Химические свойства водорода и применение

Дата: ______________
|
8 -41 |
Химические свойства водорода и применение |
|
ТЕМА |
|
|
ЦЕЛЬ |
Знать химические свойства водорода, уметь записывать уравнения реакции взаимодействия водорода с простыми и сложными веществами, решать задачи на объемные отношения газов |
|
СОДЕРЖАНИЕ |
Химические свойства водорода |
|
ТЕРМИНЫ |
- |
|
ОБОРУДОВАНИЕ |
Таблица Д.И.Менделеева, интерактивная доска |
|
ДОМ ЗАДАНИЕ |
§32 пересказ №5-№9 стр.88-89 |
ПЛАН УРОКА.
Опрос домашнего задания
** Соединения металлов с водородом (они называются гидридами металлов) представляют собой твердые вещества. Гидриды металлов можно получать непосредственно из металла и водорода:
![]()
Гидриды бурно реагируют с водой с образованием газообразного водорода:
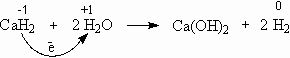
Это еще один удобный способ получения газообразного водорода. Источником водородных атомов являются как гидрид металла, так и вода. Поэтому для получения 1 м3 водорода необходимо всего 0,94 кг гидрида кальция, в то время как для получения того же количества газа действием металлов на кислоты требуется 2,5 кг железа или 2,9 кг цинка.
Соединения водорода с неметаллами в большинстве являются газами. Исключение составляет вода. Такое резкое отличие воды от соседей по таблице 7-1 объясняется существованием между молекулами воды особого вида химической связи – водородной. Об этом более подробно рассказывается в следующем параграфе.
Из всех соединений водорода одним из важнейших является аммиак, который получают реакцией водорода с азотом при высокой температуре, давлении и в присутствии катализатора:
![]()
Это один из немногих химических процессов, позволяющих связывать довольно инертный атмосферный азот. В дальнейшем из более активного в химическом отношении аммиака получают множество азотистых соединений – азотную кислоту, красители, взрывчатые вещества, азотные удобрения.
Восстановительные свойства водорода используют для получения чистых металлов из их оксидов. Например, при нагревании оксида меди CuO в токе водорода образуется вода и порошок металлической меди:
![]()
Для некоторых очень тугоплавких металлов восстановление их оксидов водородом оказывается удобным и экономичным способом получения. Например, металл вольфрам, из которого делают нити лампочек накаливания, получают с помощью реакции:
WO3 + 3 H2 = W + 3 H2O
Металл получается в виде порошка, который затем можно прессовать в готовые изделия. После спекания такие изделия не требуют дальнейшей обработки. Этот способ получения металлов и деталей из них называется порошковой металлургией.
Важной является также реакция горения водорода. Можно ожидать, что реакция водорода с таким хорошим окислителем, как кислород, протекает с большим выделением энергии. Это действительно так. Приведем количество энергии, образующейся при сжигании 1 кг различных топлив, включая водород:
Водород 110 000 – 130 000 кДж
Бензин 45 000 – 43 000 кДж
Уголь 33 000 кДж
Дрова 10 000 кДж
Таким образом, водород является чрезвычайно теплотворным химическим топливом. Кроме того, при сжигании водорода образуется только вода, в то время как другие топлива загрязняют атмосферу оксидами углерода, азота и несгоревшими остатками топлива.
Водород используется в качестве горючего в современной ракетной технике. Российская ракета-носитель "Энергия" способна выводить на орбиту более 100 тонн различных грузов благодаря водородно-кислородным двигателям. В ее баках находятся жидкий кислород и жидкий водород.
Вы уже знаете, что смеси водорода с кислородом называются гремучим газом и взрываются от малейшей искры. Поэтому работа с водородом в качестве топлива требует таких мер предосторожности, которые бы исключали возможность взрыва. Современная техника позволяет достичь высокого уровня безопасности, но история знает трагедии, связанные со взрывами водорода.
В первой половине века в разных странах было построено большое
количество  летательных аппаратов легче
воздуха – дирижаблей.
летательных аппаратов легче
воздуха – дирижаблей.
Дирижабли – это управляемые аэростаты с сигарообразной оболочкой, наполненной водородом. Большой объем водорода в оболочке обеспечивал высокую грузоподъемность этих воздушных кораблей. На снимке вы видите один из первых дирижаблей небольшого размера, но крупнейшие пассажирские дирижабли 30-х годов XX века могли перевозить до 100 человек на очень большие расстояния. На этих летательных аппаратах были комфортабельные каюты, рестораны, душевые, прогулочные палубы и т.д. Такие дирижабли совершали регулярные рейсы из Европы в Америку.
Однако большое количество энергии, выделяющееся в реакции водорода с кислородом, таит в себе огромную опасность. 6 мая 1937 года крупнейший в мире пассажирский дирижабль "Гинденбург", прилетевший из Германии в Нью-Джерси (США), взорвался и рухнул на землю от искры, проскочившей между причальной мачтой и корпусом дирижабля. На фотографии ниже запечатлен этот трагический момент. Во многом именно из-за этой катастрофы строительство пассажирских дирижаблей вскоре прекратилось.

В настоящее время водород не применяют для наполнения аэростатов и других летательных аппаратов легче воздуха. Для этих целей используют более дорогой, но зато безопасный газ гелий.
Задачи.
7.6. Требуется получить 159 г меди из оксида меди CuO. Сколько граммов воды необходимо разложить электролизом, чтобы получить водород для проведения этого превращения?
7.7. Вольфрам – редкий и дорогой металл, используемый при изготовлении нитей для лампочек накаливания. Высокие требования к чистоте вольфрама заставляют получать его восстановлением оксида WO3 таким относительно дорогим восстановителем, как водород. Если получать водород реакцией железа с серной кислотой Fe + H2SO4 = H2 + FeSO4, то сколько потребуется железа и серной кислоты для получения 100 кг вольфрама?
** 7.8 (НГУ). Напишите формулы всех известных вам соединений водорода с элементами 2-го периода. Найдите среди них те, которые реагируют между собой и напишите уравнения реакций.
** 7.9. С помощью каких химических реакций можно получить аммиак NH3 из метана CH4? Напишите схему превращения и рассчитайте, сколько молей аммиака можно теоретически получить из 1 моля метана.
Для закрепления материала выполнить задания по рабочей тетради и по задачнику
Домашнее задание: §32 пересказ №5-№9 стр.88-89
© ООО «Знанио»
С вами с 2009 года.
![]()

