|
Дата: ____________ |
|||
|
8 – 7-8 |
Количество вещества. Моль. Число Авогадро. Молярная масса |
|
|
ТЕМА |
|
|
|
ЦЕЛЬ |
Формировать представление о количестве вещества, знать обозначение количества вещества, измерение количества вещества, чему равен число Авогадро, обозначение молярной массы и ее измерение, формировать способы решения задач на количество вещества |
|
|
СОДЕРЖАНИЕ |
Количество вещества. Моль. Число Авогадро. Молярная масса |
|
|
ТЕРМИНЫ |
Количество вещества. Моль. Молярная масса |
|
|
ОБОРУДОВАНИЕ |
Таблица Д.И.Менделеева |
|
|
ДОМ ЗАДАНИЕ |
§9 пересказ, №5-№7 стр.47 |
|
ПЛАН УРОКА.
Проверка домашнего задания
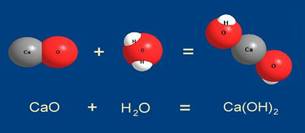
В предыдущих параграфах нам было удобно рассматривать реагенты и продукты в виде отдельных молекул. Мы выяснили, что для полного протекания реакции достаточно на одну молекулу СаО взять тоже одну молекулу Н2О:
А для реакции метана с кислородом на каждую молекулу метана надо брать две молекулы кислорода:
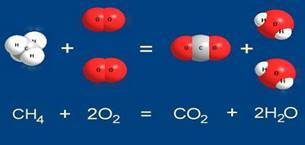
В воздухе всегда содержится достаточно кислорода для того, чтобы реакция горения метана протекала именно так, как она записана:
СН4 + 2О2 = СО2 + 2Н2О
Но представим на минуту, что нам надо сконструировать газовую горелку для подводных работ или двигатель космического корабля. Эти устройства должны работать без доступа атмосферного воздуха. Поэтому в таких конструкциях не обойтись без точного подсчета молекул реагентов, поступающих в зону горения (то есть в химическую реакцию).
Например, если в камеру сгорания космического двигателя попадает больше молекул топлива, чем может прореагировать с окислителем, то это ведет к снижению тяги двигателя и к бесполезному расходованию части драгоценного топлива.
Но для начала возьмем не “космическую” реакцию, а что-нибудь попроще. Допустим, мы знаем, что вещества А и Б реагируют между собой с образованием продукта В. Другими словами, нам известно уравнение химической реакции:
А + Б = В
Примером может послужить уже встречавшаяся нам простая реакция:
СаО + Н2О = Са(ОН)2
Остается взять нужные количества А (CaO) и Б (H2O) и провести реакцию. Итак, сколько нужно взвесить А и сколько Б, чтобы реакция прошла до конца и не осталось никаких исходных веществ?
Если мы возьмем одинаковые по весу образцы А и Б, то цели не достигнем – продукт В обязательно будет загрязнен одним из исходных веществ. Почему это произойдет?
Дело в том, что А и Б – разные молекулы и различаются по массе. Значит, в 1 г вещества А – одно количество молекул, а в 1 г вещества Б – другое количество молекул. При реакции между ними обязательно останутся неизрасходованными молекулы одного из исходных веществ.
Для работы химикам удобно брать вещества такими порциями, которые содержали бы одинаковое количество молекул. Допустим, химик взял порцию СаО, в которой содержится N молекул этого вещества. Затем берется некая порция воды, в которой тоже N молекул. Смешав эти две порции реагентов, химик получает порцию продукта, в которой будет тоже ровно N молекул Са(ОН)2:
СаО + Н2О = Са(ОН)2
N молекул СаО, N молекул Н2О, N молекул Са(ОН)2
После окончания реакции не останется ни СаО, ни Н2О, потому что порции реагентов содержали одинаковое число молекул – по N штук.
Легко сосчитать определенное количество яблок, конфет или монеток, но молекулы отсчитывать затруднительно.
Зато это можно сделать путем взвешивания вещества. Допустим, нам известно, что N молекул весят М г. Достаточно взвесить на весах М г этого вещества, чтобы быть уверенным, что мы отмерили N молекул этого вещества. Но как узнать величину М в граммах?
Масса молекул складывается из масс составляющих ее атомов. Относительные атомные массы (атомные веса) элементов мы можем узнать из Периодической таблицы. Атомный вес Са – 40 а.е.м., а атомный вес кислорода – 16 а.е.м. Следовательно, молекулярная масса (молекулярный вес) молекулы СаО составит:
40 а.е.м. (Ca) + 16 а.е.м. (O) = 56 а.е.м. (CaO)
Допустим, мы решили взять для проведения реакции 10 молекул СаО и 10 молекул Н2О. Удобно ли нам будет работать с такими малыми количествами вещества? Разумеется, нет.
Тогда попробуем взвесить на весах по миллиону (1000000) молекул каждого реагента. В принципе, можно сосчитать, сколько весит порция из миллиона молекул СаО. Мы знаем, что 1 а.е.м. = 1,67.10-27 кг (это значение нам встречалось в таблице 2-1 из главы 2).
Перейдем для удобства из килограммов в граммы. В граммах вес 1 а.е.м. будет таким: 1,67.10-24 г. Нетрудно умножить эту величину на 56 (число а.е.м. в молекуле СаО).
Получим:56.(1,67.10-24 г) = 93,5.10-24 г. Теперь умножим массу одной молекулы на число самих молекул (миллион). Мы получим вес (в граммах) порции из миллиона молекул СаО:
93,5.10-24 г× 1 000 000 = 93,5× 10-18 г.
Если вспомнить, что наибольшая точность обычных лабораторных весов составляет 1 мг (это всего лишь 10-3 г), то обнаружится, что и миллион молекул СаО - совсем неудобная “порция” молекул для взвешивания на весах.
Значит, надо выбрать для работы не 1 000 000 молекул, а какую-то другую, более удобную порцию из N молекул. Видимо, это число N должно быть намного больше миллиона молекул.
** Попробуем найти такое число молекул (N), с которым было бы удобно работать. Это может быть не обязательно число молекул именно СаО или Н2О. Число N должно быть таким, чтобы с его помощью было удобно "отмерять" взвешиванием ЛЮБЫЕ молекулы, атомы и вообще частицы, вес которых очень мал (измеряется в атомных единицах массы).
Возьмем одну из таких частиц – протон. Он имеет массу 1 а.е.м. (округленно). Такую же массу имеет нейтрон.
Посчитаем, какое количество протонов (или нейтронов) окажется в 1 г этих частиц. Для этого составим пропорцию:
1 частица массой 1 а.е.м – весит 1,67.10-24 г
N частиц – весят 1 г.
Отсюда:
![]() частиц.
частиц.
Оказывается, очень удобной является порция из 6× 1023 частиц (молекул, атомов, ионов и т.д.). Обозначим ее буквой N (чтобы отличать от любых других порций N). Если N равно именно такому числу частиц (6× 1023), то их вес в граммах числено равен весу этих частиц в а.е.м.
Другими словами, чтобы перейти от единиц а.е.м. к граммам, достаточно увеличить шкалу измерений в 6.1023 раз!
6× 1023 а.е.м. = 1 г
Число N = 6.1023 является как бы переводным коэффициентом из шкалы а.е.м. в шкалу граммов. Например, молекулярный вес CaO составляет 56 а.е.м. Взвесив на весах 56 г оксида кальция СаО, мы тем самым "отсчитали" 6.1023 молекул СаО. Чтобы теперь "отсчитать" для нашей реакции точно такое же количество молекул Н2О, следует взвесить на весах ровно 18 г воды:
1+1 а.е.м (вес двух атомов Н) + 16 а.е.м. (вес одного атома О) = 18 а.е.м. (H2O)
18 а.е.м. .6.1023 = 18 г.
Понятно, что взвесив 18 г воды, мы тем самым берем нужные нам 6.1023
 молекул
воды.
молекул
воды.
Смешав точно 56 г СаО и 18 г Н2О, мы смешиваем порции молекул, в которых число молекул CaO и H2O абсолютно одинаково. Тем самым мы обеспечиваем полное протекание реакции. В продукте реакции – Са(ОН)2 – не должно остаться непрореагировавших молекул CaO и H2O.
Такие порции из 6.1023 структурных единиц вещества (атомов, молекул, ионов) называются МОЛЕМ вещества. Таким образом, МОЛЬ – это мера количества вещества. Более точное, не округленное количество частиц вещества в 1 моле составляет 6,022045.1023 частиц. С точностью до второго знака после запятой (6,02.1023) эту величину нужно хорошенько запомнить.
МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Примеры:
1 моль(1М) воды = 6.1023 молекул Н2О,
1 моль (1 М) железа = 6.1023 атомов Fe,
1 моль (1 М) хлора = 6.1023 молекул Cl2,
1 моль (1 М) ионов хлора Cl- = 6.1023 ионов Cl-.
1 моль (1 М) электронов е- = 6.1023 электронов е-.
Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием.
Разумеется, если мы увеличим или уменьшим взятое нами количество воды (18 г) и оксида кальция (56 г) в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз.
Допустим, 1,8 г воды полностью прореагируют с 5,6 г СаО, а 180 г Н2О тоже без остатка прореагируют с 560 г СаО. Другими словами 0,1 моль воды прореагирует с 0,1 моль СаО, а 10 моль воды прореагируют с 10 моль СаО и т.д.
Как мы видим, масса одного моля какого-нибудь вещества (в граммах) числено совпадает с молекулярным или атомным весом этого вещества (в а.е.м). Это очень удобно для химических расчетов.
Например, молекулярный вес метана CH4 составляет (12 + 4) = 16 а.е.м. Тогда для реакции горения метана:
CH4 + 2O2 = CO2 + 2H2O
справедливо, что из 1 моля метана получаются 2 моля воды и что из 16 г метана получается 2× 18 = 36 г воды.
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она бозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
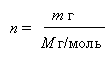
Число молей в m г вещества, например для H2O составляет: n = m/18, для Na – m/23 и так далее.
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n×M.
Например, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 г.
Молярная масса всегда совпадает с молекулярным весом (или атомным весом - есл вещество состоит не из молекул, а из атомов). В таблице 5-1 для иллюстрации приведены молярные массы М для нескольких веществ разного строения, состоящих либо из молекул, либо только из атомов.
Таблица 5-1. Молярные массы различных веществ.
|
Вещество |
Молекулярная или атомная масса (округлена) |
молярная масса М |
|
Вода Н2О |
18 а.е.м |
18 г/моль |
|
СаО |
56 а.е.м. |
56 г/моль |
|
Углерод 12С |
12 а.е.м. |
12 г/моль |
|
Медь Cu |
63,5 a.e.м. |
63,5 г/моль |
|
Атом хлора Сl |
35,5 а.е.м. |
35,5 г/моль *) |
|
Ион хлора Cl- |
35,5 а.е.м |
35,5 г/моль |
|
Молекула хлора Cl2 |
71 а.е.м |
71 г/моль *) |
*) Атомарный хлор и молекулярный хлор - разные вещества, обладающие разными физическими и химическими свойствами.
Разумеется, в таблице 5-1 каждая из указанных в правой колонке “порций” вещества содержит 6,02× 1023 мельчайших частиц этих веществ.
Молярная масса М – постоянная величина для каждого конкретного вещества. Без не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Термины “моль” и “молекула” отдаленно связаны между собой. Моль происходит от латинского moles, что означает количество, счетное множество, а также масса. Термин “молекула” является уменьшительной формой этого слова и означает “маленькая масса”. Таким образом моль – это такое количество вещества, которое можно считать “большой массой”, состоящей из 6,02× 1023 “маленьких масс”.
Задачи.
5.7. Пользуясь значениями атомных весов элементов из Периодической таблицы, рассчитайте с точностью до целых чисел молекулярный вес (а.е.м) и молярную массу (г) для следующих веществ: NaF, N2, NaOH, SO2. Сколько молекул содержится в 1 моле каждого из этих веществ?
5.8. Сколько молей кислорода содержится в 128 г кислорода?
5.9. При грозовых разрядах в атмосфере происходит следующая реакция: N2 + O2 ® NO2. Уравняйте реакцию. Сколько молей кислорода потребуется для полного превращения 1 моля азота в NO2? Cколько это будет граммов кислорода? Сколько граммов NO2 образуется?
5.10. В стакан налили 180 г воды. Сколько молекул воды в стакане? Сколько это молей H2O?
5.11. Между собой прореагировали 1 моль кальция и 1 моль хлора. Сколько молей CaCl2 получилось? Какова масса получившегося хлорида кальция CaCl2 ?
** 5.12. Между собой реагируют 4,0 г Ca и 14,2 г Cl2. Какие вещества и в каком количестве (в молях и в граммах) останутся после окончания реакции?
5.13. Смешали 2 моля водорода и 1 моль кислорода. Смесь взорвали. Сколько молей воды получилось? А сколько граммов?
** 5.14. Смешали 4 г водорода и 64 г кислорода. Смесь взорвали. Сколько граммов воды получилось? Сколько граммов кислорода осталось не израсходованным?
** 5.15 (НГУ). Определите количество вещества (моль) и массу порции пропина C3H4, которая содержит 6,02.1021 атомов углерода. Какова масса одной молекулы пропина?
Домашнее задание: §17 пересказ, №1-№9 стр.47
© ООО «Знанио»
С вами с 2009 года.
![]()