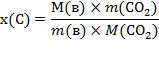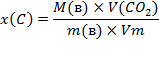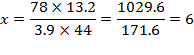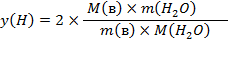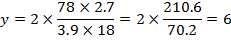Методические рекомендации по выполнению лабораторных работ и практических занятий по химии по программам подготовки специалистов среднего звена

 Государственное автономное
профессиональное
Государственное автономное
профессиональное
образовательное учреждение
«КРАЕВОЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ И ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ «ХИМИЯ»
по программам подготовки специалистов среднего звена
2016
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ И ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ «ХИМИЯ» для студентов по программам подготовки специалистов среднего звена – Чернушка: ГАПОУ «Краевой политехнический колледж», 2016. – 53 с.
Рассмотрено на заседании ЦМК преподавателей естественнонаучного цикла (протокол № 2 от 28.10.2015)
Методические рекомендации по выполнению лабораторных работ и практических занятий разработаны для студентов по программам подготовки специалистов среднего звена по специальностям: 13.02.11 Техническая эксплуатация и обслуживание электрического и электромеханического оборудования (по отраслям), 21.02.01 Разработка и эксплуатация нефтяных и газовых месторождений, 21.02.02 Бурение нефтяных и газовых скважин, 21.02.03 Сооружение и эксплуатация газонефтепроводов и газонефтехранилищ; по программам подготовки квалифицированных рабочих, служащих: 15.01.05 Сварщик (электросварочные и газосварочные работы) по учебной дисциплине «Химия»
Составитель:
Султанова Н. В., преподаватель ГАПОУ «Краевой политехнический колледж»
Рецензенты:
617830, г. Чернушка, ул. Юбилейная, 10
ГАПОУ «Краевой политехнический колледж», 2016
Cодержание
|
I. Пояснительная записка |
4 |
|
1.1 Структура методических указаний 1.2 Правила выполнения лабораторных работ 1.3 Критерии оценки лабораторных работ 1.4 Правила техники безопасности при работе в кабинете химии |
5 5 5 6 |
|
II. Перечень практических и лабораторных работ |
9 |
|
III. Раздел «Неорганическая химия» 3.1 Практическое занятие №1 3.2 Лабораторная работа №1 3.3 Практическое занятие №2 3.4 Лабораторная работа № 2 3.5 Лабораторная работа №3 3.6 Лабораторная работа №4 3.7 Лабораторная работа №5 3.8 Лабораторная работа №6 |
10 10 13 16 21 23 26 29 32 |
|
IV. Раздел «Органическая химия» 4.1 Практическое занятие №3 4.2 Практическое занятие №4 4.3 Лабораторная работа №7 4.4 Лабораторная работа №8 4.5 Лабораторная работа №9 |
36 36 39 45 48 51 |
|
V.Список литературы |
53 |
Пояснительная записка
Настоящие методические рекомендации по выполнению лабораторных работ и практических занятий по дисциплине «Химия» разработаны на основе Федерального государственного образовательного стандарта среднего общего образования и примерной программы учебной дисциплины «Химия».
Методические рекомендации по выполнению лабораторных работ и практических занятий предназначены для студентов по программам подготовки специалистов среднего звена: 13.02.11 Техническая эксплуатация и обслуживание электрического и электромеханического оборудования (по отраслям), 21.02.01 Разработка и эксплуатация нефтяных и газовых месторождений, 21.02.02 Бурение нефтяных и газовых скважин, 21.02.03 Сооружение и эксплуатация газонефтепроводов и газонефтехранилищ; по программам подготовки квалифицированных рабочих, служащих: 15.01.05 Сварщик (электросварочные и газосварочные работы).
Лабораторные работы и практические занятия рассчитаны на 26 часов учебных занятий, включают 13 работ.
Выполнение лабораторных работ направлено на формирование у студентов следующих умений:
1 Выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ, получению конкретных веществ, относящихся к изученным классам соединений.
2 Проводить расчеты по химическим формулам и уравнениям реакций.
3 Осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации, ее представления в различных формах.
4 Использовать приобретенные знания и умения в практической деятельности и повседневной жизни.
Структура методических рекомендаций
1 Тема;
2 Цель работы;
3 Оборудование и реактивы для выполнения лабораторных (практических) работ;
4 Пояснения к работе (краткие теоретические сведения);
5 Домашнее задание для подготовки к лабораторной (практической) работе;
6 Инструкция по проведению лабораторной (практической) работы;
7 Содержание отчета;
8 Литература.
Правила выполнения лабораторных работ
При домашней подготовке к выполнению лабораторных (практических) работ студент должен повторить изученную тему.
Студенты, пропустившие занятия, выполняют лабораторные (практические) работы вовнеурочное время.
После выполнения каждой лабораторной (практической) работы студент демонстрирует результат выполнения преподавателю, отвечает на вопросы. Преподаватель на уроке оценивает работу и выставляет оценку в журнал.
Лабораторные и практические работы должны выполняться студентом индивидуально. Результатом выполнения лабораторных (практических) работ является составление лабораторного отчета, где приводятся уравнения реакций, расчеты, результаты проведенных анализов, выводы.
Критерии оценки лабораторных работ
Оценка «5» – работа выполнена в полном объеме и без замечаний.
Оценка «4» – работа выполнена правильно с учетом 2-3 несущественных ошибок исправленных самостоятельно по требованию преподавателя.
Оценка «3» – работа выполнена правильно не менее чем на половину или допущена существенная ошибка.
Оценка «2» – допущены две (и более) существенные ошибки в ходе работы, которые студент не может исправить даже по требованию преподавателя или работа не выполнена.
Правила техники безопасности при работе в лаборатории химии
I Общие положения
1 Соблюдение требований настоящей инструкции обязательно для всех устудентов, работающих в лаборатории химии.
2 К работе в лаборатории допускаются только те студенты, которые прошли инструктаж по технике безопасности в лаборатории химии.
3 Студенты могут находиться в лаборатории только в присутствии преподавателя, не допускается нахождение студентов в лаборатории химии во время его проветривания; пребывание студентов в помещении лаборантской не допускается.
4 Присутствие посторонних лиц в лаборатории химии во время эксперимента допускается только с разрешения преподавателя.
5 Студентам запрещается выносить из лаборатории и вносить в неё любые вещества без разрешения преподавателя.
6 Не допускается загромождение проходов портфелями и сумками, они должны размещаться в специально отведенном месте.
7 В лаборатории химии запрещается принимать пищу и напитки, бегать по лаборатории, шуметь и устраивать игры.
8 Во время работы в лаборатории химии студенты должны быть максимально внимательными, дисциплинированными, строго следовать указаниям преподавателя, соблюдать тишину, поддерживать чистоту и порядок на рабочем месте.
9 Студенты, присутствующие на лабораторной или практической работе без халата, непосредственно к проведению эксперимента не допускаются.
II Обеспечение безопасности перед началом работы
1 Перед проведением экспериментальной работы каждый студент должен надеть халат; студенты, имеющие длинные волосы, должны собрать их, чтобы исключить возможность соприкосновения с лабораторным оборудованием, реактивами и тем более – с открытым огнем.
2 Прежде чем приступить к выполнению эксперимента, студенты должны по методическим рекомендациям изучить и уяснить порядок выполнения предстоящей работы.
3 Студенты обязаны внимательно выслушать инструктаж преподавателя по технике безопасности в соответствии с особенностями предстоящей работы. Текущий инструктаж по технике безопасности перед лабораторной (практической) работой регистрируется собственноручно студентами в журнале инструктажей.
4 Приступать к проведению эксперимента студенты могут только с разрешения преподавателя.
III Обеспечение безопасности во время работы
1 Во время демонстрационных опытов студенты должны находиться на своих рабочих местах или пересесть по указанию преподавателя на другое, более безопасное место.
2 При выполнении лабораторных и практических работ студенты должны неукоснительно соблюдать правила техники безопасности, следить, чтобы вещества не попадали на кожу лица и рук, т.к. многие из них вызывают раздражение кожи и слизистых оболочек.
3 Вещества в лаборатории запрещается пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы легким движением ладони, нельзя наклоняться к сосуду и вдыхать полной грудью.
4 При выполнении лабораторных работ студенты должны точно повторять действия преподавателя, показывающего, как нужно правильно проводить эксперимент.
5 Подготовленный к работе прибор студенты должны показать преподавателю или лаборанту.
6 Реактивами необходимо пользоваться следующим образом: сухое вещество брать шпателем, жидкие реактивы – капельницей или наливая раствор из склянки; держать склянку этикеткой к ладони (чтобы капли раствора не повредили надпись). Избыток взятого вещества нельзя ссыпать и сливать обратно в склянку с реактивом, для этой цели служат санитарные склянки. Все работы с вредными веществами проводятся в вытяжном шкафу.
7 По первому требованию преподавателя студенты обязаны немедленно прекратить выполнение работы (эксперимента). Возобновление работы возможно только с разрешения преподавателя.
8 Для нагревания жидкостей разрешается использовать только тонкостенную посуду. Пробирки для нагревания жидкостей запрещается наполнять более чем на одну треть их объема. Отверстие пробирки при нагревании нельзя направлять в сторону студентов и на себя.
9 Студентам запрещается самостоятельно проводить любые опыты, не предусмотренные в данной работе.
10 О разлитых и рассыпанных реактивах студенты должны немедленно сообщить преподавателю или лаборанту. Студентам запрещается самостоятельно убирать любые вещества.
11 О всех неполадках в работе оборудования, водопровода, электросети и т.п. студенты обязаны сообщить преподавателю или лаборанту. Студентам запрещается самостоятельно устранять неисправности.
12 При получении травм (порезы, ожоги и т п.), а также при плохом самочувствии студенты должны немедленно сообщить об этом преподавателю или лаборанту.
13 Во время работы студентам запрещается переходить на другое рабочее место без разрешения преподавателя.
14 Студентам запрещается брать вещества и какое-либо оборудование с не задействованных на данный момент рабочих мест.
15 Недопустимо во время работы перебрасывать друг другу какие-либо вещи (учебники, тетради, ручки и др.).
16 Запрещается оставлять без присмотра включенные нагревательные приборы, а также зажигать спиртовки без надобности.
IV Обеспечение безопасности по окончании работы
1 Уборка рабочих мест по окончании работы производится в соответствии с указаниями преподавателя.
2 Студенты должны привести в порядок свое рабочее место, сдать преподавателю или лаборанту дополнительные реактивы и оборудование, выданные в лотке.
3 По окончании лабораторной и практической работ студенты обязаны вымыть руки с мылом.
V Аварийные ситуации
При возникновении аварийных ситуаций во время занятий в лаборатории химии (пожар, появление посторонних запахов) не допускать паники и подчиняться только указаниям преподавателя.
Перечень лабораторных работ и практических занятий
|
Наименование тем
|
Номер и наименование практических работ |
Кол-во часов |
|
Раздел 1 Общая и неорганическая химия |
16 |
|
|
Тема 1.2 Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома |
Практическое занятие №1 Составление электронных формул атомов элементов и графических схем. Характеристика элементов. Определение элемента по его электронной формуле |
2 |
|
Тема 2.3 Строение вещества |
Лабораторная работа№1 Приготовление и изучение дисперсных систем |
2 |
|
Тема 1.4 Вода Растворы. Электролитическая диссоциация |
Практическое занятие №2 Составление уравнений реакций в молекулярной и ионной формах. Приготовление раствора заданной концентрации |
2 |
|
Тема 1.5 Классификация неорганических соединений |
Лабораторная работа№2 Изучение химических свойств кислот |
2
|
|
Лабораторная работа№3 Изучение химических свойств оснований |
2
|
|
|
Лабораторная работа №4 Испытание растворов солей индикаторами. Общие свойства солей |
2 |
|
|
Тема 1.7 Металлы и неметаллы |
Лабораторная работа №5 Общие свойства металлов. |
2 |
|
Лабораторная работа №6 Получение, собирание и распознавание газов. Качественные реакции на хлорид-, сульфат-, карбонат-анионы |
2
|
|
|
Раздел 2 Органическая химия |
10 |
|
|
Тема 2.2 Углеводороды и их природные источники |
Практическое занятие №3 Решение задач. Нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов |
2
|
|
Практическое занятие №4 Сравнение свойств синтетических каучуков |
2 |
|
|
Тема 2.3Кислородсодержащие органические соединения |
Лабораторная работа №7 Исследование свойств уксусной кислоты. Решение экспериментальных задач на распознавание органических соединений |
2
|
|
Лабораторная работа №8 Изучение химических свойств глюкозы, сахарозы, крахмала |
2 |
|
|
Тема 2.4 Азотсодержащие органические соединения. Полимеры |
Лабораторная работа №9 Изучение свойств белков. Цветные реакции |
2 |
|
Итого |
26 |
|
Раздел 1. Неорганическая химия
Практическое занятие №1
Тема: Составление электронных формул атомов элементов и графических схем. Характеристика элементов. Определение элемента по его электронной формуле
Цель: продолжить развитие умений составлять схему строения атома, электронные, графические формулы; определять положение элемента в периодической системе и давать характеристику элемента.
Пояснения к работе
Краткие теоретические сведения
Порядковый номер показывает заряд ядра атома и число электронов. Номер периода показывает количество энергетических уровней. Номер группы показывает количество электронов на внешнем уровне и валентность.
Электроны в атомах, обладающие наименьшим запасом энергии, находятся на первом энергетическом уровне.
Максимальное количество
электронов на энергетическом уровне
определяется по формуле N=2n2, поэтому
на первом уровне -2е1 s2
на втором уровне - 8е2s22p6
на третьем уровне- 18е3s23p63d10
на четвертом -32е4s24p64d104f14
Электроны, двигаясь вокруг ядра, образуют «электронное облако».
Электронное облако может иметь разную форму. Электроны, которые в движении образуют облако сферической формы, принято называть sэлектронами, в виде гантелеобразной формы — р-электроны, есть d- и f-электроны. На одной орбитали может находиться лишь два электрона.
На одном и том же уроне могут находиться электроны с различной формой облаков. Поэтому энергетические уровни принято разделять на подуровни. Числоэнергетических подуровней соответствует номеру энергетического уровня (номеру периода).
Каждый энергетический уровень в атоме начинается с s-подуровня. s-электроны занимают одну орбиталь, s-электронов всего два. p-электроны занимают три орбитали, начиная со второго уровня, р-электронов всего шесть. На третьем энергетическом уровне появляются d-электроны, они занимают 5 орбиталей, а максимальное число этих электронов 10.
В зависимости от состояния электронов в атомах, различаютs-, р-, d-, f-элементы и соответствующие им s-, p-, d-, f-подуровни.В зависимости от того, какой подуровень заполняет очередной электрон, соответственно различают s-, p-, d-, f- элементы.
В главных подгруппах находятся только s-, р-элементы, в побочных –d-элементы, лантаноиды и актиноиды относятся к f-элементам.
План характеристики химического элемента:
1 Название химического элемента
2 Положение в периодической системе:
а) период; б) группа; в) подгруппа; г) порядковый номер; д) атомная масса
3 Металл или неметалл
4 Формула соединений с высшей валентностью элемента:
а) оксида; б) водородного соединения; в) кислоты или основания; г) соли
5 Строение атома:
а) заряд ядра; б) число электронов (е); в) протонов (р); г) нейтронов (n)
6 Схема строения атома:
а) электронная формула;
б) графическая формула.
Домашнее задание для подготовки к практическому занятию
1 Самостоятельно изучить методические рекомендации по проведению практического занятия.
2 Подготовить на контрольные вопросы.
3 Прочитать текст параграфа 2.1 и 2.2 глава 2 (с. 18-28), выполнить упражнение 6 стр. 28.
4 По каким признакам различают s-, p-, d-, f- элементы?
Инструкция по проведению практического занятия
1 Определить, в атоме какого химического элемента число электронов на энергетических уровнях соответствует ряду чисел 2, 8, 13, 1? Написать электронную и электронно-графическую формулы.
2 Какое число s-, р-электронов образует внешний энергетический уровень атома хлора? Составить электронную и электронно-графическую формулы.
3 Общая формула оксида химического элемента третьего периода R2O. Какова схема строения его атома и формула, соответствующая высшему оксиду, гидроксиду или кислоте?
4 Какой заполненный энергетический уровень характеризует электронная формула ns2np6nd10?
5 Из предложенных ниже электронных формул:
а) 1s22s22p63s23p64s2
б) 1s22s22p63s23p63d54s2
в) 1s22s22p63s23p63d84s2
г) 1s22s22p2
выбрать электронную формулу, соответствующую:
1) атому никеля; 2) d-элементам седьмой группы;
3) s-элементам; 4) элементам главной подгруппы четвертой группы.
6 Дать характеристику химическому элементу. Индивидуальное задание получить у преподавателя.
Содержание отчета (отчет оформить в виде ответов на поставленные вопросы)
Контрольные вопросы
1 На основе теории строения атомов пояснить, почему группы элементов разделены на главную и побочную подгруппы?
2 Почему лантаноиды и актиноиды обладают сходными химическими свойствами?
3 Почему число элементов в периодах соответствует ряду чисел 2-8-18-32? Объяснить эту закономерность с учетом расположения электронов по энергетическим уровням.
4 Объяснить физический смысл периодической системы: порядковый номер, номер периода и группы.
5 Дать формулировку периодического закона.
Литература
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.18-28
Лабораторная работа№1
Тема: Приготовление и изучение дисперсных систем
Цель: приготовить дисперсные системы и исследовать их свойства, решать задачи на определение массовой доли компонентов смеси.
Оборудование и реактивы: пробирки, колбы, стакан, фонарик, темная бумага, капиллярная трубка, дистиллированная вода, карбонат кальция CaCO3, растительное масло, глицерин, мука, раствор мыла, этиловый спирт.
Пояснения к работе
Краткие теоретические сведения
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные (растворы) и гетерогенные (дисперсные) системы.
Дисперсными - называют гетерогенные системы, в которых одно вещество - дисперсная фаза(их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого - дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы:
- грубодисперсные - (взвеси) с размерами частиц более 100нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это - эмульсии, суспензии, аэрозоли;
- тонкодисперсные - с размерами частиц от 100 до 1нм. Фаза и среда в таких системах отстаиванием разделяются с трудом. Это: золи (коллоидные растворы – «клееподобные») и гели (студни).
|
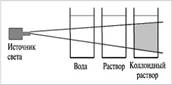
Коллоидные системыпрозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся «светящейся дорожке» – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. |
Эффект Тиндаля |
|
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса. Различают 8 типов дисперсных систем (д/с + д/ф) - Г+Ж→аэрозоль (туман, облака, карбюраторная смесь бензина с воздухом в ДВС; - Г+ТВ→аэрозоль (дым, смог, пыль в воздухе); - Ж+Г→пена (газированные напитки, взбитые сливки); - Ж+Ж→эмульсия (молоко, майонез, плазма крови, лимфа, цитоплазма); - Ж+ТВ→золь, суспензия (речной и морской ил, строительные растворы, пасты); - ТВ+Г→твердая пена (керамика, пенопласт, поролон, пористый шоколад); - ТВ+Ж→гель (желе, желатин, косметические и медицинские мази, помада); - ТВ+ТВ→твердый золь (горные породы, цветные стекла). |
|
Эмульсии - грубодисперсные системы из взаимно нерастворимых жидкостей. В таких системах одна из жидкостей (дисперсная фаза) взвешена в другой (дисперсионной среде) в виде капелек.Так, к числу эмульсий относят бензин, керосин, бензол, масла минеральные, животные, растительные и другие неполярные жидкости, которые гидрофобны.
Если ввести в систему какое-либо поверхностно-активное вещество, способное адсорбироваться на поверхности капелек эмульсии, то оно способно препятствовать их слиянию. Подобные вещества называют стабилизаторами или эмульгаторами. При этом суммарная поверхность системы останется неизменной, а образующаяся эмульсия станет устойчивой.
Пены – грубодисперсные системы, в которых дисперсная фаза - газ, а дисперсионная среда -жидкость в виде тонких пленок. Устойчивость пен характеризуется временем существования ее определенного объема. Чистые жидкости, как правило, не дают пен. С повышением температуры устойчивость пены уменьшается. Чтобы получить устойчивые пены, необходимы эффективные стабилизаторы - пенообразователи. Ими могут быть мыла, высокомолекулярные соединения (желатин). Устойчивость пен зависит от прочности пленок, разделяющих пузырьки газа. Хорошие пенообразователи - это вещества, способные давать прочные пленки. Если эти пленки способны отвердевать, то получаются твердые пены (пенобетоны, пенопласты, хлеб и пр.).
Разрушения пен достигают механическим воздействием на пену или физико-химическим путем, заменяя в пленке механически прочное вещество другим веществом, хорошо адсорбирующимся, но не дающим прочных пленок. Так, например, одна капля сложного эфира полностью разрушает пену в стакане пива.
Домашнее задание при подготовке к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведению данной лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
Инструкция по проведению лабораторной работы
Опыт №1.Приготовление суспензии карбоната кальция в воде и изучение ее свойств
1 В пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция.
2 Пробирку закрыть резиновой пробкой и встряхнуть пробирку несколько раз.
Опыт №2.Приготовление эмульсии масла в воде и изучение ее свойств
1 В пробирку влить 4-5 мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть пробирку несколько раз.
2 Изучить свойства эмульсии.
3 Добавить 2-3 капли глицерина. Что произошло после его добавления?
Опыт №3. Приготовление коллоидного раствора и изучение его свойств
1 В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать.
2 Пропустить через раствор луч света фонарика на фоне темной бумаги.
3 Наблюдается ли эффект Тиндаля?
Опыт №4. Получение пены
1 Налить в колбу 15 мл воды и через капиллярную трубку продуть воздух через воду, пронаблюдать за образованием и разрушением пены.
2 Заменить воду раствором мыла и провести процедуру ещё раз. Пронаблюдать за образованием и разрушением пены.
3 К полученной мыльной пене добавить несколько капель этилового спирта.
Наблюдения: Какая пена образуется в первой и во второй пробирке: устойчивая или неустойчивая? Что произошло с пеной, когда в неё добавили спирт? Почему?
Содержание отчета: отчет представить в виде таблицы 1 и ответов на контрольные вопросы
Таблица 1
|
№ опыта |
Внешний вид и видимость частиц |
Способность осаждаться (осаждается, не осаждается) и способность к коагуляции (высокая, низкая) |
Особые свойства |
|
|
|
|
|
Контрольные вопросы:
1 Что такое дисперсная система? По каким признакам они делятся на грубо- и тонкодисперсные системы?
2 Что такое эффект Тиндаля и коагуляция?
3 Что такое эмульгаторы или стабилизаторы?
4 Что такое пена? От чего зависит устойчивость пены? Как можно разрушить пену?
5 Решение задачи на определение массовой доли компонентов смеси и примесей: Какую массу вещества оксида кальция можно получить при термическом разложении 600г известняка, содержащего 10% примесей?
Литература
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.48-54
Практическое занятие №2
Тема: Составление уравнений реакций в молекулярной и ионной формах. Приготовление раствора заданной концентрации.
Цель: закрепить умение составлять полные и сокращенные ионные уравнения реакций, готовить растворы с заданной концентрацией, закрепить умение работать с весами, мерной посудой, химическими веществами.
Оборудование и реактивы: мерный цилиндр, химический стакан 150 и 50мл, стеклянная палочка, электронные весы, карбонат натрия Na2CO3, хлорид железа FeCl3, хлорид алюминия AlCl3, сульфат меди CuSO4.
Пояснения к работе
Краткие теоретические сведения
Часть 1
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Правила составления ионных уравнений реакций
1Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют, их записывают в молекулярном виде.
2В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4 Вещество, выпавшее в осадок, выделяется стрелкой вниз ¯, выделение газа отмечают стрелкой вверх.
5Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Порядок составления ионных уравнений реакции
1 Записывают молекулярное уравнение реакции:
MgCl2+2AgNO3→2AgCl+Mg(NO3)2
2 Определяют растворимость каждого из веществ с помощью таблицы растворимости:
РРНР
MgCl2+2AgNO3 → 2AgCl+Mg(NO3)2
3Записывают полное ионное уравнение реакции
Mg2++2Cl-+2Ag++2NO3- → 2AgCl↓ +Mg2++2NO3-
4Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg2++2Cl-+2Ag++2NO3-
→2AgCl↓ +Mg2++2NO3-
Ag++Cl-→AgCl↓
Условия необратимости реакций ионного обмена
1Если образуется осадок (↓) (смотри таблицу 1)
Pb(NO3)2+2KI→PbI2↓+2KNO3
Pb2++ 2I-→PbI2↓
2Есливыделяетсягаз (↑)
Na2CO3+H2SO4→Na2SO4+H2O+CO2↑
CO32-+2H+ →H2O+CO2↑
3Если образуется малодиссоциированное вещество (H2O)
Ca(OH)2+2HNO3→Ca(NO3)2+2H2O
H+ +OH- →H2O
4Если образуются комплексные соединения (малодиссоциированные комплексные ионы)
CuSO4•5H2O+4NH3→[Cu(NH3)4]SO4+5H2O
Cu2++4NH3→Cu(NH3)4]2+
В тех случаях, когда нет ионов, которые могут связываться между собой с образованиемосадка, газа, малодиссоциированных соединений(H2O) или комплексных ионов реакции обмена обратимы ←.
Таблица 1 Таблица растворимости солей, кислот и оснований в воде
|
Катион анион |
H+ |
NH4+ |
K+ |
Na+ |
Ag+ |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Cu2+ |
Hg2+ |
Pb2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
OH- |
|
P |
P |
P |
– |
P |
M |
M |
H |
H |
– |
H |
H |
H |
H |
|
NO3- |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
|
Cl- |
P |
P |
P |
P |
H |
P |
P |
P |
P |
P |
P |
M |
P |
P |
P |
|
S2- |
P |
P |
P |
P |
H |
P |
– |
– |
H |
H |
H |
H |
H |
H |
– |
|
SO32- |
P |
P |
P |
P |
M |
M |
M |
P |
M |
– |
– |
H |
M |
– |
– |
|
SO42- |
P |
P |
P |
P |
M |
H |
M |
P |
P |
P |
– |
M |
P |
P |
P |
|
CO32- |
P |
P |
P |
P |
H |
H |
H |
H |
H |
– |
H |
H |
H |
– |
– |
|
SIO32- |
H |
– |
P |
P |
H |
H |
H |
H |
H |
– |
– |
H |
H |
– |
– |
|
PO43- |
P |
P |
P |
P |
H |
H |
H |
H |
H |
H |
H |
H |
H |
H |
H |
|
CH3COO- |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P |
P- растворимое (>1г в 100г воды);
M- малорастворимое (0,001г-1г в 100г воды);
H- нерастворимое (< 0,001г в 100г воды);
–разлагается водой или не существует.
Часть 2 Приготовление раствора соли заданной концентрации.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
1 Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
![]()
![]() O+
O+![]()
![]() O)
O)![]()
2 Молярная концентрация C – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль/л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1М; 0,5моль/л, обозначают 0,5М.
![]()
Домашнее задание для подготовки к практическому занятию
1 Самостоятельно изучить методические рекомендации по проведению практического занятия.
2 Подготовить ответы на контрольные вопросы.
3 Прочитать текст параграфа 4.1-4.2 глава 4 (с. 54-63), выполнить упражнение 9 стр.58[1].
Содержание отчета (отчет оформить в виде ответов на контрольные задания и приведенных расчетов)
Контрольные задания
ВАРИАНТ 1
1 Записать уравнения реакций в молекулярном, полном ионном и сокращённом ионном виде:
1 Na2SO4+BaCl2→
2 NaOH+HCl→
3 CuSO4+NaOH→
4 Cu(OH)2+HCl→
5 Na2CO3+HCl→
2 Рассчитать массу растворенного вещества, которую взяли для приготовления 0.05% раствора массой 150г.
Дано:
m(р-ра CuSO4) = 150г
ω (CuSO4) = 0,05%
3 Приготовить раствор заданной концентрации (индивидуальное задание получить у преподавателя)
3.1 Рассчитать, сколько соли и воды потребуется для приготовления раствора заданной концентрации общим объемом 50мл.
3.2 Взвесить на весах рассчитанную навеску. Перенести навеску соли в мерную колбу.Мерным цилиндром отмерить необходимый объем воды, вылить в колбу с солью и перемешать стеклянной палочкой до полного растворения соли.
ВАРИАНТ 2
1 Записать уравнения реакций в молекулярном, полном ионном и сокращённом ионном виде:
1 HBr+AgNO3→
2 PbSO4+HNO3→
3 Fe(OH)3+HC1→
4 MgCl2+KOH→
5 А12O3+НNO3→
2 Рассчитать массу растворенного вещества, которую взяли для приготовления 3% раствора массой 200г.
Дано:
m(р-ра CuSO4) = 200г
ω (CuSO4) = 3%
3 Приготовить раствор заданной концентрации (индивидуальное задание получить у преподавателя)
3.1 Рассчитать, сколько соли и воды потребуется для приготовления раствора заданной концентрации общим объемом 50мл.
3.2 Взвесить на весах рассчитанную навеску. Перенести навеску соли в мерную колбу. Мерным цилиндром отмерить необходимый объем воды, вылить в колбу с солью и перемешать стеклянной палочкой до полного растворения соли.
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.54-58
2 Ерохин Ю.М. Сборник задач и упражнений по химии: учеб. Пособие для студ.сред.проф.учеб.заведений – М: Издательский центр «Академия», 2006, с.70-74
Лабораторная работа №2
Тема: Изучение химических свойств кислот.
Цель: изучить химические свойства кислот, продолжить развитие навыков работы с химическим оборудованием и реактивами.
Оборудование и реактивы: штатив, пробирки, дистиллированная вода, магний Mg, фенолфталеин, метиловый оранжевый, лакмус, соляная кислота HCl, серная кислота H2SO4, гидроксид натрия NaOH, нитрат серебра AgNO3.
Пояснения к работе
Краткие теоретические сведения
Кислоты – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты классифицируют по составу: кислородосодержащие и бескислородные, по основности: одноосновные, двухосновные и многоосновные. Под основностью кислоты понимают число атомов водорода, способные заместиться атомами металла.
Характерным для кислот является кислый вкус, действие на индикаторы, электрическая проводимость.
Взаимодействие с гидроксидами сопровождается образованием соли и воды:
HCl + KOH = KCl + H2O
3H2SO4+ 2Fe(OH)3= Fe2(SO4)3+ 6H2O
Кроме того, кислоты взаимодействуют с металлами, основными и амфотерными оксидами и солями:
2HCl + Fe = FeCl2+ 2H2↑
2H3PO4+ 3Na2O = 2Na3PO4+ 3H2O
H2SO4+ BaCl2= BaSO4↓ + 2HCl
Бескислородные кислоты получают синтезом из простых веществ или вытеснением из их солей:
H2+ Cl2= 2HCl
2FeS + 2HCl = FeCl2+ H2S
Кислородосодержащие кислоты можно получить взаимодействие оксидов с водой или вытеснением из солей:
N2O5+ H2O = 2HNO3
Ca3(PO4)2+ 3H2SO4= 3CaSO4+ 2H3PO4
Домашнее задание для подготовки к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведению лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
3 Прочитать текст. Глава 5 (с. 68-72).
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории химии (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1. Испытание растворов кислот индикаторами
1 В три пробирки прилить по 1мл дистиллированной воды. В первую пробирку добавить 3-4 капли лакмуса, во вторую – 3-4 капли фенолфталеина, в третью – 1-2 капли метилового оранжевого.
2 В три пробирки прилить по 1 мл выданной кислоты. В первую пробирку добавить 3-4 капли лакмуса, во вторую – 3-4 капли фенолфталеина, в третью – 1-2 капли метилового оранжевого.
3 Результаты наблюдений занести в таблицу 1:
Опыт №2. Изучение взаимодействия металлов с растворами кислот
1 В пробирку налить 1 мл серной кислоты и опустить кусочек магния.
2 Написать уравнение реакции по наблюдению
Опыт №3. Изучение взаимодействия оснований с растворами кислот
1 В пробирку прилить 1 мл гидроксида натрия NaOH, затем добавить 1 каплю фенолфталеина. Отметить изменение окраски раствора.
2 В пробирку прилить соляную кислоту до полного обесцвечивания раствора. Составить уравнение реакции.
Опыт №4. Изучение взаимодействия солей с растворами кислот
1 К раствору нитрата серебра добавить раствор соляной кислоты.
2 Написать уравнение реакции по наблюдению.
Содержание отчета: отчет оформить в виде ответов на контрольные вопросы, результаты 1 опыта – в виде таблицы 1, 2-4 опытов - в виде таблицы 2.
Таблица 1
|
Индикаторы |
Окраска индикатора |
|
|
В воде |
В кислоте |
|
|
Лакмус |
||
|
Фенолфталеин |
||
|
Метилоранж |
||
Таблица 2
|
№ опыта |
Что делали |
Что наблюдали |
Выводы и уравнения реакций |
|
|
|
|
|
Контрольные вопросы:
1 На какие ионы диссоциируют кислоты?
2 Как изменяет свой цвет лакмус в растворах кислот?
3 Как называется реакция взаимодействия кислоты и основания?
4 Осуществить превращения: HCl→NaCl→AgCl.
Литература
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.68-72
Лабораторная работа №3
Тема: Изучение химических свойств оснований.
Цель: изучить химические свойства оснований, продолжить развитие навыков работы с химическим оборудованием и реактивами.
Оборудование и реактивы: штатив, пробирки, фенолфталеин, метиловый оранжевый, лакмус, соляная кислота HCl, серная кислота H2SO4, щелочь(NaOH,КOH),хлорид алюминия AICI3, соли: хлорид магния MgCI2 (СоCl2),хлорид железа (III) FeCI3, сульфат меди (II) CuSO4,
Пояснения к работе
Краткие теоретические сведения
Основания – это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы гидроксид - ионов ОН-.
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются.
Щелочи в воде диссоциируют полностью: NaOH→Na+ + OH-.
Классификация оснований по следующим признакам:
1 По кислотности (по числу групп –ОН в молекуле основания): однокислотные – NaOH, KOH, многокислотные - Са(ОН)2, Аl(OH)3.
2 По растворимости: растворимые (щелочи) – LiOH, KOH, нерастворимые – Cu(OH)2, Al(OH)3.
3 По силе (по степени диссоциации):
- сильные (α =100%) - все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
- слабые (α <100%) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
4 По химическим свойствам: основные – Са(ОН)2, NaОН; амфотерные – Zn(ОН)2, Al(ОН)3.
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид-ионов ОН-.
1 Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации): 2NaOH + H2SO4→ Na2SO4+ 2H2O,
2 Взаимодействие с кислотными оксидами: 2NaOH+ SO3 → Na2SO4 + H2O
3 Взаимодействие с растворимыми солями с образованием осадков:
Ba(OH)2+ K2SO4→ BaSO4↓+ 2KOH.
4 Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2→CaO+ H2O
Домашнее задание для подготовки к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведению лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
3 Прочитать текст параграфа 5.2 глава 5 (с.73- 77), выполнить упражнение 4.
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории химии (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1. Испытание растворов щелочей индикаторами
В три пробирки прилить по 1 мл выданного основания. В первую пробирку добавить 3-4 капли лакмуса, во вторую – 3-4 капли фенолфталеина, в третью – 1-2 капли метилового оранжевого. Результаты занести в таблицу 1.
Опыт №2.Получение и свойства амфотерных гидроксидов
1 Налить в две пробирки по несколько капель раствора хлорида алюминия AICI3.
2 Добавить в каждую из пробирок по несколько капель раствора гидроксида калия. Что при этом образуется?
3 В 1 пробирку добавить раствор соляной кислоты, а в другую - избыток раствора гидроксида калия. Сделать вывод по наблюдению.
Опыт №3.Получение и свойства нерастворимых оснований
1 В пробирки с растворами солей: СоCl2, FeCI3, CuSO4(5–6 капель) внести по 6–8 капель раствора щелочи NaOH до образования осадков. Отметить их окраску. Записать уравнения реакций.
2 Разделить полученный синий осадок Cu(OH)2на две пробирки. В одну из них добавить 2–3 капли раствора серной кислоты, в другую _ столько же щелочи. В какой пробирке наблюдалось растворение осадка? Написать уравнение реакции.
Содержание отчета: отчет оформить в виде ответов на контрольные задания, результаты практической части работы - в виде таблицы 1 и 2.
Таблица 1
|
Индикаторы |
Окраска индикатора в основании |
|
Лакмус |
|
|
Фенолфталеин |
|
|
Метилоранж |
Таблица 2
|
№ опыта |
Что делали |
Что наблюдали |
Выводы и уравнения реакций |
|
|
|
|
|
Контрольные вопросы:
1 На какие ионы диссоциируют основания? Написать уравнение реакции.
2 Как изменяет свой цвет фенолфталеин в растворах оснований?
3 Написать формулы гидроксидов калия, натрия, меди (II), кальция, железа (III), алюминия. Какие из них растворимы в воде? Отметить одно-, двух- и трехкислотные основания.
4 Какими химическими свойствами обладают следующие гидроксиды: Cа(OH)2 и Zn(OH)2? Подтвердить ответ соответствующими уравнениями реакций.
5 Как опытным путем определить, в какой пробирке находится раствор кислоты, а в какой – щелочи?
Литература
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.73-77
Лабораторная работа №4
Тема: Испытание растворов солей индикаторами. Общие свойства солей
Цель: познакомиться с явлением гидролиза солей, закрепить умение составлять полные и сокращенные ионные уравнения реакций, работать с химическими веществами.
Оборудование и реактивы: индикаторная бумага, растворы солей AlCl3, Na2CO3, ZnCI2, NaCI, FeCl3, CuSO4,соляная кислота HCI, мелCaCO3, сульфат натрия Na2SO4, хлорид бария BaCI2, пробирки, штатив.
Пояснения к работе
Краткие теоретические сведения
Соли - это сложные вещества, состоящие из одного (нескольких) атомов металла и одного (нескольких) кислотных остатков. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммонияNН4+) и анионы кислотного остатка.
- Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl![]() Na++ Cl–.
Na++ Cl–.
- Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+(кислая среда) или ионы ОН–(щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+(ОН–)![]() окрашенное соединение.
окрашенное соединение.
Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит [H+]=[OH-] - среда нейтральная, [H+]>[OH-] - среда кислая, [OH-]>[H+] - среда щелочная.
В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей, которые представлены в таблице 1.
Таблица 1 Типы гидролиза солей
|
1. Соль образована катионом слабого основания и анионом сильной кислоты: CuCl2, NH4Cl, Fe2(S04)3 - гидролиз по катиону CuCl2+Н2О Cu2++
2Сl- + Н++ ОН- Cu2++Н++ОН- Выводы:[Н+]>[ОН-] |
2. Соль образована катионом сильного основания и анионом слабой кислоты: К2С03, Na2S - гидролиз по аниону К2С03+ Н2О 2К++ С032- +Н++
ОН- С032-+ Н++ ОН- Выводы:[Н+]<[ОН-] |
|
1. Соль образована катионом слабого основания и анионом слабой кислоты: (NH4)2CO3, CH3COONH4- гидролиз по катиону и по аниону Fe2(C03)3+6Н2О 2Fe3++3C032-+3Н++3ОН Выводы:Характер среды определяется относительной силой кислоты и основания |
4. Соль образована катионом сильного основания и анионом сильной кислоты. (гидролизу не подвергаются: NaCl, К2SО4, Ba(N03)2. NaCl +Н2О≠ Na++Сl-+Н++ОН-≠Na+ +Сl-+Н++ОН- Выводы:[
Н+] = [ОН-] |
Таблица 2 Сильные и слабые электролиты
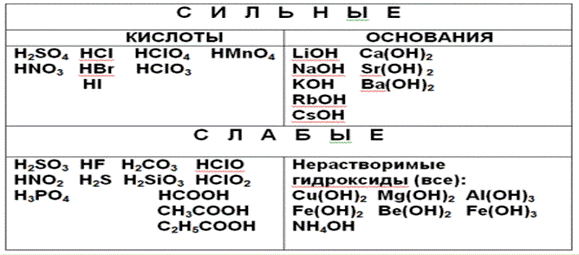
Домашнее задание для подготовки к лабораторной работе
1 Самостоятельно изучите методические рекомендации по проведению лабораторной работы.
2 Подготовьте ответы на контрольные вопросы.
3 Прочитайте текст параграфа 5.4 глава 5 (с. 82 - 86), выполните упражнение 4.
Работа в лаборатории
Инструкция по технике безопасности при работе в кабинете химии (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1.Испытание растворов солей индикатором
1 На полоску универсальной индикаторной бумаги нанести пипеткой по одной капле раствора каждой соли(из списка реактивов).
2 Результаты наблюдений занести в таблицу 3.
3 Составить уравнения реакций гидролиза солей.
Опыт №2: Взаимодействие раствора соли со щелочью
1 В пробирку прилить 2 мл хлорида железа (III) FeCI3 и добавить несколько капель гидроксида натрияNaOH.
2 Пронаблюдать за изменениями.
Опыт №3: Взаимодействие соли с кислотой
1 Налить в пробирку соляную кислоту HCI и добавить кусочек мела CaCO3.
2 Пробирку плотно закрыть пробкой.
3 Собранный газ проверить с помощью зажженной спички.
4 Сделать вывод. Какой газ при этом образуется?
Опыт №4: Взаимодействие солей друг с другом
1 К раствору сульфата натрия Na2SO4 добавить несколько капель хлорида бария BaCI2.
2 Пронаблюдать за изменениями.
Содержание отчета (отчет оформите в виде ответов на контрольные задания)
Контрольные задания
1 Результаты практической части работы оформите в виде таблицы 3 и 4.
Таблица 3 Определение среды растворов солей
|
Формула соли |
Цвет индикатора |
Реакция среды |
рН (рН<7, рН=7, рН>7) |
|
Na2CO3 |
|||
|
AlCl3 |
|||
|
FeCl3 |
|||
|
CuSO4 |
|||
|
NaCl |
|||
|
ZnCl2 |
Таблица 4
|
№ опыта |
Что делали |
Что наблюдали |
Выводы и уравнения реакций |
|
|
|
|
|
2 Теоретическое задание: Осуществите цепь превращений: K→K2O→KOH→KCl.
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.82-87
2 Ерохин Ю.М. Сборник задач и упражнений по химии: учеб. Пособие для студ.сред.проф.учеб.заведений – М: Издательский центр «Академия», 2006, с.82-85
Лабораторная работа №5
Тема: Общие свойства металлов
Цель: изучить химические свойства металлов.
Оборудование и реактивы: стружка магния Mg, соляная кислота HCl, серная кислота H2SO4, алюминий Al, сульфат алюминияAl2(SO4)3, хлорид алюминия AlCl3, хлорид меди CuCl2, железная скрепкаFe, хлорид железа (III)FeCl3, сульфат железа (II)FeSO4,желтая кровяная соль K3[Fe(CN)6], роданид аммония NH4NCS.
Пояснения к работе
Краткие теоретические сведения
Металлы содержатся во всех группах периодической системы элементов. Атомы металлов легко отдают валентные электроны, в свободном состоянии они являются восстановителями.
Общность физических свойств металлов: высокая электрическая проводимость, теплопроводность, ковкость, пластичность, объясняется общностью строения их кристаллических решеток. В металлах химическая связь - металлическая.
Строение атомов металлов определяет не только физические свойства простых веществ - металлов, но и общие их химические свойства. Русский ученый Н. Н. Бекетов расположил металлы в ряд, называемый электрохимическим рядом напряжений металлов:
Li, К, Са, Na, Мg, А1, Мп, Zn, Сг, Fе, Ni, Sn, РЬ, Н2, Сu, Нg, Аg, Рt, Аu
Металлы, стоящие в ряду напряжений до водорода, вытесняют его из растворов многих кислот, а все следующие за ним, не вытесняют. Металлы способны вытеснять следующие за ними металлы из растворов их солей.
Металлы реагируют с простыми веществами - неметаллами, сложными - водой, кислотами, солями.
Почти все металлы реагируют с кислотами, образуя соли. Характер взаимодействия металлов с кислотами зависит от активности металлов, его свойств и концентрации кислоты.
При действии кислоты на металл, роль окислителя играет или ион водорода (НСl, разбавленная H2SO4), или кислотный остаток кислородсодержащей кислоты (НNO3, Н2S04).
Концентрированная и разбавленная азотная кислота окисляет металлы без выделения водорода, так как в ней окислителем является нитрат - ион (NО3-).
Окислительное число азота при взаимодействии кислоты с металлами меняется от +5 до -3. Степень восстановления азота в азотной кислоте зависит от концентрации кислоты и от активности металла.
В разбавленной серной кислоте окислителем является ион водорода Н+, поэтому она окисляет многие металлы, расположенные в ряду напряжений до водорода. В концентрированной серной кислоте окислителем служит ион S042-. Окислительное число серы может изменяться от + 6 до -2.
Домашнее задание для подготовки к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведению данной лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
3 Прочитать текст параграфа 7.1 (с. 110), выполнить упражнение4 (с.113).
4 Какими общими химическими свойствами обладают все металлы главных подгрупп, почему? Ответ подтвердите уравнениями соответствующих реакций.
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1. Взаимодействие магния с соляной кислотой
1 В пробирку с соляной кислотой поместить стружки магния.
2 Какой газ выделился? Как его обнаружить?
3 Составить уравнение реакции. Сделать вывод.
Опыт №2. Взаимодействие алюминия с кислотами и щелочами
1 Налить в одну пробирку 10 капель 1М раствора серной кислоты, а во вторую – 10 капель 1М раствора гидроксида натрия.
2 Опустить в них по грануле алюминия (или по кусочку алюминиевой фольги одинакового размера).
3 Записать наблюдения.
4 Написать уравнения протекающих реакций.
Опыт №3. Получение гидроксида алюминия (III) и его свойства
1 Налить в 2 пробирки по 4-5 капель 1М раствора соли алюминия (например, Al2(SO4)3, AlCl3).
2 Прибавить в обе пробирки по 4-5 капель 1М раствора гидроксида натрия NaOH. Наблюдать образование осадка.
3 В первую пробирку добавить 6-7 капель 1М раствора NaOH, а во вторую – 6-7 капель 1М раствора H2SO4.
4 Записать наблюдения и уравнения протекающих реакций.
Опыт №4. Реакция замещения меди железом
1 В пробирку с раствором хлорида меди опустить на нитке железную скрепку.
2 Через 2-5 минут скрепку вынуть.
3 Составить соответствующее уравнение реакции.
Опыт №5. Получение гидроксида железа (III) и его свойства
1 Налить в 2 пробирки по 4-5капель 1М раствора соли железа (III) (например, FeCl3).
2 Прибавите в обе пробирки по 4-5капель 1М раствора гидроксида натрия NaOH. Наблюдать образование осадка.
3 В первую пробирку добавить 6-7 капель1М раствора NaOH, а во вторую – 6-7 капель 1М раствора H2SO4.
4 Записать наблюдения и вывод о кислотно-основных свойствах гидроксида железа (III).
Опыт №6. Качественные реакции на ионы Fe2+, Fe3+
1 В одну пробирку внести 5 капель 0,1 М раствора FeSO4, а во вторую – 5 капель 0,1 М раствора FeCl3.
2 В первую пробирку добавить 2-3 капли раствора K3[Fe(CN)6]. Во вторую пробирку добавить 2-3 капли раствора роданида аммония NH4NCS.
3 Записать наблюдения и уравнения протекающих реакций.
Содержание отчета
Результаты практической части работы оформите в виде таблицы, теоретической – в виде ответов на контрольные вопросы.
|
№опыта |
Что делал? |
Наблюдения |
Уравнения реакций, вывод |
|
|
|
|
|
Контрольные вопросы
1 Описать общие химические свойства для всех металлов.
2 Какие основания и оксиды называются амфотерными? Ответ пояснить примерами.
3 Почему цинк не может вытеснить магний из его соли?
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник - М.: Издательский центр «Академия», 2012, с.110-120
2 Ерохин Ю.М. Сборник задач и упражнений по химии: учеб. Пособие для студ.сред.проф.учеб.заведений – М: Издательский центр «Академия», 2006, с.170-179
Лабораторная работа №6
Тема: Получение, собирание и распознавание газов. Качественные реакции на хлорид-, сульфат-, карбонат-анионы.
Цель: закрепить умение получать, собирать и распознавать газообразные вещества; проводить эксперимент, наблюдать и делать выводы из увиденного.
Оборудование и реактивы: растворы карбоната натрияNa2CO3, хлорида бария BaCl2, хлорида натрия NaCl, нитрата серебра AgNO3, сульфата натрия Na2SO4, соляной кислоты HCl, уксусной кислоты CH3COOH, известковая вода Ca(OH)2, цинк Zn, карбонат кальция CaCO3, спички, стеклянная трубка, пробирки, пробиркодержатель.
Пояснения к работе
Краткие теоретические сведения
Водород – это самый легкий газ. В лаборатории его получают чаще всего в аппарате Киппа взаимодействием цинка с соляной кислотой. Так как водород самый легкий газ, его собирают в перевернутый вверх дном сосуд. Для распознавания водорода, к отверстию перевернутого вверх дном сосуда подносят зажженную лучину, при этом раздается глухой хлопок, если водород чистый или «лающий» звук, если водород содержит примеси.
Кислород – газ, содержание которого в атмосфере составляет 21%. Кроме кислорода в верхних слоях атмосферы содержится аллотропное видоизменение – озон О3. В лаборатории кислород получают разложением перманганата калия KMnO4 или пероксида водорода H2O2. Собирают кислород в сосуд методом вытеснения воздуха или методом вытеснения воды, потому что он тяжелее воздуха и малорастворим в воде. Распознают кислород по вспыхиванию, внесенной в сосуд с этим газом, тлеющей лучинки.
Углекислый газ или оксид углерода (IV) СО2 – бесцветный, не имеющий запах газ. Он примерно в полтора раза тяжелее воздуха. Растворим в воде. В лаборатории углекислый газ получают действием соляной кислоты на карбонат кальция. В промышленности углекислый газ получают обжигом известняка. Углекислый газ можно распознать по помутнению известковой воды или с помощью горящей лучинки, она при внесении в сосуд с углекислым газом гаснет.
Аммиак NH3 – газ с резким запахом, бесцветный, хорошо растворим в воде.В промышленности его получают взаимодействием азота с водородом, соблюдая следующие условия: катализатор (Fe), высокие температура и давление. В лаборатории аммиак получают взаимодействием щелочей с солями аммония. Аммиак легче воздуха, поэтому его следует собирать так же, как и водород – в перевернутую вверх дном пробирку. Кроме этого, аммиак можно распознать по характерному запаху и по изменению окраски влажной лакмусовой бумажки, по появлению белого дыма при поднесении стеклянной палочки, смоченной в соляной кислоте.
Качественный анализ позволяет определить, из каких элементарных веществ состоит данное сложное вещество или смесь. При качественном анализе испытуемое вещество переводят в другое новое вещество, обладающее каким - либо характерным свойством: малой растворимостью, определенной окраской, специфическим запахом и т.п. Вещества, которые дают характерную реакцию с испытуемым веществом, называют реактивами.
Чаще всего качественный анализ проводят в растворах, так как большинство неорганических соединений являются электролитами, распадающимися в водном растворе на ионы. Таким образом, реакции между испытуемым веществом и реактивом в растворе - это реакции между ионами.
Таблица 1Таблица распознавания анионов
|
Определяемый ион |
Реактив |
Условия проведения реакции |
Признаки химической реакции |
|
PO43- |
Ионы Ag+ |
Нейтральная среда |
Выпадение светло-желтого осадка |
|
CO32- |
Ионы Н+ |
обычные |
Выделение газа без запаха CO2, вызывающего помутнение известковой воды |
|
SO42- |
Ионы Ba2+ |
обычные |
Выпадение белого мелкокристаллического осадка, нерастворимого в азотной и др. кислотах |
|
SO32- |
Ионы H+ |
обычные |
Появление характерного запаха SO2 |
|
Cl- |
Ионы Ag+ |
обычные |
Появление белого творожистого осадка, который не растворяется в азотной кислоте |
|
Br - |
Ионы Ag+ |
обычные |
Появление светло-жёлтого осадка, который не растворяется в азотной кислоте |
|
I- |
Ионы Ag+ |
обычные |
Появление жёлтого осадка, который не растворяется в азотной кислоте |
Домашнее задание для подготовки к лабораторной работе
1 Повторить способы получения и распознавания различных газов.
2 Самостоятельно изучить методические рекомендации по проведению данной лабораторной работы.
3 Подготовить ответы на контрольные вопросы.
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1. Получение водорода
1 В пробирку поместить стружку магния.
2 Прилить 2мл раствора соляной кислоты. Наблюдения записать в таблицу 1.
3 Доказать наличие водорода, поднеся к горлышку пробирки зажженную спичку – раздается слабый хлопок, так как водород сгорает.
4 Записать уравнение реакции с точки зрения окислительно-восстановительного процесса.
Опыт №2. Получение углекислого газа
1 В пробирку поместить кусочек мела.
2 Прилить к мелу 4мл раствора уксусной кислоты. Наблюдения записать в таблицу 1. Записать уравнение химической реакции в молекулярной и ионной форме.
3 Через 1-2 минуты внести в верхнюю часть пробирки горящую лучинку. Наблюдения записать в таблицу 1.
4 В другую пробирку налить 2мл раствора известковой воды.
5 Используя чистую стеклянную трубку, осторожно продуть через неё выдыхаемый воздух. Наблюдения записать в таблицу 1. Записать уравнение химической реакции.
Опыт №3. Качественные реакции на хлорид-ион
1. В пробирку налить 0,5мл раствора хлорида натрия и прилить столько же раствора нитрата серебра.
2. Записать свои наблюдения.
3. Составить уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде.
Опыт №4. Качественные реакции на карбонат-ион
1 В пробирку налить 1мл раствора карбоната натрия и прилить столько же раствора соляной кислоты.
2 Записать наблюдения.
3 Составить уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде.
Опыт №5. Качественные реакции на сульфат-ион
1 В пробирку налить 1мл раствора сульфата натрия и прилить столько же раствора хлорида бария.
2 Записать наблюдения.
3 Составить уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде.
Содержание отчета
Результаты практической части занести в таблицу 1, ответить на контрольные вопросы.
Таблица 1
|
Название опыта |
Что делал? |
Наблюдения |
Уравнения реакций, вывод |
|
|
|
|
|
Контрольные вопросы
1. Каким образом можно распознать газ водород и углекислый газ?
2. Какие реакции называются качественными?
3. Какие вещества являются реактивом для обнаружения сульфат-иона?
4. С помощью какого вещества можно определить ион хлора в соли?
5. Какие вещества служат реактивом для обнаружения карбонат-иона?
Раздел 2. Органическая химия
Практическое занятие№3
Тема: Решение задач. Нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов.
Цель: научиться решать задачи на нахождение молекулярной формулы газообразногоуглеводорода по его плотности и массовой доле элементов.
Пояснения к работе
Краткие теоретические сведения
Алгоритм решения задач на нахождение молекулярных формул по его плотности и массовой доле химических элементов, выраженных в процентах
Обозначения величин:
М-молекулярная масса
А-атомная масса
Д-относительная плотность газа по другому газу
М (СхНу)=Д(Н2)хМ(Н2)
М (СХНУ) = Д(02)хМ(02)
М(СхНу)=Д(N2)хМ(N2)
М(СхНу)=Д(в)х М(в); М(в) =29г/м
Задача: Относительная плотность углеводорода по водороду, имеющего состав: w(С)=85,7%; w(Н)=14,3%, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: ω(С)=85,7% ω(Н)=14,3%, D(Н2)=21 |
Решение: 1 Находим относительную молекулярную массу углеводорода, исходя из величины его относительной плотности по водороду: М (СхНу)= D(Н2)хМ(Н2)=21х2=42 2
3
4 Составляем молекулярную формулу: С3Н6 5 Производим проверку: Мr(C3H6)=3×12+6×1=42г/моль |
|
Найти: СхНу=? |
|
|
Ответ: истинная формула вещества С3Н6 |
|
Алгоритм решения задач на нахождение молекулярных формул по массе или объему образовавшихся продуктов реакции
Задача: Определите молекулярную формулу углеводорода, при сжигании 3,9г которого образуется 13,2г оксида углерода (IV) и 2,7г воды. Плотность вещества по воздуху равна 2,69.
|
Дано: |
Решение: |
|
D(в)=2,69 m(CxHy)=3,9г m(С02)=13,2г m(Н20)=2,7г |
1 Вычисляем молярную массу вещества (1): М(в) =D(x)×М(х) = 2,69×29 = 78г/моль 2 Вычисляем количество атомов С: - если СО2 дано по массе:
- если СО2 дано в объеме:
Вычисляем количество атомов Н: Так как в молекуле Н2О 2 моля Н, формулу умножаем на 2 (это применимо и к N)
3 Составляем молекулярную формулу: С6Н6 4 Вычисляем молярную массу полученного вещества. M(C6H6) = 12×6 + 6×1 = 78г/моль 5 Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее. |
|
Найти: СхНу=? |
|
|
Ответ: истинная формула вещества С6Н6 |
|
Домашнее задание для подготовки к практическому занятию
1 Повторить способы решения задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов.
2 Самостоятельно изучить методические рекомендации по проведению данного практического занятия.
Инструкция по проведению практического занятия
1 Внимательно изучить алгоритмы решения типовых задач, записать их в тетради.
2 По данным алгоритмам решить задачи вашего варианта.
|
Вариант №1 1 Выведите формулу вещества, содержащего 82,75% углерода и 17,25%водорода. Относительная плотность паров этого вещества по воздуху равна 2. 2 Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22. 3 Какова молекулярная формула углеводорода, имеющего плотность по воздуху равную 2,9, если при сгорании 4,2г его в кислороде образовалось 13,2 г СО2 и 5,4г Н2О. 4 При сгорании 11,2г. углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу. |
Вариант №2 1 Выведите формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность паров этого вещества по водороду равна 22. 2 Выведите формулу вещества, содержащего 82,75% углерода и 17,25% водорода. Относительная плотность паров этого вещества по воздуху равна 2. 3 Какова молекулярная формула углеводорода, имеющего плотность по водороду равную 43, если при сгорании 4,3г его в кислороде образовалось 13,2г СО2 и 6,3г Н2О. 4 При сжигании 2.2г. вещества получили 4,4г оксида углерода и 1,8г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества. |
|
Вариант №3 1 Выведите формулу вещества, содержащего85,71% углерода и 14,29% водорода. Относительная плотность паров этого вещества по водороду равна 21. 2 Выведите молекулярную формулу хлорпроизводного предельного углеводорода с массовой долей хлора – 89,9% и углерода – 10,1%. Относительная молекулярная масса этого соединения – 237. 3
Какова молекулярная формула углеводорода, имеющего
плотность по воздуху равную 1,52, 4 При сжигании 29г углеводорода образовалось 88г углекислого газа и 45г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода. |
Вариант №4 1 Выведите формулу вещества, содержащего85,7% углерода и 14,3% водорода. Относительная плотность паров этого вещества по водороду равна 14. 2 Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества. 3 Какова молекулярная формула 4 При сжигании 2.2г вещества получили 4,4г оксида углерода и 1,8г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества. |
Содержание отчета
Отчет по практическому занятию представить в виде полной записи решения задач.
Практическое занятие№4
Тема: Сравнение свойств синтетических каучуков
Цель: познакомиться с различными видами синтетических каучуков, их особенностями строения и применения; развивать умения наблюдать, сравнивать и делать выводы из увиденного.
Оборудование и реактивы: наборы «Каучук», учебник Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник / О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия», 2012 (стр.163-165)
Пояснения к работе
Краткие теоретические сведения
Каучуки - натуральные или синтетические материалы, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём специальной обработки получают резину. В технике из каучуков изготовляют шины для автотранспорта, самолётов, велосипедов; каучуки применяют для электроизоляции, а также производства промышленных товаров и медицинских приборов.
Слово «каучук» происходит от двух слов языка тупи-гуарани: «кау» - дерево, «учу» - течь, плакать. «Каучу» - сок гевеи, первого и самого главного каучуконоса. Основной компонент каучука - углеводород полиизопрен (91-96%).
Каучуковые шары из сырой резины найдены среди руин цивилизаций инков и майя в Центральной и Южной Америке, возраст этих шаров не менее 900 лет. Первое знакомство европейцев с натуральным каучуком произошло пять веков назад. На острове Гаити (а тогда - Эспаньола) во время своего второго путешествия в 1493 году испанский адмирал Христофор Колумб увидел туземцев, игравших большим плотным мячом. Испанцы были удивлены весёлой игрой индейцев. Они в такт песне подбрасывали чёрные шары. Хотя это казалось невероятным, но, ударяясь о землю, мячи довольно высоко подскакивали в воздух. Взяв эти шары в руки, испанцы нашли, что они довольно тяжелы, липки и пахнут дымом.
Первые попытки сделать каучуковую обувь вызывали только смех. Галоши или сапоги хорошо служили в дождь, но стоило выглянуть и припечь солнцу, как они растягивались, начинали прилипать. В мороз же такая обувь становилась хрупкой как стекло.
Следующие два века каучук для Европы был просто любопытной заморской диковинкой. В 1770 году британский химик Джозеф Пристли впервые нашёл ему применение: он обнаружил, что каучук может стирать то, что написано графитовым карандашом. Тогда такие куски каучука называли гуммиластиком («смолой эластичной»).
В Англии британский химик и изобретатель Чарльз Макинтош предложил класть тонкий слой каучука между двумя слоями ткани и из этого материала шить водонепроницаемые плащи. Непромокаемый плащ из прорезиненной ткани до сих пор носит его имя. Но эти плащи зимой становились твёрдыми от холода, а летом расползались от жары.
Промышленность изделий из каучука оказалась на краю гибели. Однако вскоре стало все меняться. А началось с того, что американский изобретатель Чарльз Гудьир неожиданно обнаружил интересное явление. Нагретый в присутствии серы каучук не размягчался, а приобретал высокую эластичность. Такой каучук легко деформировался под действием небольших нагрузок и легко восстанавливал свою форму после их снятия. Это произошло в 1839 году, а в 1844 году изобретатель запатентовал полученный им вулканизированный каучук, который уже, собственно, не был обычным каучуком. Это был новый продукт – резина (от лат.resina– смола).
Для получения 1000тонн растительного полимера необходимо было обработать 3млн. каучуконосных деревьев и затратить на это в течение года труд 5,5тыс. человек. Да и сам натуральный каучук не всегда удовлетворял промышленность: он растворялся в масле, в нефтепродуктах, имел плохую термостойкость и быстро терял свои качества.
Так возникла необходимость в получении каучука синтетическим путем.
В 1926 году Высший совет народного хозяйства СССР объявил международный конкурс на лучший промышленный способ получения синтетического каучука (СК). Одержала победу советская наука: в 1931году. На опытном заводе был получен первый синтетический каучук. Получен он был полимеризацией дивинила, который синтезировали из этилового спирта. Эту реакцию успешно осуществил академик С.В.Лебедев:
Сырье: зерно картофель→ крахмал→глюкоза→спирт этиловый→бутадиен-1,3→синтетический каучук.
2С2Н5ОН→Н2С═СН─СН═СН2+2Н2О+Н2
![]()
бутадиеновый каучук
В настоящее время на рынке присутствует большое разнообразие каучуков по свойствам и характеристикам. Но в самом общем виде их можно разделить на два крупных сегмента: каучуки общего назначения и каучуки специального назначения.
Таблица 1 Синтетические каучуки
|
Каучуки общего назначения |
Каучуки специального назначения |
|
Бутадиен-стирольный каучук |
Хлоропреновый каучук |
|
Бутадиен-метил-стирольный каучук |
Бутадиен-нитрильный каучук |
|
Полибутадиеновый каучук |
Галогенированные изобутилены |
|
Бутилкаучук |
Уретаны |
|
Этиленпропиленовый каучук |
Силиконы |
|
Этиленпропилендиеновый каучук |
Полисульфидные каучуки |
|
Цис-1,4-полиизопреновый каучук |
|
Каучуки общего назначения используются в тех изделиях, в которых важна сама природа резины и нет каких-либо особых требований к готовому изделию. Каучуки специального назначения имеют более узкую сферу применения и используются для придания резино-техническому изделию (шинам, ремням, обувной подошве и т.д.) заданного свойства, например, износостойкости, маслостойкости, морозостойкости, повышенного сцепления с мокрой дорогой и т.д. Спецкаучуки применяются в резино-технической промышленности в гораздо меньших количествах по сравнению с каучуками общего назначения.
Домашнее задание для подготовки к практическому занятию
1 Самостоятельно изучить методические рекомендации по проведению данного практического занятия.
2 Повторить строение диеновых углеводородов, способы получения каучуков.
3 Подготовить ответы на контрольные вопросы.
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории (прилагается).
Инструкция по проведению практического занятия
Задание №1. Исторические сведения
1 Изучить краткие теоретические сведения.
2 Составить хронологию открытия и развития каучукового производства.
Задание №2. Сравнение свойств каучуков
1 Рассмотреть коллекцию «Каучуки».
2 Используя приложение №1, заполнить таблицу 1
Содержание отчета
Отчет по практическому занятию представить в виде таблицы 1 и ответов на контрольные вопросы.
Таблица 1
|
Название каучука |
Цвет |
Мономер |
Физические свойства |
Применение |
|
|
|
|
|
|
Контрольные вопросы:
1 Что такое вулканизация? С какой целью она проводится?
2 Чем отличается полимеризация диеновых углеводородов от этиленовых?
3 На какие группы делят синтетические каучуки? В чем их отличительные особенности?
4 Кем и когда впервые был получен бутадиеновый каучук?
Приложение 1
![]() Натуральный каучук - природный полимер цис-1,4-полиизопрен Н2С=С-СН=СН2
Натуральный каучук - природный полимер цис-1,4-полиизопрен Н2С=С-СН=СН2
СН3 аморфное, способно кристаллизоваться твёрдое тело. Он не набухает и не растворяется в воде, спирте, ацетоне и ряде других жидкостей. Набухая и, затем растворяясь в жирных и ароматических углеводородах (бензине, бензоле, эфире и других) и их производных, каучук образует коллоидные (клееобразные) растворы, широко используемые в технике. Особенно важным и специфическим свойством каучука является его эластичность (упругость) — способность каучука восстанавливать свою первоначальную форму после прекращения действия сил, вызвавших деформацию. Наряду с эластичностью, каучук так же пластичен, - он сохраняет форму, приобретённую под действием внешних сил. Каучук - хороший диэлектрик, он имеет низкую водопроницаемость и газопроницаемость. Теплопроводность каучука в 100 раз меньше теплопроводности стали.
Бутадиеновые каучуки - полимеры 1,3-бутадиена ![]() , каучуки общего назначения, обладает отличной
стойкостью к низким температурам и к истиранию. Но при этом, он не обладает
высокой прочностью при растяжении и обычно наполняется упрочняющими добавками.
Основная область применения - это изготовление протекторных и обкладочных
(каркас, брекер, боковина) шинных резин, используют также в производстве
конвейерных лент, низа обуви, изоляции кабеля, ударопрочного полистирола.
, каучуки общего назначения, обладает отличной
стойкостью к низким температурам и к истиранию. Но при этом, он не обладает
высокой прочностью при растяжении и обычно наполняется упрочняющими добавками.
Основная область применения - это изготовление протекторных и обкладочных
(каркас, брекер, боковина) шинных резин, используют также в производстве
конвейерных лент, низа обуви, изоляции кабеля, ударопрочного полистирола.
Бутадиен-стирольные
каучуки- группа продуктов
сополимеризации бутадиена -1,3 СН2=СН-СН=СН2 и стирола,  наиболее распространенный тип каучуков общего
назначения. Каучук растворим в алифатических и ароматических углеводородах,
хлороформе, четырёххлористом углероде, сероуглероде. Уступает натуральному по
эластичности, но обладает высокой водо- и газонепроницаемостью. Важным
преимуществом бутадиен-стирольных каучуков перед натуральным каучуком является меньшая
склонность к образованию трещин, более высокая износостокость, паро- и
водонепроницаемость, лучшее сопротивление тепловому, озонному и световому
старению. Хорошими диэлектрическими свойствами обладают каучуки с высоким
содержанием стирола. Применяется в шинной, резинотехнической, кабельной,
обувной и других отраслях промышленности.
наиболее распространенный тип каучуков общего
назначения. Каучук растворим в алифатических и ароматических углеводородах,
хлороформе, четырёххлористом углероде, сероуглероде. Уступает натуральному по
эластичности, но обладает высокой водо- и газонепроницаемостью. Важным
преимуществом бутадиен-стирольных каучуков перед натуральным каучуком является меньшая
склонность к образованию трещин, более высокая износостокость, паро- и
водонепроницаемость, лучшее сопротивление тепловому, озонному и световому
старению. Хорошими диэлектрическими свойствами обладают каучуки с высоким
содержанием стирола. Применяется в шинной, резинотехнической, кабельной,
обувной и других отраслях промышленности.
Хлоропреновый каучук- разновидность синтетического каучука, полимер хлоропрена: n(Н2С=СС1-СН=СН2)→(-Н2С-СС1=СН-СН2-)n. Хлоропреновый каучук стоек к открытому огню; обладает отличной адгезией (способность склеиваться) к тканям и металлам; очень хорошей стойкостью к атмосферному воздействию, озоностойкостью и стойкостью к естественному окислению, к истиранию и низкой температуре, обладает масло- и бензостойкостью, термостабилен. Используют в производстве резино-технических изделий: конвейерных лент, приводных ремней, рукавов, шлангов, водолазных костюмов, электроизоляционных материалов, технических пластин, труб для перекачки нефти.
Полиизобутиленовый каучук - полимер изобутилена. Изделия отличаются высокими гидроизоляционными свойствами, трещиностойкостью и хорошей адгезией к основаниям. Высокая водонепроницаемость, биостойкость и атмосферостойкость покрытий из каучука позволяют рекомендовать их для оклеенной гидроизоляции.
Резина - эластичный материал, образующийся в результате вулканизации натурального и синтетических каучуков с наполнителями, смягчителями и другими компонентами. Важнейшее свойство резины - высокая эластичность, т.е. способность к большим обратимым деформациям в широком интервале температур. Сравнительно мягкий, практически несжимаемый материал. Незначительно поглощает воду и ограниченно набухает в органических растворителях. Известны резины, характеризующиеся масло-, бензо-, водо-, паро- и термостойкостью, стойкостью к действию химически агрессивных сред, озона, света, ионизирующих излучений. При длительном хранении и эксплуатации резины подвергаются старению и утомлению, приводящим к ухудшению их механических свойств, снижению прочности и разрушению. Срок службы резины в зависимости от условий эксплуатации от нескольких дней до нескольких десятков лет.
Резины широко используют в технике, сельском хозяйстве, быту, медицине, строительстве, спорте. Среди них: шины, транспортные ленты, приводные ремни, рукава, амортизаторы, уплотнители, сальники, манжеты, кольца и др., кабельные изделия, обувь, ковры, трубки, покрытия и облицовочные материалы, прорезиненные ткани, герметики и др. Более половины объема вырабатываемой резины используется в производстве шин.
Синтетический латекс содержат следующие изделия: эластичный бинт, медицинский бандаж, ластики, воздушные шарики, хирургические перчатки, бактерицидный пластырь, некоторые виды обуви и предметы одежды, катетеры, соски, пустышки, некоторые предметы спортивного инвентаря, некоторые ремешки для часов, массажеры для зубов, бельевая резинка, краски, различные маски, матрасы, подушки и другие. Латексы на основе синтетических каучуков - коллоидные водные дисперсии синтетических каучуков и других полимеров (полистирол, сополимеры стирола с 20-35 мас% бутадиена). Синтетические латексы обладают достаточно высокой химической устойчивостью, что обеспечивает возможность практического их применения.
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник – М.: Издательский центр «Академия», 2012, с.158-167
Лабораторная работа №7
Тема: Исследование свойств уксусной кислоты. Качественные реакции на определение альдегидов, кислот и спиртов.
Цель: изучить химические свойства уксусной кислоты, развивать умения распознавать органические вещества, составлять уравнения качественных реакций.
Оборудование и реактивы: уксусная кислота СНзСООН, лакмус, гидроксид натрия NаОН, магний Мg, карбонат натрия Nа2СОз, фенол С6Н5ОН, глицерин С3H7ОН, хлорид железа FеС13, сульфат меди CuSO4, пробирки.
Пояснения к работе
Краткие теоретические сведения
Предельными одноосновными карбоновыми кислотами называются органические вещества, молекулы которых содержит функциональную группу СООН, соединенную с углеводородным радикалом.
Для карбоновых кислот характерны реакции замещения атома водорода в гидроксильной группе и в углеводородном радикале. Растворимые в воде кислоты имеют характерный кислый вкус и окрашивают лакмус в красный цвет. Их диссоциацию в водном растворе можно выразить уравнением: R-СООН→Н++R-СОО-
При действии на растворы кислот некоторых металлов происходит выделение водорода и образование соли. При взаимодействии кислот с основными оксидами и основаниями образуются соли. Реагируя с солями, кислоты вытесняют более слабые и летучие кислоты.
Качественные (характерные) реакции на определение альдегидов, кислот испиртов
Уксусная кислота определяется хлоридом железа (III): в результате реакции образуется красное окрашивание. Муравьиная кислота с оксидом серебра дает реакцию серебряного зеркала (проявляет свойства альдегидов).
Качественными реакциями на альдегиды являются:
- окисление их оксидом серебра при нагревании (реакция серебряного зеркала);
- окисление гидроксидом меди (II) при нагревании, образуется красное окрашивание.
Многоатомный спирт глицерин определяется свежеприготовленным гидроксидом меди(II), появляется ярко-синее окрашивание. Гидроксид меди (II) получают следующим образом: в пробирку с 2-3 каплями сульфата меди прилить в избытке щелочь (гидроксид калия или натрия).
Характерной реакцией на фенол служит реакция с хлоридом железа(III): образуется фиолетовое окрашивание.
Домашнее задание для подготовки к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведении данной лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
3 Повторить химические свойства кислот и альдегидов, многоатомных спиртов, фенола.
Работа в лаборатории
Инструкция по технике безопасности при работе в лаборатории (прилагается).
Инструкция по проведению лабораторной работы
Опыт №1. Испытание уксусной кислоты раствором лакмуса
1 В пробирку с уксусной кислотой прилить каплю лакмуса. В какой цвет окрасился лакмус?
2 К какому классу органических соединений относится выданное вещество?
3 Написать уравнение диссоциации данного вещества.
Опыт №2. Реакция нейтрализации
1 В пробирку с кислотой и лакмусом прилить раствор щелочи NaOH. В какой цвет окрасился раствор?
2 Составить уравнение реакции.
Опыт №3. Взаимодействие уксусной кислоты с магнием
1 В пробирку с кислотой поместить кусочек магния. Какой газ выделился? Как можно обнаружить выделившийся газ? Определить его.
2 Составить уравнение реакции.
Опыт №4. Взаимодействие уксусной кислоты с солями
1 В пробирку налить 1мл раствора карбоната натрия и добавить несколько капель раствора уксусной кислоты.
2 Какой газ выделяется в ходе реакции? Как опытным путем его можно обнаружить? Определить выделившийся газ.
3 Составить уравнение реакции.
Опыт №5.Качественная реакция на глицерин
1 Приготовить свежеосажденный гидроксид меди (II). Гидроксид меди (II) получают следующим образом: в пробирку с 2-3 каплями сульфата меди прилить в избытке щелочь (гидроксид калия или натрия).
2 В пробирку налить 2-3 мл глицерина и добавить половину осадка гидроксида меди(II). Что произошло с осадком и раствором?
3 Составить уравнения реакции получения гидроксида меди (II) и его взаимодействия с глицерином.
Опыт №6. Качественная реакция на фенол
В пробирку налить 2-3мл фенола и добавить 3-4 капли хлорида железа (III). Что произошло с раствором?
Содержание отчета
Отчет по лабораторной работе представить в виде таблицы 1 и ответов на контрольные вопросы.
Таблица 1
|
Номер опыта |
Что делал |
Что наблюдал |
Уравнения реакций, вывод |
|
|
|
|
|
Контрольные вопросы
1 Что называется функциональной группой?
2 Дать определение карбоновых кислот. Написать их общую формулу.
3 Чем обусловлены химические свойства карбоновых кислот?
4 Как можно обнаружить водород и углекислый газ?
5 Как химическим способом отличить:
- глицерин от фенола;
- фенол от уксусной кислоты;
- муравьиный альдегид от уксусной кислоты?
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля:учебник - М.: Издательский центр «Академия», 2012, с. 142, 185-200
2 Ерохин Ю.М. Сборник задач и упражнений по химии: учеб. Пособие длястуд.сред.проф.учеб.заведений-М: Издательский центр «Академия», 2006, с. 307-330.
Лабораторная работа №8
Тема: Изучение химических свойств глюкозы, сахарозы, крахмала.
Цель: изучить физические и химические свойства углеводов, развитие умений распознавать глюкозу-альдегидоспирт, сахарозу - многоатомный спирт, крахмал, выполнять реакции гидролиза.
Оборудование и реактивы: глюкоза, сахароза, крахмал, сульфат меди, гидроксид натрия, аммиачный раствор нитрата серебра, спиртовой раствор йода.
Пояснения к работе
Краткие теоретические сведения
Углеводы в зависимости от их строения подразделяют на моносахариды, дисахариды и полисахариды. Молекулярная формула глюкозы С6Н12О6, крахмала (С6Н10О5)n, сахарозы С12Н22О11.
Опытным путем ученые доказали, что глюкоза-альдегидоспирт. Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Глюкоза - вещество с двойственной химической функцией. Кроме того, она обладает и некоторыми специфическими свойствами. Как многоатомный спирт, глюкоза реагирует со свежеосажденным гидроксидом меди (II) с образованием ярко-синего (василькового) окрашивания - это качественная реакция на глюкозу.
Как альдегид глюкоза окисляется, реагирует с оксидом серебра (реакция серебряного зеркала). Окислителем альдегидной группы глюкозы может служить и гидроксид меди. Если к небольшому количеству свежеосажденного гидроксида меди (II) прилить раствор глюкозы и смесь нагреть, то образуется красный оксид меди (I). Уравнение реакции окисления глюкозы гидроксидом меди аналогично тому, которое приводилось для альдегидов. Реакции глюкозы с оксидом серебра и гидроксидом меди - качественные.
При исследовании химических свойств сахарозы можно убедиться, что для нее характерна реакция многоатомных спиртов: при взаимодействии с гидроксидом меди образуется ярко-синий раствор (реакция качественная). Реакцию «серебряного зеркала» с сахарозой осуществить не удается. Следовательно, в ее молекуле имеются гидроксильные группы, но нет альдегидной.
Крахмал - природный полимер. Характерной реакцией крахмала является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. Этим свойством пользуются при определении крахмала в пищевых продуктах.
Домашнее задание при подготовке к лабораторной работе
1 Самостоятельно изучить методические рекомендации по проведению данной лабораторной работы.
2 Подготовить ответы на контрольные вопросы.
3 Как опытным путем можно доказать, что в молекуле глюкозы имеются пять гидроксильных групп и альдегидная группа?
4 Повторить химические свойства углеводов.
Работа в лаборатории
Инструкция по технике безопасности при работе в кабинете химии (прилагается)
Инструкция по проведению лабораторной работы
Опыт №1. Физические свойства углеводов
1 Рассмотреть глюкозу, сахарозу, крахмал, определить их агрегатное состояние, цвет и запах. Наблюдения занести в таблицу 1.
2 Растворить небольшое количество каждого углевода в воде. Сделать вывод об их растворимости. Наблюдения занести в таблицу 1.
Опыт №2. Взаимодействие глюкозы с гидроксидом меди
1 В пробирку к 3-4 каплям раствора сульфата меди (П) прилить 2-3мл раствора гидроксида натрия.
2 К полученному осадку прилить равный объем раствора глюкозы. Как изменилась окраска раствора? Почему?
3 Нагреть содержимое пробирки. Какие изменения наблюдаются?
4 О наличии какой функциональной группы в молекуле глюкозы свидетельствует этот опыт? Составить уравнение реакции.
Опыт №3. Реакция «серебряного зеркала»
1 Получить аммиачный раствор оксида серебра:в чистую пробирку поместить2-3 капли нитрата серебра, прибавить по каплям раствор гидроксида аммония NH4OHдо растворения появившегося осадка.
2 К полученному аммиачному раствору оксида серебра добавить раствор глюкозы, смесь осторожно нагреть над пламенем спиртовки.
3 Объяснить наблюдаемое явление. Почему эта реакция называется реакцией «серебряного зеркала»?
Опыт №4. Взаимодействие сахарозы с гидроксидом меди
1 К раствору гидроксида меди(II) прилить раствор сахарозы, смесь взболтать.
2 Как изменилась окраска раствора? О чем это свидетельствует?
Опыт №5. Реакция крахмала с йодом
1 Налить в пробирку 2-3мл крахмального клейстера, добавить каплю раствора йода. Что наблюдаете?
2 Нагреть смесь. Какие изменения наблюдаются?
3 Восстанавливается ли прежняя окраска при охлаждении смеси?
Содержание отчета
Отчет по лабораторной работе представить в виде таблиц 1 и 2, ответов на контрольные вопросы.
Таблица 1
|
Название углевода |
Агрегатное состояние |
Цвет |
Запах |
Растворимость в воде |
|
Глюкоза |
|
|
|
|
|
сахароза |
|
|
|
|
|
крахмал |
|
|
|
|
Таблица 2
|
Номер опыта |
Что делал |
Что наблюдал |
Уравнения реакций, вывод |
|
|
|
|
|
Контрольные вопросы
1 Какие вещества относятся к углеводам и почему им было дано такое название?
2 Какое общее химическое свойство присуще сахарозе, крахмалу, целлюлозе? Ответ подтвердить уравнениями реакций.
3 Какой из углеводов можно назвать альдегидоспиртом и почему?
4 Какие химические свойства для глюкозы и глицерина являются общими, чем эти вещества отличаются друг от друга?
5 Как распознать растворы глюкозы и сахарозы?
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник-М.: Издательский центр «Академия», 2012, с.207-213
2 Ерохин Ю.М. Химия: учеб, для студ. сред. проф. учеб, заведений - М.; 2007, с.338-346
Лабораторная работа №9
Тема: Изучение свойств белков. Цветные реакции.
Цель: изучить основные химические свойства белков, развитие умений проводить реакции осаждения белка и объяснять их механизмы.
Оборудование и реактивы: водный раствор яичного белка, 10%-ный раствор гидроксида натрия, 1%-ный раствор сульфата меди (II), хлорид цинка, этиловый спирт, пробирки, спиртовки, пробиркодержатели, спички.
Пояснения к работе
Краткие теоретические сведения
Белки - это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул. В состав белков входят углерод, водород, кислород и азот. Мономерами белков являются аминокислоты, которые соединяются в молекуле белка за счет пептидной связи, каждый белок имеет свою строгую последовательность аминокислотных звеньев.
При изучении структуры белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а некоторые белки и четвертичную структуры.
Имея сложное строение, белки обладают разнообразными свойствами. Одни белки, например белок куриного яйца, растворяется в воде. Некоторые белки совсем не обладают свойством растворимости.
Наличие в молекулах белков групп -СООН и -NH2 делает их амфотерными.
Под влиянием ряда факторов может нарушиться конфигурация молекулы белка. Этот процесс называется денатурацией. Сильное нагревание вызывает не только денатурацию белков, но и разложение с выделением летучих продуктов.
Белки дают характерные цветные реакции, по которым их можно распознать среди других веществ. Например, если к раствору белка прилить концентрированный раствор азотной кислоты, то появится желтое окрашивание (ксантопротеиновая реакция). Эту реакцию можно наблюдать на коже рук при неосторожном обращении в лаборатории с азотной кислотой. При взаимодействии белка с гидроксидом натрия происходит биуретовая реакция (появляется красно-фиолетовая окраска).
Значение цветных реакций состоит в том, что они дают возможность установить белковую природу вещества и доказать присутствие некоторых аминокислот в различных природных белках. На основании цветных реакций разработаны методы количественного определения белков и аминокислот.
Домашнее задание при подготовке к лабораторной работе
1 Изучить рекомендации к данной лабораторной работе.
2 Подготовить ответы на контрольные вопросы.
3 Прочитать текст параграфа 11.2-11.3,стр. 216-224.
Инструкция по проведению лабораторной работы
Опыт №1. Биуретовая реакция
1 В пробирку с 2-3мл раствора белка добавить несколько мл раствора гидроксида натрия, а затем раствора сульфата меди.
2 В какой цвет окрасился раствор?
Опыт №2. Ксантопротеиновая реакция
1 В пробирку с раствором белка прилить1 мл разбавленной азотной кислоты (осторожно), смесь нагреть.
2 Какое окрашивание появилось в пробирке? Сделать вывод о сущности цветных реакций белков.
Опыт №3. Денатурация белка
1 В 3 пробирки налить раствор белка.
2 В первую пробирку с белком добавить 1мл раствора хлорида цинка; во вторую пробирку - 1мл этилового спирта; третью пробирку с белком нагреть.
3 Что произошло с белком во всех трех пробирках? Наблюдения занести в таблицу 1.
Содержание отчета
Отчет по лабораторной работе представить в виде таблицы 1, ответов на контрольные вопросы.
Таблица 1
|
Номер опыта |
Что делал? |
Что произошло? |
Уравнение реакций, вывод |
|
|
|
|
|
Контрольные вопросы:
1 Охарактеризовать строение белковых молекул.
2 Как можно доказать наличие белков в продуктах питания и тканях?
3 Какие вещества образуются при гидролизе белков в организме?
4 Что такое денатурация белков и какие факторы её вызывают?
Литература
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник – М.: Издательский центр «Академия», 2012, с.221-225
2 Ерохин Ю.М. Химия: учеб. для студ. сред. проф. учеб. заведений – М.; 2007, с.361-364
Список рекомендуемой литературы
1 Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник – М.: Издательский центр «Академия», 2012.- 256 с.
2 Ерохин Ю.М. Химия: учеб. для студ. сред. проф. учеб. заведений – М.; 2007.-384 с.
Список использованных источников
1 http://nsportal.ru/shkola/khimiya/library/2014/02/10/reshenie-zadach-10-klass
2 http://online-tusa.com/tasks
3 http://nsportal.ru/npo-spo/estestvennye-nauki/library/2013/11/05/rabochaya-tetrad-dlya-laboratornykh-i-prakticheskikh
4 https://infourok.ru/laboratornie-i-prakticheskie-raboti-po-himii-dlya-obuchayuschihsya-spo-305630.html
5 http://www.docme.ru/doc/1044262/laboratornyj-praktikum-po-himii
6 http://www.zavuch.ru/methodlib/133/105484/#sthash.OOgaZgh0.dpbs
Скачано с www.znanio.ru
© ООО «Знанио»
С вами с 2009 года.
![]()