Памятка "Основания" 9 класс
Раздаточные материалы
docx
химия
9 кл
28.04.2017
Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда) либо с вакантной орбиталью другого химического соединения (основание Льюиса).
В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−.
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме.
памятка основания.docx
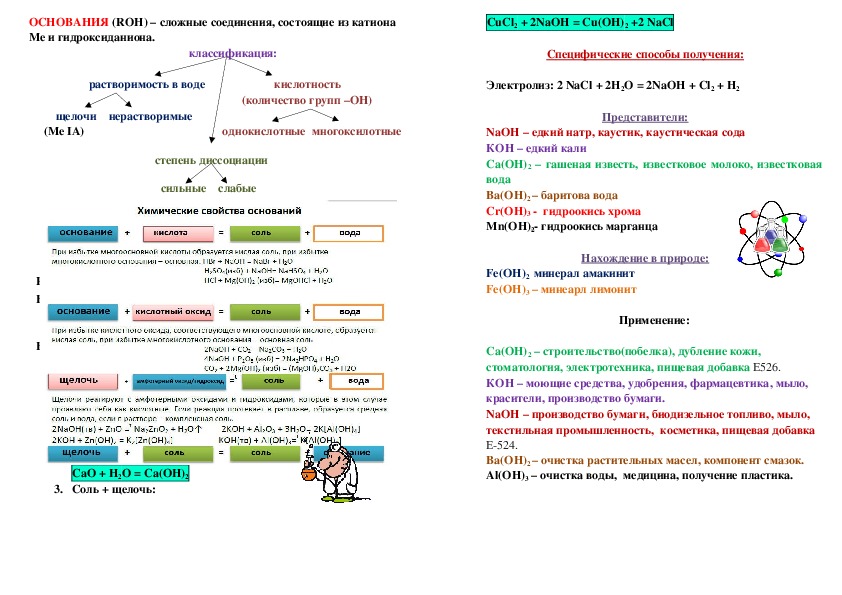
ОСНОВАНИЯ (ROН) – сложные соединения, состоящие из катиона
Ме и гидроксиданиона.
классификация:
растворимость в воде кислотность
(количество групп –ОН)
щелочи нерастворимые
(Ме IА) однокислотные многоксилотные
степень диссоциации
сильные слабые
Химические свойства:
Специфические свойства:
Разложение нерастворимых оснований: Cu(OH)2 = CuO + H2O
Взаимодействие с неМе: 4 P + 3NaOH + H2O= PH3 + 3↑ NaH2PO4
3S +6 KOH =K2SO3 +2 K2S + 3H2O
Cl2 + KOH = KClO3 + KCl + H2O
Взаимодействие с Ме: Zn + NaOH = Na2ZnO2 + H2↑
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2 H2O
1. Активные Ме + вода:
Получение оснований:
2Na + H2O = NaOH + H2
2. Оксид активного Ме + вода:
CaO + H2O = Ca(OH)2
3. Соль + щелочь:
CuCl2 + 2NaOH = Cu(OH)2 +2 NaCl
C пецифические способы получения:
Электролиз: 2 NaCl + 2H2O = 2NaOH + Cl2 + H2
Представители:
NaOH – едкий натр, каустик, каустическая сода
КОН – едкий кали
Са(ОН)2 – гашеная известь, известковое молоко, известковая
вода
Ba(OH)2 – баритова вода
Cr(OH)3 гидроокись хрома
Mn(OH)2 гидроокись марганца
Нахождение в природе:
Fe(OH)2 минерал амакинит
Fe(OH)3 – минеарл лимонит
Применение:
Са(ОН)2 – строительство(побелка), дубление кожи,
стоматология, электротехника, пищевая добавка E526.
КОН – моющие средства, удобрения, фармацевтика, мыло,
красители, производство бумаги.
NaOH – производство бумаги, биодизельное топливо, мыло,
текстильная промышленность, косметика, пищевая добавка
E524.
Ba(OH)2 – очистка растительных масел, компонент смазок.
Al(OH)3 – очистка воды, медицина, получение пластика.
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
28.04.2017
Посмотрите также:
© ООО «Знанио»
С вами с 2009 года.
![]()
О портале

