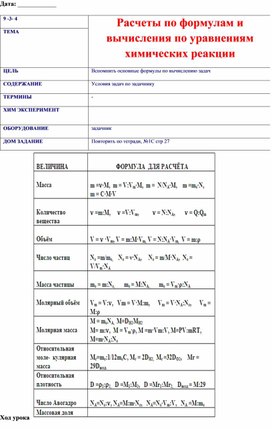
Расчеты по формулам и вычисления по уравнениям химических реакции
Дата: ____________
|
Ход
урока 
1. Почему оксид ртути можно разложить, а кислород- нельзя?
2. В каких случаях вы назовете кислород простым веществом, а в каких- химическим элементом:
а) из оксида железа получили кислород
б) в состав воды входит кислород
в) оксид меди состоит из кислорода и меди
г) рыбы дышат кислородом, растворенным в воде
3. Молекула сахара состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода.
Запишите химическую формулу вещества, вычислите относительную молекулярную массу.
4. Рассчитайте, в каком веществе содержится больше серы: в пирите FeS2 или в сероводороде H2S.
5. В состав вещества входят углерод (массовая доля 75%) и водород(массовая доля 25%). Определите молекулярную формулу этого соединения.
Примеры задач
Задача 1. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого газа.
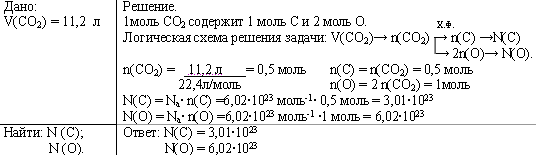
Задача 2. В каком объеме углекислого газа содержится 9,03·1023 атомов кислорода?
Какова его масса?
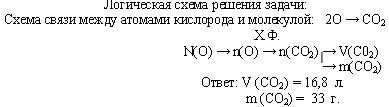
Задача 3. Газ, плотность которого равна 1,96 г/л (н.у.), состоит из углерода и кислорода, причем ω(C) = 0,27. Определите формулу данного вещества.
Логическая схема решения задачи:
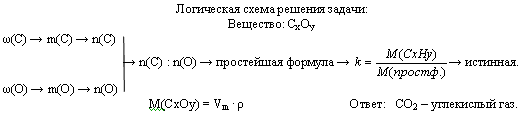
Задача 1. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты.
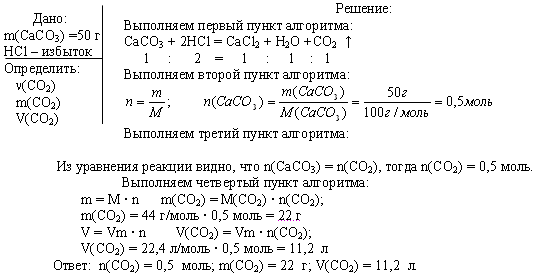
Задача 2. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли.
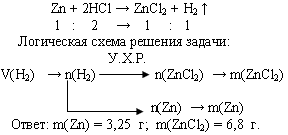
Задача 3. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.).
Определите, какой это металл.
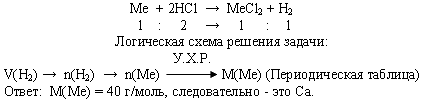
I вариант
1. Разделите
группу неорганических соединений на оксиды, кислоты, соли, основания и дайте им
названия: Fe(OH)3,
KCl, HF,
H![]() PO
PO![]() , K
, K![]() SiO
SiO![]() ,
Zn(OH)2,
Cl
,
Zn(OH)2,
Cl![]() O
O![]() , H
, H![]() SiO
SiO![]() ,
AgNO
,
AgNO![]() ,
Na
,
Na![]() O,
Mg(OH)2,
Al
O,
Mg(OH)2,
Al![]() O
O![]() .
.
2. Определите тип химической связи и тип кристаллической решетки у следующих веществ:
CuO,
Fe, HBr, HI, S, KCl, CO![]() ,
NaCl, Br
,
NaCl, Br![]() , B.
, B.
3. Расставьте коэффициенты методом электронного баланса, а также напишите для калия электронную формулу и укажите расположение электронов по энергетическим уровням:
HNO![]() +
K → KNO
+
K → KNO![]() + H
+ H![]() O
+ N
O
+ N![]() O
O
4. Осуществите следующие химические превращения:
Ca → Ca(OH)![]() →
Ca SO
→
Ca SO![]() → Cа(OH)
→ Cа(OH)![]() → Ca
→ Ca![]() (PO
(PO![]() )
)![]() →
Ca CO
→
Ca CO![]() → CaO
→ CaO
5. В 130 мл воды (ρ=1г/см3) растворено 20г соли. Вычислите массовую долю соли в полученном растворе.
II вариант
1. Разделите группу
неорганических соединений на оксиды, кислоты, соли, основания и дайте им
названия: H![]() SO
SO![]() , P
, P![]() O
O![]() , Al(OH)3,
HCl, RbOH,
Na
, Al(OH)3,
HCl, RbOH,
Na![]() PO
PO![]() , Mn
, Mn![]() O
O![]() ,
MgO, Al(NO
,
MgO, Al(NO![]() )
)![]() , Cu(OH)2,
HBr, FeS
.
, Cu(OH)2,
HBr, FeS
.
2. Определите тип химической связи и тип кристаллической решетки у следующих веществ:
Fe
Cl![]() , N
, N![]() ,
C, N
,
C, N![]() O
O![]() ,
Li
,
Li![]() O, MgO, AlCl
O, MgO, AlCl![]() ,
Pb, I
,
Pb, I![]() , Si.
, Si.
3. Расставьте коэффициенты методом электронного баланса , а также напишите для железа электронную формулу и укажите расположение электронов по энергетическим уровням:
HNO![]() +
Fe → Fe(NO
+
Fe → Fe(NO![]() )
)![]() +
H
+
H![]() O + NO
O + NO![]()
4. Осуществите следующие химические превращения:
Na → NaH → NaOH → NaCl
→ Na![]() CO
CO![]() →
CO
→
CO![]() → Ca CO
→ Ca CO![]()
5. В 1 мл 20%-ного раствора содержится 0,244г растворенного вещества. Какова плотность данного раствора?
Домашнее задание: повторить формулы веществ
© ООО «Знанио»
С вами с 2009 года.
![]()

