Учебная программа для детей по теме: « Химия пищи и напитков»

Химия пищи и напитков
Здравствуйте, ребята, сегодня мы поговорим с вами о химии в такой важной области нашей жизни как пища и напитки. Все мы любимы вкусно покушать, любим (или не любим) овощи и фрукты, пьем молоко, газировку колу, и многое другое. Пища и напитки необходимы нам для поддержания жизнедеятельности верно? А сегодня посмотрим на привычные нам продукты с точки зрения химии и разберемся, почему же происходят те ли иные процессы.
Сначала я хочу спросить вас, кто любит молоко? Что это вообще такое? Откуда оно в магазинах?(ответы детей). Давайте попробуем молоко покрасить и понять, что молоко не совсем обычная жидкость. Кстати чем повашему оно отличается от воды? Что такое молоко с точки зрения химии?
Молоко — это сложная биологическая смесь белков, жиров, сахаров, витаминов и минеральных веществ, растворенных в воде. Основной белковый компонент — казеин — состоит из гидрофильной (любящей воду) «головы» и гидрофобного (боящегося воды) «хвоста».
Молекулы белков и жиров плохо растворимы в воде, однако в молоке они равномерно распределены по всему объему (диспергированы), поэтому молоко выглядит однородным. Молекулы белка казеина в молоке объединены в маленькие шарообразные структуры — мицеллы. В их центре расположены гидрофобные «хвосты» молекул, а снаружи (то есть в воде) — гидрофильные «головы». Давайте проведем эксперимент.
Опыт № 1. Цветное молоко. Нанесем на поверхность молока в чашках Петри несколько капель красителей.
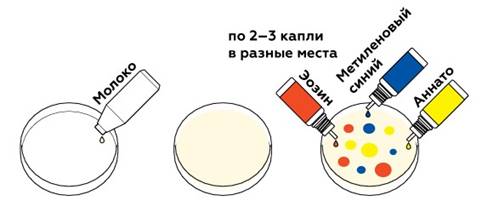
Попробуйте добавить каплю мыла.
.
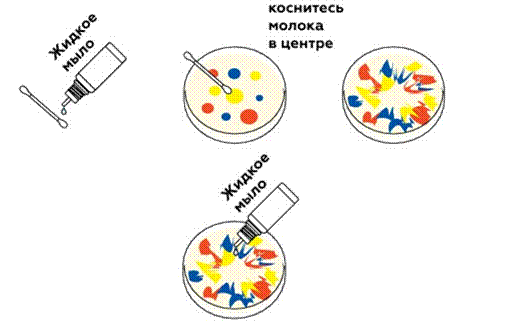
Жидкое мыло очень быстро тонкой пленкой «разбегается» по поверхности молока и увлекает за собой красители, образуя красивый цветной узор.
Поэкспериментируйте с разными жидкостями! Например, вместо молока возьмите обычную воду. Если вы работаете с прозрачной посудой, лучше подстелить под нее белую бумагу — тогда узоры будут смотреться более контрастно. Это интересно. Что такое поверхностное натяжение?
В толще воды каждая молекула H2O окружена такими же, как она, соседями. А вот на поверхности молекул касаются не только «собратья», но и воздух. По всей толще воды между молекулами образуются одинаковые связи. Но поскольку с внешней стороны притяжения нет, молекулы поверхностного слоя сильнее связаны с молекулами, находящимися в толще. Чем больше сила притяжения, тем ближе друг к другу располагаются молекулы. Поэтому молекулы воды на поверхности слегка «вжаты», напряжены. Поверхностное натяжение — это характеристика любой жидкости, сила, которая действует на молекулы ее поверхностного слоя.
Поверхностное натяжение используют водяные клопы водомерки. Они скользят по воде и не проваливаются в нее. Молекулы воды взаимодействуют с большей силой, чем давление лапок водомерки, которые стремятся эту связь разорвать.
Толща воды удерживает не только водомерку. Проведите эксперимент: аккуратно положите скрепку на воду — она не утонет.
А теперь перейдем к следующему напитку, я точно знаю, все его знают и любят. Он бывает черный, зеленый, белый и даже красный! Что это? Конечно чай.
Опыт № 2. Чайный индикатор. Реагенты: гидроксид натрия, лимонная кислота.
Пошаговая инструкция
Заварим черный чай.
Разольем поровну по трем стаканам детям.
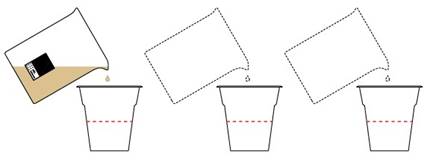
В первом стакане создадим кислую среду, добавив лимонную кислоту. Во втором стакане оставим нейтральную, а в третьем — создадим щелочную с помощью стиральной соды Na2CO3.
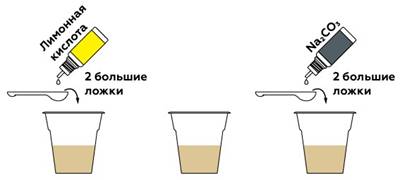
Цвет чая меняется в зависимости от кислотности, а значит, чай можно использовать как pH-индикатор.
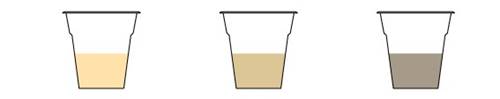
Почему в кислой среде чай светлеет, а в щелочной темнеет?
В листьях черного чая содержится много теарубигина — пигмента, который отвечает за цвет напитка. Его структура до конца не изучена, но известно, что в кислой среде она изменяется таким образом, что заваренный чай светлеет. То же самое происходит, когда мы добавляем в чай кусочек лимона. И наоборот: чай темнеет, когда мы добавляем щелочной раствор гидрокарбоната натрия.
А вот с зеленым чаем опыт будет не таким наглядным. Его собирают совсем молодым, когда листья еще не успевают накопить достаточно пигмента.
Что такое pH-индикатор?
pH-индикатор помогает определить значение pH раствора, то есть его кислотность. pH раствора определяется концентрациями ионов водорода H+ и гидроксид-ионов OH- в нем.
Существует множество различных pH-индикаторов, меняющих окраску в зависимости от кислотности раствора. Некоторые меняют цвет всего один раз. Например, лакмус: при pH<4,5 он красный, а при pH>8,3 — синий. В промежутке между этими значениями можно наблюдать оттенки фиолетового - результат смешения красного и синего цветов в разной пропорции. Другие индикаторы меняют цвет несколько раз, и чем больше таких ярких переходов, тем точнее они указывают на значение pH раствора. Раз заговорили о кислоте и кислотности среды давайте поговорим о том, где вы встречали кислый вкус? Это интересно. Почему лимоны кислые?
Персики и клубника часто ассоциируются со сладкими десертами. Но есть фрукты, от которых непроизвольно морщишь нос. Конечно, речь идет о лимонах. «Кислую мину» эти цитрусовые вызывают неспроста, ведь на вкус они кислее, чем апельсины и грейпфруты. Но откуда же берется такой кислый вкус?
Всё дело в высокой концентрации лимонной кислоты (C₆H₈O₇) — слабой органической кислоты, содержащейся во многих фруктах и овощах. Химики измеряют кислотность веществ по рН-шкале, имеющей диапазон от 0 до 14. Значение рН указывает, сколько ионов водорода содержится в том или ином веществе. Чем меньше число, тем сильнее кислота. рН лимонной кислоты составляет 2, то есть практически столько же, сколько и в растворе соляной кислоты, известного нам как желудочный сок (рН=1,5–3,5). Лимонная кислота содержится в апельсинах, грейпфрутах и ягодах, но из всех цитрусовых ее больше всего в лимонах и лаймах.
Давайте узнаем, как с помощью лимонной кислоты сделать домашнюю газировку:
Опыт № 3. Домашняя газировка. В стакан насыпаем 1 ч. л. пищевой соды, 1 ч. л. сахара, выдавливаем сок половинки лимона, наблюдаем выделение СО2. Добавляем воды. Газировка готова! Можно пробовать! Гидрокарбонат натрия взаимодействует с кислотами, содержащимися в соке лимона и выделяется углекислый газ.
А теперь снова вернемся к молоку и вашей любимой газировке – кока коле
Опыт № 4. Молоко и кола.
Пошаговая инструкция
Чтобы излишки газа не мешали проведению опыта, выпустим их, помешивая колу.
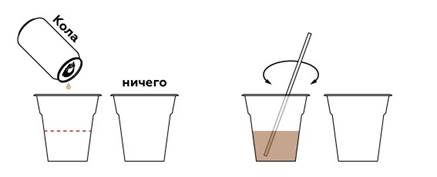
Чтобы «очистить» колу, нам понадобится молоко.
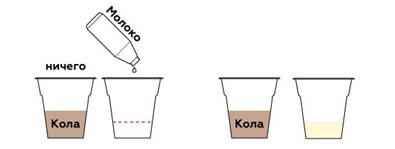
Краситель в коле — карамельный колер — легко прилипает к молекулам белка в молоке.
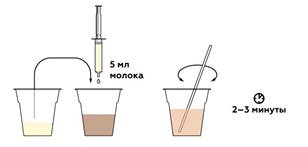
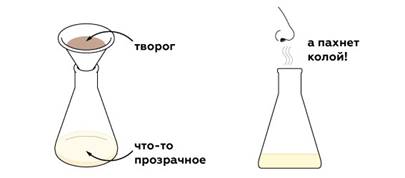
Кола имеет кислую среду, поэтому молоко створаживается. Чтобы отфильтровать его, нам понадобится бумажный фильтр.
Карамельный колер сорбируется створоженным молоком и остается с ним на фильтре.
Вот и получилась «прозрачная кола»!
Что произойдет, если в колу добавить молоко?
Помимо сахара и воды, кола содержит ряд других ингредиентов, в том числе и ортофосфорную кислоту (H3PO4).
По словам производителей, ортофосфорная кислота придает особую кислинку напиткам Dr.Pepper и Coca-Cola (классической, диетической и «зеро»). В целом с ними можно согласиться, ведь этот компонент создает в напитке кислую среду, или другими словами, понижает кислотность раствора (в данном случае - напитка).
Молоко состоит из белков, жиров, микроэлементов и воды. При этом реакция молока примерно нейтральная (pH≈7) — почти как у воды. Когда мы добавляем молоко в колу, структура молочных белков меняется под действием кислоты, и те слипаются друг с другом и с каплями жира. В результате молоко створаживается.
Что осталось на фильтре?
Творожистая масса темно-бежевого цвета — это результат взаимодействия молочных белков и протонов ортофосфорной кислоты. Фактически мы получили творог кислотным створаживанием молока. Этот способ часто используется и в промышленности. Поэтому полученные таким образом молочные продукты можно встретить на полках в супермаркете.
Почему кола стала бесцветной, а осадок — коричневым?
В составе колы есть краситель «карамельный колер». По международной классификации он известен как Е150. Краситель выпадает в осадок вместе со створоженными белками, т.к. фактически прилипает к ним. Это происходит благодаря водородным связям, которые образуются между некоторыми атомами молекул красителя и белка.
Молекулы ароматизатора никак не взаимодействуют с молочными белками и попадают в колбу. Поэтому отфильтрованная жидкость отчетливо пахнет колой.
Опыт № 5. Фрукты против йода.
Реагенты
Сульфат меди (II)
Йодид калия
Аскорбиновая кислота Пошаговая инструкция
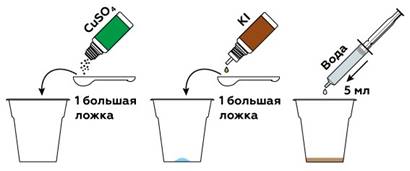
Для начала приготовим образцы фруктов и овощей. Лимон, апельсин, киви, банан, редька, лук и чеснок, а также болгарский перец отлично подойдут. Чтобы проанализировать образцы, понадобится йод, который мы получим в реакции иодида калия KI с сульфатом меди CuSO4. Сделать р-р сульфата меди, а затем понемногу добавлять йодид калия до темно коричневого цвета.
Бумага, покрытая йодом — отличный индикатор на аскорбиновую кислоту.
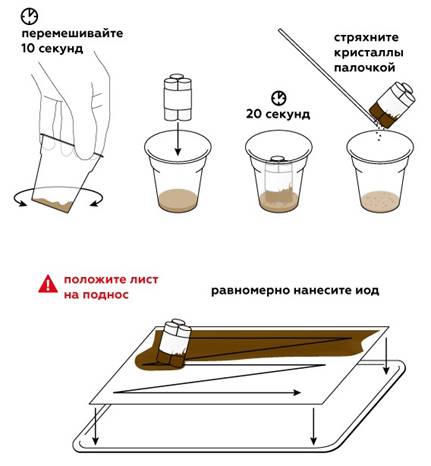
Когда сок из срезов вступает в контакт с йодом, начинается химическая реакция йода с аскорбиновой кислотой, в которой йод превращается в бесцветные иодиды.
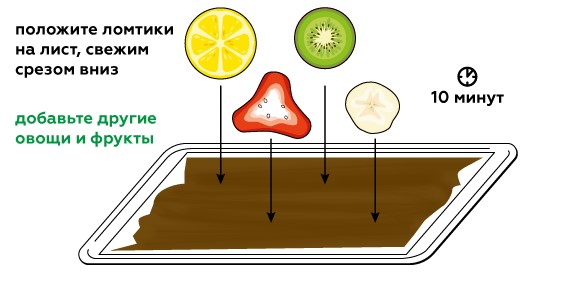
По тому, насколько обесцветился йод под кусочком, можно понять, как много аскорбиновой кислоты было в образце.
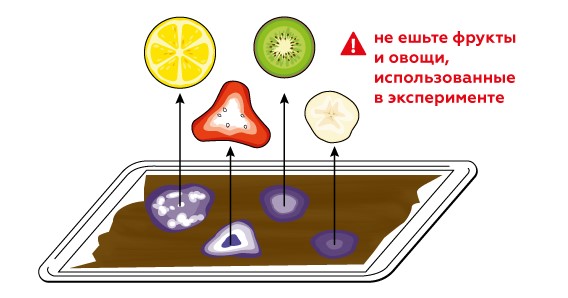
Также отдельным пятном в конце капнуть воды и насыпать немного аскорбиновой кислоты из пакетика. Сказать, что это химически выделенная кислота, но зачем она нам если так много ее содержится в обычных овощах и фруктах которые можно и НУЖНО ЕСТЬ!
Что произошло? Что такое аскорбиновая кислота, и зачем она нужна?
А вы знаете, что кислород — это почти яд? 2,5 миллиарда лет назад он чуть было не истребил всю жизнь на Земле! Всё дело в том, что кислород — это сильный окислитель: он может легко забирать электроны у других соединений. Для организмов, подобных нашему, это даже хорошо: мы получаем энергию благодаря окислению органических соединений. Но, с другой стороны, органические соединения, из которых состоят организмы, от окисления могут разрушиться.
Для защиты от окисления многие организмы вырабатывают вещества, которые окисляются легче других и при взаимодействии с окислителями вроде кислорода «вызывают огонь на себя». Аскорбиновая кислота у растений как раз из таких веществ.
Чтобы увидеть, как аскорбиновая кислота взаимодействует с окислителями, можно использовать йод I2 . йод — тоже окислитель, но, в отличие от кислорода, он имеет насыщенную окраску. Когда йод забирает у аскорбиновой кислоты электроны, он образует бесцветные йодид-ионы I- (атомы йода с избытком электронов). Чем больше аскорбиновой кислоты содержится во фрукте или овоще, тем больше йода превратится в йодидионы и тем меньше его останется на бумаге.
Аскорбиновая кислота — это не только антиоксидант. Это вещество мы знаем как витамин С — важнейший участник биохимических процессов в организме. Например, он обеспечивает работу некоторых ферментов. Самостоятельно организм человека не может вырабатывать витамин С, поэтому его необходимо получать из пищи, например, из фруктов и овощей. Недостаток витамина С вызывает у человека цингу — болезнь, которая сопровождается слабостью и выпадением зубов. До открытия этого факта в ХХ веке, люди, не имевшие доступа к фруктам и овощам (например, моряки), страдали от этой болезни. Поэтому если у пирата нет зубов, помните: не факт, что он лишился зубов в суровой схватке — возможно, он просто ел мало овощей!
Откуда в нашем опыте получается йод?
йод образуется при смешивании сульфата меди CuSO4 с раствором иодида калия KI. Между ними протекает следующая реакция: 2CuSO4 + 2KI → CuSO4 + K2SO4 + I2
Образуется йод, который придает раствору коричневатый оттенок.
А теперь давайте попробуем увидеть, как выглядит качественная реакция йода с крахмалом.
Опыт № 6. Крахмал+йод. Налейте воду в пробирку и капните туда 4–5 капель йода. Добавьте щепотку крахмала и хорошо перемешайте палочкой. В итоге вы сразу получите раствор темно-синего цвета.
Крахмал взаимодействует с йодом, образуя соединения включения, то есть клатрат. Этот химический процесс был открыт в далеком 1814 году учеными Жан Жаком Коленом и Анри-Франсуа Готье де Клобри.
Соединение включения — это особое соединение, в котором молекулы одного вещества внедряются в молекулярную структуру другого вещества. В данном случае молекулы амилозы (один из основных полисахаридов крахмала) будут «хозяевами», а молекулы йода — «гостями».
Кстати, этот опыт можно повторить и другим способом. Например, в небольшую горку крахмала капнуть одну капельку йода, в результате получится темно-синее пятно. Также йод можно капнуть на половинку картофеля (известен повышенным содержанием крахмала). Если опустить очищенную картофелину в холодную воду, через некоторое время в воде будут появляться частички крахмала. Если подержать очищенный картофель в руках, на них также останется крахмал.
Кстати, если потом в течение 10 секунд нагревать пробирку с раствором крахмала, йода и воды на специальной химической горелке, раствор станет бесцветным. Это объясняется тем, что соединение йода и крахмала неустойчиво, но если подержать пробирку в холодной воде, то вновь будет образовываться осадок темно-синего цвета. ПОГРЕТЬ ПРОБИРКУ НА ГОРЕЛКЕ.
При нагревании крахмала до кипячения он начинает разрушаться, и цепи амилозы будут рваться. Так образуются короткие цепочки декстринов, поэтому цвет начинает меняться. Кстати, отдельные соединения глюкозы при реакции с йодом не дают цвета.
Итак, ребята, сегодня мы с вами поговорили о напитках, о молоке и его свойствах створаживаться под действием кислот и специальных солей, о чае и том, что это природный рН индикатор, о кока-коле и ее вредности, как напитка, содержащего большое количество ортофосфорной минеральной кислоты. Также мы сделали более полезную домашнюю газировку, которая должна заменить вам вредную колу!
ТАКЖЕ был опыт, связанный с определение аскорбиновой кислоты во фруктах и овощах, убедились, что ее очень много в цитрусах, болгарском перце, луке и чесноке. ОВОЩИ и фрукты НУЖНО ЕСТЬ, ОНИ ОЧЕНЬ ПОЛЕЗНЫ С ХИМИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ!
Реактивы:
1. молоко, жидкие красители
2. р-р NaOH, лимонная к-та
3. NaHCO3, лимон, сахар
5. CuSO4, KI, аскорбиновая к-та
5. крахмал, йод
© ООО «Знанио»
С вами с 2009 года.
![]()

