Методика изучения периодического закона и периодической системы элементов Д.И. Менделеева.
В дидактике химии периодическому закону Д.И. Менделеева отводится ведущая роль, т.к. он является теоретической методологической основой изучения химии. Как известно, Д.И. Менделеев работал над периодической системой в период своей преподавательской деятельности и помимо задачи систематизации химических элементов, приведшей к открытию периодического закона, перед ним стояла проблема разработки учебного курса – курса, который в дальнейшем стал основой всемирно известного учебника «Основы химии».
Сегодня поиски методистов направлены на то, чтобы найти пути наиболее полного использования образовательных, воспитывающих, развивающих возможностей темы.
Образовательные задачи темы «Периодический закон» выражаются в формировании у учащихся понимания сущности явления периодичности, в выработке умения пользоваться периодической системой для объяснения, сравнения и прогнозирования свойств химических элементов.
Развивающий аспект темы выражается в возможностях содержания темы для развития приёмов мышления, особенно при использовании проблемного подхода; в этой теме претерпевают значительный скачок важнейшие понятия (о химическом элементе, веществе, химической реакции), следствием чего также является развитие мышления учащихся.
Воспитательные задачи темы заключаются в следующем: обеспечить понимание значения периодического закона и периодической системы для развития науки и производства, показать на примере учения о периодичности объясняющую, обобщающую и прогнозирующую роли научной теории, роль практики в процессе познания; раскрыть диалектико-материалистические закономерности и принципы.
Вследствие важного значения темы «Периодический закон и периодическая система химических элементов» особую роль приобретает проблема её места в школьном курсе, проблема взаимосвязи периодического закона и теории строения вещества.
Крайними по своей сути были подходы, согласно которым:
- периодический закон рассматривался после изучения химии элементов, при этом в малой степени реализовывались возможности научной теории;
- изучение периодического закона переносилось к самому началу курса химии, ученики воспринимали этот материал схоластически.
В большинстве современных программ реализуются следующие условия, определяющие место данной темы в школьном курсе:
- обеспечить достаточную фактологическую базу для вывода закона;
- изучать все группы химических элементов на теоретической основе периодического закона;
- рассматривать структуру и закономерности периодической системы, не отделяя их от теории строения атомов.
Выделим основные этапы изучения периодического закона и периодической системы.
На первом, подготовительном, этапе учащиеся усваивают основные понятия, необходимые для дальнейшего усвоения периодического закона. Это понятия об атоме, химическом элементе, атомной массе, валентности, о простых и сложных веществах, о классах неорганических соединений и их генетических связях. Происходит также накопление фактов об отдельных химических элементах и их соединениях.
Второй этап представляет непосредственное изучение периодического закона и периодической системы, теории строения вещества.
На третьем этапе при изучении химии элементов происходит конкретизация учения о периодичности.
Четвёртый этап – этап обобщения и углубления данной теоретической концепции. Существует несколько методических подходов к изучению периодического закона. Так, вывод периодического закона на основе изученных важнейших классов неорганических соединений и сформированных понятий о естественных группах химических элементов характеризует исторический подход. Другой подход, когда сначала изучается теория строения атома, а затем выводится периодический закон в свете электронных представлений, характеризует логический подход. Изучение периодического закона в первом случае является исследовательским для учащихся, так как они сами приходят к выводу о естественной взаимосвязи элементов. Кроме того, данный подход отражает логику открытия закона в истории науки. Изучение строения атома до периодического закона в этом отношении является уязвимым: именно открытие периодического закона стимулировало развитие науки в области строения атома и вещества, поиск причин периодичности; при этом в меньшей степени реализуется воспитательный и развивающий аспект изучения периодического закона.
В практике преподавания часто сочетаются оба подхода – принцип сочетания исторического, логического и дидактического. Сначала раскрывается явление периодичности в трактовке Д.И. Менделеева, затем сразу же после этого изучается теория строения атома и периодический закон, периодичности в свете этой теории; таким образом, выявляется сущность учения о периодичности, прослеживается развитие периодического закона и периодической системы элементов. Такая последовательность изучения соответствует историческому процессу развития знаний о периодическом законе.
Реализация развивающей функции обучения осуществляется через проблемный подход к изучению темы. Важным методом проблемного обучения должна стать самостоятельная поисковая деятельность учащихся.
При обращении к классификации химических элементов может быть обсужден ряд проблемных вопросов.
Почему возникает проблема классификации элементов? Какие этапы она прошла? Как классифицируются химические элементы в настоящее время? Эти вопросы решаются постепенно, в системе уроков. В начале темы учащиеся убеждаются, что классификация элементов на металлы и неметаллы несовершенна (не имеет четких границ ни при рассмотрении физических свойств простых веществ, ни при рассмотрении генетических рядов металлов и неметаллов – выявляются ряды переходных элементов, оксиды и гидроксиды которых амфотерны). Таким образом, встают проблемы: каким образом может быть осуществлена научная классификация химических элементов? на основании каких признаков? Эти вопросы являются естественным переходом к рассмотрению периодического закона и периодической системы. Отмечается один из признаков истинной классификации – возможность предсказывать неизвестные факты (свойства элементов).
Для выявления системы классификации используется работа с карточками, в которых отражены сведения об элементах малых периодов: химический символ, атомная масса, высшая валентность, формулы высшего оксида и гидроксида. Учитель предлагает учащимся самим в ходе самостоятельной работы «открыть периодический закон», выявив взаимосвязь элементов. При этом возможно два варианта:
- учащиеся раскладывают в ряд карточки химических элементов по мере возрастания атомных масс, а затем объединяют сходные элементы в вертикальные столбцы;
- учащиеся объединяют элементы в группы на основании высшей валентности, формы и характера их соединений. Упорядочение элементов внутри групп и между группами достигается на основе учета атомной массы.
Какой подход предпочесть? 2-ой подход, который соответствует процессу познания от единичного (свойства отдельных элементов) к более общему, характерному для отдельных групп объектов (выделение естественных семейств элементов). Как завершающий этап – выделение ещё более общего, которое связывает отдельные группы объектов (открытие периодического закона).
Д.И. Менделеев обнаружил, что свойства меняются нелинейно (немонотонно), а периодически, то есть через определенное число элементов встречаются сходные. Эту закономерность и называют законом периодичности.
Особое внимание обращается на трудности поиски зависимости между атомными массами и свойствами элементов; эти трудности обусловлены следующими обстоятельствами:
- атомные массы некоторых элементов были неточно определены, что приводило к путанице в случае формального использования этих величин;
- к середине XIX в было открыто всего 63 химических элемента.
Необходимо обратить внимание учащихся на отличие подходов к классификации химических элементов, предложенных разными учеными.
При переходе к рассмотрению современного толкования периодического закона проблемно может быть рассмотрена причина периодического изменения свойств элементов. Почему при постоянно возрастающих зарядах атомных ядер свойства химических элементов изменяются периодически?
Для решения этой проблемы необходимо проследить цепочку взаимосвязей:
- заряд атомных ядер является характерным, самым существенным признаком химических элементов;
- заряд ядра определяет общее число электронов (они численно равны); эти характеристики по мере увеличения порядкового номера элемента постоянно возрастают;
- число валентных электронов, их распределение по атомным орбиталям изменяется периодически, а поскольку именно валентные электроны влияют на химические свойства элементов, то последние также подчиняются периодическим зависимостям.
Для выявления этих закономерностей учащимся предлагается занести на карточки схемы электронного строения 20 первых химических элементов (с указанием числа электронов на каждом энергетическом уровне). Анализируя эти карточки, расположенные по периодам и группам в соответствии с периодической системой, учащиеся замечают, что число электронных слоёв равно номеру периода и что число электронов на внешнем слое изменяется периодически, что и является причиной периодического изменения свойств элементов.
Вопрос о влиянии строения внешнего электронного слоя может быть рассмотрен более подробно, а именно можно показать, что повторяется не только число валентных электронов, но и характер распределения электронов по подуровням, орбиталям. Для этого можно использовать модели внешнего электронного слоя (отмечается периодическая повторяемость строения внешней электронной оболочки).
При рассмотрении периодической системы химических элементов проблемно могут быть рассмотрены вопросы о структуре периодической таблицы.
- Каковы причины деления элементов на периоды, группы, подгруппы?
- На каком основании элементы объединяются в одну группу, подгруппу, в период?
- Почему в таблице имеются большие и малые периоды?
- Почему в больших периодах неодинаковое число элементов?
- Почему 1-ый период состоит только из 2-х элементов?
- Возможно ли ещё открытие элементов 1-го периода?
- Могут ли ещё быть открыты элементы, стоящие в периодической системе до водорода (проблема нижней границы периодической системы)?
Проблемным можно назвать и такой подход, когда учитель подводит учащихся к самостоятельному определению понятий «период», «группа», «подгруппа» химических элементов. При анализе различных определений следует остановиться на вопросе о выделении наиболее существенных признаков.
Сравните следующие определения:
- Период – это горизонтальный ряд химических элементов периодической системы, начинающийся щелочным металлом и заканчивающийся инертным газом (в определении отражены лишь внешние признаки);
- Период – совокупность химических элементов с одинаковым числом электронных слоёв в атоме, в пределах которой происходит постепенное накопление электронов на внешнем (пред внешнем) уровне, обусловливающее ослабление металлических и нарастание неметаллических свойств (определение сформулировано на основе теории строения атома).
Сформулируйте определение подгруппы химических элементов:
(Подгруппа представляет совокупность химических элементов, сходных по строению электронных оболочек, число которых и радиус атомов возрастают с увеличением зарядов их ядер атомов, что приводит к ослаблению неметаллических свойств и усилению металлических свойств).
Для решения проблемного вопроса: «Почему при построении периодической системы Д.И. Менделеев в отдельных случаях допускал расположение химических элементов не в порядке увеличения атомных масс»? – учащиеся должны обладать знаниями об изотопах, понимать различия между массой единичного атома и относительной атомной массой химического элемента. Внимание учащихся обращается на то, что массы атомов должны выражаться целыми числами (точнее, близкими к целым числам). Однако, относительные атомные массы большинства химических элементов выражаются дробными числами. Это происходит потому, что относительная атомная масса – это средняя величина числовых значений масс атомов данного элемента с учетом их распространения в природе. От соотношения тяжелых и легких изотопов и зависит относительная атомная масса. Разным соотношением тяжелых и легких изотопов объясняются и перестановки элементов в периодической системе.
Для установления связи периодического с последующими открытиями в физике, химии учащимся предлагается проблемный вопрос: Каким образом повлияло открытие периодического закона на дальнейшее развитие науки? Решение этой проблемы может превратиться в настоящее теоретическое исследование.
Таким образом, мы выделили основные группы проблемных вопросов раздела «Периодический закон. Строение атома».
При разъяснении учебного материала по отдельным темам школьного курса химии, следует использовать, кроме классической схемы подготовки конспекта урока, материал, которого нет в учебнике, но он связан с изучаемой темой.
В настоящее время при изучении отдельных тем химии необходимо использовать материал, связанный с экологическими проблемами.
Роль химии в решении экологических проблем на современном этапе значительна:
а) изучая состав, строение и свойства веществ, химия может ответить, как ведет себя то или иное вещество в атмосфере, почве, водной среде, какие воздействия оказывает оно и продукты его превращений на биологические системы;
б) раскрывая механизмы биогеохимических процессов в природном круговороте элементов, химия способствует решению задачи наиболее естественного и “безболезненного” вхождения промышленного производства в природные циклы, делая его частью какой-либо экосистемы;
в) используя разнообразные методики химико-аналитического контроля состояния объектов окружающей среды или качества готовой продукции ряда отраслей промышленности (химической, нефтехимической, микробиологической, фармацевтической), химия позволяет получить информацию, необходимую для последующего принятия решений о предотвращении поступления вредных веществ в контролируемые объекты, очистке этих объектов, способах их защиты и т.д.
Экологизированный курс химии дает возможность раскрыть особую роль этой науки в борьбе с экологическим невежеством, проявляющимся в укоренившемся представлении о “виновности” химии в сложившейся экологической ситуации, привлечь школьников к исследовательской работе по изучению состояния природной среды, воспитать у них чувство личной ответственности за ее сохранение.
VIII класс
Тема «Первоначальные химические понятия»
При изучение темы «Первоначальные химические понятия», учащиеся должны получить начальные представления о химическом элементе и связанных с ним понятиях. Помимо теоретических знаний учащиеся приобретают практические умения по проведению химического эксперимента, например при очистке веществ и разделении смесей. В связи с этим представляется возможным ознакомить учащихся с рядом понятий природоохраняемого характера: загрязнители, источники загрязнений, современные способы очистки веществ (отходов) в промышленности.
Коротко о проблеме отходов. По некоторым оценкам, человечество использует примерно 11 млрд. тонн различных веществ и природных материалов. К концу века их потребление может утроиться. От 50 до 90 % первичного природного вещества в процессе его переработки и потребления превращается в отходы.
В мире ежегодно добывают более 4 млрд. нефти и природного газа, более 2 млрд. тонн горной массы в виде руд и сопровождающих горных пород. Горючие ископаемые, руды, горные породы, подвергаясь переработке, попадают в воздух, почву, воду.
Не все вещества, попадающие в окружающую среду загрязнители: к ним относятся только те, которые вызывают нарушение ее качества. К числу химических загрязнителей, которые, например, попадают в организм человека с пищей, относятся: нитраты и нитриты, радионуклиды, пестициды и продукты их разложения, тяжелые металлы, стимуляторы роста животных и др. Их источники – промышленность, сельское хозяйство, энергетика.
Остро стоит вопрос об очистке отходов любого производства, поскольку идеальная модель безотходной технологии еще не создана. К современным методам очистки можно отнести: фильтрацию, пыле-, газоулавливание, обезвреживание (нейтрализация, окисление, восстановление, поглощение газов жидкими и твердыми поглотителями), биологическую очистку (очистку при помощи микроорганизмов), обеззараживание сточных вод, осаждение (в отстойниках), перевод веществ в малорастворимые или нерастворимые соединения.
С некоторыми методами учащиеся знакомятся при выполнении лабораторных и практических работ.
Учащимся можно порекомендовать ознакомиться с дополнительной литературой по этим вопросам и выполнить творческую работу. Не все школьники примут участие в подобной работе, остальным можно предложить следующие задания:
- Найдите в печатных изданиях (газетах, журналах, книгах) сообщения о неблагоприятных экологических ситуациях. Составьте краткий реферат или аннотацию, прочитанного вами. Сформулируйте своё отношение к этой публикации. Представьте себе, что вы ответственное лицо, и предложение свой вариант решения.
- Прочтите предложенный вам текст (или посмотрите картинку). Перечислите неправильные действия, которые совершил человек (или группа людей) в отношении природы. Как поступили бы вы?
- Используя свой опыт, придумайте (или опишите) ситуацию, в которой по вине человека страдает природа (её обитатели). Предложите всем товарищам проанализировать её. Оцените их ответы.
- Предложите правила поведения школьника в природной среде: а) на отдыхе; б) во время экскурсии; в) при выполнении общественно полезного труда вне школы.
- Охарактеризуйте экологическую обстановку:
а) на вашем пришкольном участке;
б) около дома, подъездов, на лестничных площадках, в жилище;
в) около ближайших предприятиях, учреждений, магазинов;
г) в ближайшем парке, лесу, на речке, озере, пруду.
6. Что лично вы можете сделать для сохранения и улучшения природной среды?
Тема «Кислород. Оксиды. Горение»
В ходе изучения данной темы обсуждается роль кислорода в жизни живых организмов. Учащимся известно, что основная жизненно важная функция организма – это дыхание. Химическая сущность состоит в соединении углерода и водорода органических веществ с кислородом воздуха. Как у животных, так и у растений оно происходит в этом плане одинаково. Однако у растений параллельно протекает процесс питания: под действием солнечных лучей растение синтезирует необходимые ему органические вещества из углекислого газа и воды, причем в атмосферу возвращается свободный кислород. Общее его количество, выделяемое растениями в процессе питания, примерно в 6 раз больше потребляемого ими при дыхании.
При сравнении влияния кислорода и озона на организм человека следует подчеркнуть, что небольшое содержание озона в воздухе благотворно действует на организм, особенно при болезнях дыхательных путей. Напротив, в более высоких концентрациях озон сильно ядовит, чего нельзя сказать о самом кислороде. Поскольку кислород – важная составная часть воздуха, следует подробно остановиться на главных источниках загрязнения атмосферы и последствиях этого процесса. Основные источники техногенного загрязнения атмосферного воздуха в промышленных районах – транспорт, предприятия, ТЭС.
В России на долю автотранспорта в общем загрязнении атмосферы приходятся на 15%, в США - 60%. Выхлопные газы автомобилей содержат вредные примеси. По данным французского ученого Ж. Дерти, выхлопные газы от бензиновых и дизельных двигателей имеют соответственно примерно следующий состав: углекислый газ - 9,0 и 0,9%; оксид углерода(II) - 4,0 и 0,1%;оксид азота - 0,06 и 0,04 %;оксид серы (IV) - 0,006 и 0,02%; кислород - 4,0 и 9,0 %; водород -2,0 и 0,03. От каждой тысячи автомобилей за день в воздух поступает более 300 кг оксида углерода (II), весьма токсичного вещества.
ТЭС средней мощности, работающее на угле, только за 1 час сжигают более 80 т угля и выбрасывают в атмосферу примерно 5 т оксида серы (IV) и 16-17 т золы.
Реактивные самолеты в полете выделяют вредные примеси: альдегиды — 0,7 мг/см3, СО - 6,5 мг/см3углеводы — 1,7 мг/см3, оксиды азота - 4,3 мг/см3, твердые частицы - 6,3 мг/см3.
Промышленность выбрасывает в атмосферу значительное количество твердых частиц (сажа, зола, копоть, пыль) и вредных газов (СО, СО2, углеводороды, оксиды серы и азота), образующихся при неполном сгорании топлива, на котором работают предприятия.
В 1 см3 городского воздуха содержится 100 тыс пылинок. Промышленность всех стран мира выбрасывает в атмосферу 6 млрд. тонн СО2 ежегодно.
Внимание учащихся следует обратить на то, что большинство загрязнителей атмосферы - оксиды, образующиеся в результате реакций горения или неполного окисления.
Учащиеся могут самостоятельно указать возможные источники загрязнения атмосферы, привести примеры воздействия некоторых загрязнителей на организм человека.
Далее рассматриваются оксиды неметаллов как загрязнители природной среды. Попадая в водоемы (пруды, озера, водохранилища), в ряде случаев они значительно закисляют их, вызывая тем самым гибель практически всех водных обитателей. Соединяясь с атмосферной влагой, оксиды превращаются в кислоты и выпадают на землю в виде «кислотных дождей», нанося огромный ущерб, как самой природе, так и объектам окружающей среды: металлическим конструкциям, бетонным сооружениям. Учащиеся приходят к выводу, что экономически более выгодно предотвратить загрязнения среды, чем длительное время и с огромными материальными затратами восстанавливать разрушенное.
Обсуждается влияние хозяйственной деятельности человека на круговорот кислорода в природе: уничтожение лесов, загрязнение поверхности мирового океана, огромное потребление кислорода на нужды промышленности.
При обсуждении мер борьбы с загрязнением атмосферы развивается понятие о рациональном использовании природных ресурсов и вводятся новые понятия: “экологически безвредные” и “безотходные” технологии. Отмечается что создание таких технологий - наиболее перспективное решение проблемы сохранения природной среды. Учащихся можно ознакомить с мероприятиями по охране воздуха от загрязнения:
- Правильное сжигание топлива; <li ">Строительство очистных сооружений;
- Замена ископаемого топлива на альтернативные источники энергии;
- Совершенствование технологии производства и модернизация автотранспорта;
- Улучшение планировки городов, сел и расширение площадей зеленых насаждений.
В этой теме получают развитие идеи охраны природы. Вводится понятие о мониторинге (в плане ознакомления) и о международном сотрудничестве в области защиты атмосферы. Раскрывается содержание статей “Закона об охране атмосферного воздуха”.
IX КЛАСС
Тема «Электролитическая диссоциация»
Данная тема позволяет познакомить учащихся с ионообменными процессами, происходящими в живой и неживой природе, раскрыть их взаимосвязь, расширить понятие о природном круговороте веществ и рассмотреть возможные причины его нарушения.
Учащиеся знакомятся с понятием «буферные системы», с действием таких систем в живой природе. Повторно рассматривается круговорот воды в природе (изучается в 8 классе), однако внимание учащихся акцентируется на его роли в поддержании природного равновесия, на негативных последствиях загрязнения морей и океанов для климата на планете. В этой же теме учащийся знакомится с химическими методами очистки воды от загрязнения. Достаточно подробно освещается проблема кислотных осадков (дождя, снега, тумана). Учащиеся самостоятельно составляют перечень веществ, образующих во влажной среде кислоты, а затем указывают источники поступления этих веществ в биосферу.
В качестве примера отрицательного воздействия кислотных дождей на природные системы рассматривается процесс заболевания водоема (озера) по мере снижения в нем рН воды. Отмечается, что первое время в водоеме сохраняется основная реакция (рН природной воды около 8) благодаря его естественным буферным свойствам — способности нейтрализовать поступающую кислоту (в виде осадков). Однако возможности буферных систем не безграничны. Понемногу вода в водоеме начинает подкисляться, что приводит к необратимым процессам в нем: гибнет планктон, моллюски, рыба, исчезают некоторые виды водорослей; бурно развиваются кислотолюбивые мхи, грибы и нитчатые водоросли; появляется сухопутный мох сфагнум, и водоем заболачивается, гибель обитателей водоема обусловлена не столько самим закислением, столько теми процессами, которые оно вызывает: падением содержания ионов кальция, выщелачивание (извлечение) из донных отложений токсичных ионов тяжелых металлов, дефицит кислорода, развитие анаэробных процессов, образование метана, сероводорода, углекислого газа.
Из числа мер, направленных на сохранение чистоты природных вод, подробно рассматривают химические методы очистки стоков: процессы окисления, восстановления и нейтрализации. Затем учащимся предлагается информация о других методах очистки сточных вод, применяемых в настоящее время: физических, физико-химических, биохимических и с помощью термического окисления. Информация предлагается не для запоминания, а для выполнения учащимися самостоятельной работы по обобщению полученных сведений в виде таблице “Современные методы очистки сточных вод”, в которой для каждого вида отходов они указывают соответствующие способы очистки.
Кислород (О2). Кислород на Земле создан самой жизнью. Рисунок иллюстрирует историю происхождения кислорода на планете Земля. Примерно 2 млрд лет назад содержание свободного кислорода в земной атмосфере начало возрастать. После того как из части атмосферного кислорода сформировался защитный озоновый слой, начали развиваться наземные растения и животные. С течением времени содержание кислорода в атмосфере значительно менялось, поскольку менялись уровни его образования и использования.
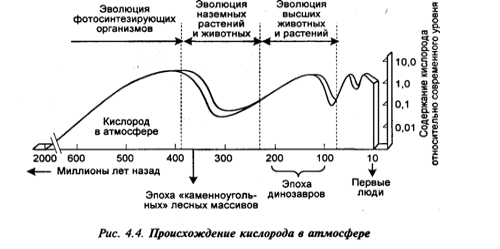
Главным продуцентом кислорода на Земле служат зеленые водоросли поверхности океана (60%) и тропические леса суши (30%). Тропические леса Амазонки называют легкими планеты Земля. Ранее в литературе высказывались опасения, что возможно уменьшение количества кислорода на Земле вследствие увеличения объема сжигаемого ископаемого топлива. Но расчеты показывают, что использование всех доступных человеку залежей угля, нефти и природного газа уменьшит содержание кислорода в воздухе не более чем на 0,15% (с 20,95 до 20,80%). Другая проблема – вырубка лесов, приводящая к возникновению кислородных «паразитов» – стран, которые живут за счет чужого кислорода. Например, США за счет своих растений имеет только 45% кислорода, Швейцария – 25%.
Озон (О3). Озон образуется в верхних слоях стратосферы и в нижних слоях мезосферы в результате протекания следующих реакций:
О2 + hv (=240 нм) = О + О,
O2 + О + М,
где М – различные составляющие атмосферы, например, кислород или азот.
Озон и атомарный кислород могут реагировать в кислородной атмосфере согласно реакциям:
O3 + hv (380 нм) = О2 + О,
О3 + О = 2O2,
О + О + М = O2+М.
Эти реакции образуют так называемый цикл Чепмена. Общее содержание озона иногда выражают как число молекул, получаемое в результате суммирования по всем широтам, долготам и высотам. На сегодняшний день это количество приблизительно равно 4·1037 молекул озона. Наиболее распространенной количественной оценкой состояния озона в атмосфере является толщина озонного слоя Х – это толщина слоя озона, приведенного к нормальным условиям, которая в зависимости от сезона, широты и долготы колеблется от 2,5 до 5 относительных мм. Области с уменьшенным содержанием на 40–50% озона в атмосфере называют «озоновыми дырами».
Около 90% озона находится в стратосфере. Долгое время считалось, что основной причиной истощения озонного слоя являются полеты космических кораблей и сверхзвуковых самолетов, а также извержения вулканов и другие природные явления.
Разрушительное действие хлорфторуглеродных соединений (ХФУ) на стратосферный озон было открыто в 1974 г. американскими учеными – специалистами в области химии атмосферы Ш. Роулендом и М. Молина (в 1996 г. за открытия в этой области им присуждена Нобелевская премия). С тех пор не раз предпринимались попытки ограничить выброс ХФУ в атмосферу, и тем не менее сейчас во всем мире ежегодно производится около миллиона тонн газообразных веществ, способных разрушить озонный слой.
ХФУ, часто встречающиеся в быту и в промышленном производстве, – это пропелленты в аэрозольных упаковках, хладоагенты (фреоны) в холодильниках и кондиционерах. Они применяются и при производстве вспененного полиуретана, и при чистке электронной техники.
Постепенно ХФУ поднимаются в верхний слой атмосферы и разрушают озонный слой – щит атмосферы, спасающий от УФ-излучения. Время жизни двух самых опасных фреонов – Ф-11 и Ф-12 – от 70 до 100 лет. Этого вполне достаточно, чтобы в ближайшее время ощутить на себе последствия сегодняшней экологической неграмотности. Если, сохранятся современные темпы выброса ХФУ в атмосферу, то в ближайшие 70 лет количество стратосферного озона уменьшится на 90%. При этом весьма вероятно, что:
- рак кожи примет эпидемический характер;
- резко сократится количество планктона в океане;
- исчезнут многие виды животных, например, ракообразные;
- УФ-излучение неблагоприятно скажется на сельскохозяйственных культурах.
Все это нарушает равновесие во многих экосистемах Земли, из-за фотохимического смога ухудшится общее состояние атмосферы, усилится «парниковый эффект».
ХФУ – высокостабильные соединения и поскольку они не поглощают солнечное излучение с большой длиной волны, они не могут подвергнуться его воздействию в нижних слоях атмосферы, но, преодолев защитный слой, поднимаются вверх по атмосфере и коротковолновое излучение высвобождает из них атомы свободного хлора. Свободные атомы хлора затем вступают в реакцию с озоном:
Сl + О3 = СlO + O2,
СlO + О = Сl + O2.
Таким образом, разложение ХФУ солнечным излучением создает каталитическую цепную реакцию, согласно которой один атом хлора способен разрушить до 100 000 молекул озона. Канцерогенным является УФ-излучение с длиной волны короче 320 нм. Ожидается, что каждый процент сокращения озонного слоя повлечет за собой увеличение числа случаев заболевания раком кожи на 5–6%.
Круговорот кислорода
Кислород играет важнейшую роль в жизни большинства живых организмов на нашей планете. Он необходим всем для дыхания. Кислород не всегда входил в состав земной атмосферы. Он появился в результате жизнедеятельности фотосинтезирующих организмов. Под действием ультрафиолетовых лучей он превращался в озон.
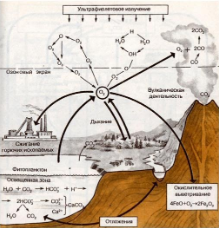 |
По мере накопления озона произошло образование озонного слоя в верхних слоях атмосферы. Озоновый слой, как экран, надежно защищает поверхность Земли от ультрафиолетовой радиации, гибельной для живых организмов.Круговорот кислорода в биосфере необычайно сложен, так как с ним вступает в реакцию большое количество органических и неорганических веществ, а также водород соединяясь с которым кислород образует воду. |
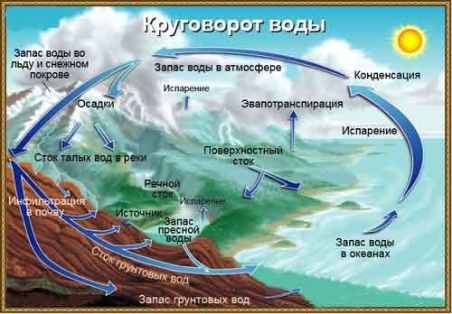
Круговорот воды
Вода испаряется и воздушными течениями переносится на большие расстояния. Выпадая на поверхность суши в виде осадков, она способствует разрушению горных пород, делает их доступными для растений и микроорганизмов, размывает верхний почвенный слой и уходит вместе с растворенными в ней химическими соединениями и взвешенными органическими частицами в моря и океаны. Циркуляция воды между океаном и сушей представляет собой важнейшее звено в поддержании жизни на Земле.
Парниковый эффект и стоимости кислорода
По какой-то странной иронии судьбы сразу, как только в Копенгагене закончился саммит ООН, посвященный проблеме потепления климата, на Европу, США и Россию обрушились небывалые снегопады и морозы. Можно подумать, что природа решила таким образом выразить свое несогласие с повесткой саммита – что в потеплении климата виноваты лишь так называемые парниковые газы. Участникам саммита не удалось достичь решений, которые позволили бы выработать единый план сокращения антропогенных выбросов парниковых газов и, таким образом, продолжить сотрудничество, заложенное в Киотском протоколе, действие которого заканчивается в 2012 году. На этом саммите речь шла о сокращении парниковых выбросов к 2020 году на 30 %, что позволит сохранить повышение среднемировой температуры на уровне двух градусов. Основная причина провала саммита – разногласия между развитыми и развивающимися странами, кто и сколько должен платить за сохранение экологии, удалось лишь договориться, что эта проблема будет обсуждаться в дальнейшем. Ни в коем случае не подвергая сомнению необходимость борьбы с парниковыми газами, хотелось бы поделиться некоторыми мыслями по этому поводу. Но сначала назову несколько общеизвестных сведений…
Парниковыми газами называются газообразные составляющие атмосферы, которые поглощают и переизлучают инфракрасное излучение и тем самым способствуют возникновению парникового эффекта, объясняющего потепление климата. Парниковые газы делятся на природные и антропогенные – то есть возникающие в результате производственной деятельности человека. Самый распространенный естественный парниковый газ – это водяные пары, обеспечивающие более 60 % парникового эффекта, однако его действие на создание парникового эффекта не рассматривается. Основным виновником климатических изменений называется углекислый газ, на долю которого по оценкам ученых приходится 64 влияния на глобальное потепление. При этом одним из источников углекислого газа являются не подвластные человеку вулканические выбросы, а основным его потребителем – растения, поглощающие приблизительно столько же углекислого газа, сколько и производят за счет гниения биомассы. Сведение лесов и сжигание биомассы обеспечивает, по подсчетам ученых, 12 % поступающего в атмосферу углекислого газа; производство, переработка и потребление ископаемого топлива – 86 % и 2 % приходится на все остальные источники.
Таким образом, объяснять причины потепления климата производственной деятельностью человека, с одной стороны, вполне логично, а с другой мы видим, что в этом процессе задействованы факторы, не зависящие от человека, и есть сведения, что потепления носят циклический характер. В качестве примера чаще всего приводят строки из поэмы Пушкина «Евгений Онегин»: «Зимы ждала, ждала природа, снег выпал только в январе», но у климатологов есть немало и других, более конкретных примеров.
С учетом всего этого объективно ли сводить проблему потепления только к влиянию парниковых газов антропогенного происхождения, а проблему экологической безопасности человечества – только к потеплению климата? Тем более что уже отмечалось существование обратной связи: повышение температуры увеличивает испарения, а облака отражают прямой солнечный свет, что уменьшает парниковый эффект. Кстати сказать, понижению температуры способствуют и механические составляющие вулканических выбросов. Еще одной насмешкой природы над идеей саммита в Копенгагене стало очередное оживление одного из вулканов на Филиппинах – в истории Земли были случаи, когда вулканические извержения становились причиной резкого похолодания. На этот раз масштабы извержения были не такими большими, но кто знает, не случится ли в будущем более мощного извержения с климатическими последствиями? А если опуститься еще ниже, то пыль и зола промышленных предприятий также способствуют уменьшению температуры, поскольку тоже отражают солнечный свет. Конечно, пока не в таких масштабах, как вулканический пепел. На саммите и перед саммитом раздавались голоса, что человек переоценивает свои возможности влияния на климат путем создания антропогенных парниковых газов, что внесло еще большую неясность в обсуждаемую проблему.
Всё это невольно приводит к мысли, что, взяв за основу решения экологической проблемы уменьшение выбросов антропогенных парниковых газов, человечество может оказаться в лабиринте, из которого не выберется – слишком уж неопределенны предложения и советы по выходу из него. Саммит в Копенгагене показал это со всей очевидностью. Нужен более точный и конкретный ориентир. В качестве такого ориентира более объективным представляется чистота атмосферного воздуха, а еще точнее – сохранность атмосферного кислорода.
Ученые, занимающиеся проблемой существования в космосе других цивилизаций, считают, что если обнаружится планета с достаточным наличием в атмосфере кислорода, то можно с уверенностью предположить, что на этой планете есть жизнь, в том числе, возможно, и разумная цивилизация.
Помимо того, что человек существует благодаря наличию в атмосфере кислорода, он широко использует кислород буквально во всех отраслях промышленности, во всех областях деятельности. Что такое углеводородное топливо, на котором держится современная промышленность? Это соединение горючего – газа, нефти, угля – с окислителем, которым является кислород. Черная металлургия поглощает свыше 60 % производимого кислорода, химическая промышленность – около 30 %. Ближайший «родственник» природного кислорода озон (О3) защищает Землю от ультрафиолетовых лучей, появление озоновой дыры над Антарктидой чуть было не вызвало в мире настоящую панику. Но отношение к использованию кислорода по-прежнему остается грабительским, не ограниченным ни здравым смыслом, ни законами. Между тем уже давно назрела необходимость поддерживать баланс техногенного потребления и воспроизводства атмосферного кислорода. По оценкам ученых в результате фотосинтеза в атмосферу Земли в настоящее время ежегодно поступает до 140 миллиардов тонн свободного кислорода. При увеличении добычи и сжигания органического топлива до 20 миллиардов условного топлива в год промышленное потребление кислорода из атмосферы составит около 50 миллиардов тонн и вместе с естественным потреблением превысит уровень его природного воспроизводства. Во многих развитых странах эта граница уже пройдена, и велика вероятность нарушения саморегуляции биосферы. Заслуженный энергетик России к.т.н. В.Болдырев в статье «Атмосферным воздухом по глобализации и кредиторам» задавался вопросом, применимо ли понятие «запасы» к «окислителю» — атмосферному кислороду? И далее писал:
«С позиции необходимости поддержания определенного содержания кислорода в атмосфере Земли сжигаемый атмосферный кислород должен постоянно и непрерывно восстанавливаться растениями путем фотосинтеза. При этом суммарная энергия, выделяемая при сжигании газа, мазута, бензина и угля в атмосферном кислороде, должна соответствовать количеству солнечной энергии, потребляемому растениями при фотосинтезе с целью воспроизводства такого же количества кислорода. Растения в виде производства кислорода и органического топлива воспроизводят тем самым затраченную животными и человеком потенциальную химическую энергию «топлива»«.
В случае если мощность существующей ныне энергетики, построенной на использовании органического топлива, превысит уровень воспроизводства атмосферного кислорода, то очень скоро будет израсходован весь кислород планеты. Автор статьи увязывает проблему сохранения кислорода с необходимостью развития ядерной энергетики, хотя она гораздо шире и актуальней. Кислородное голодание большинства промышленно развитых стран гораздо более важно для сохранения жизни на Земле, чем все разговоры о влиянии выбросов углекислого газа на потепление климата:
«Запрягая телегу впереди лошади, страны договорились, среди прочего, установить цену в 10 долларов США за каждую тонну углекислого газа, поглощенною «зелеными легкими» той или иной страны сверх её лимита выброса. Но ведь атмосферный кислород при сжигании углеводородного топлива расходуется не только на образование СО2, но и воды. Следовательно, поглотив даже весь углекислый газ, образующийся при сжигании углеводородного топлива, растения не восстанавливают первоначальное содержание кислорода в атмосфере. Если за одну «сверхлимитную» тонну СО2 промышленно развитые страны готовы платить 10 долларов, а при разложении этой тонны образуется 0,727 тонны кислорода, то получается, что эти страны готовы платить 13,8 доллара (10/0,727) за производство «зелеными легкими» 1 тонны атмосферного кислорода. Если применить такой подход к соглашениям по Киотскому протоколу, то мировое сообщество имеет шанс решить не только проблему «парникового эффекта», если она существует, но и решить проблему ликвидации кислородного голодания, т.к. за выбросы СО2 будет уже заплачено, если станут платить за потребление кислорода» (Промышленные ведомости. http://www.promved.ru).
О необходимости определения стоимости чистого воздуха и включения ее в себестоимость продукции я уже писал в статье «Сколько стоит чистый воздух»: «Маркс ошибался, не включив в стоимость конечной продукции воздух…Введение такого понятия, как стоимость воздуха, может кардинально решить проблему охраны воздушной среды от промышленных выбросов. Это именно тот случай, когда рыночный механизм способен заработать с полной отдачей и без всяких оговорок… Установив реальную стоимость воздуха, мы восстановим не только справедливость в отношении к этому бесценному природному богатству, но обретем еще один реальный рычаг для дальнейшего развития промышленности, причем такого развития, при котором – в перспективе – экологическая угроза будет сведена к минимуму» (http:// www.kondor-eco.ru/main/stat.htm).
Более правильно говорить о стоимости не воздуха, а конкретно кислорода, поскольку объемы его воспроизводства нашими «зелеными легкими» – лесами – можно легко подсчитать. Так, приводятся цифры, что тропические леса Бразилии производят ежегодно свыше 5 миллионов тонн так называемого избыточного кислорода, на триста тысяч тонн больше – леса России, составляющие четвертую часть лесных запасов мира. А есть страны, которые практически не воспроизводят кислород или воспроизводят его не в соответствии с потреблением. В первую очередь это касается развитых стран Западной Европы, США и Японии. В указанной выше статье В. Болдырев справедливо писал:
«Мировое сообщество должно найти справедливое решение этого вопроса. Если оно уже занялось квотированием промышленных выбросов углекислого газа, то более разумным является переход на квотирование промышленного потребления кислорода. Такое квотирование могло бы осуществляться на основе сопоставления, с одной стороны, количества добываемого и импортируемого для ежегодного сжигания органического горючего, а с другой стороны, ежегодного производства атмосферного кислорода природными зонами конкретной страны. Если страна производит кислорода больше, чем его сжигает в качестве обязательной компоненты топлива – окислителя, это может означать, что она часть своего атмосферного кислорода экспортирует. А за экспортируемую продукцию должны платить потребляющие ее соответствующие страны»
Именно на пути квотирования промышленного потребления кислорода и определения его стоимости может быть найден консенсус между развитыми и развивающимися странами в решении проблемы, кто и сколько должен платить за экологическую безопасность человечества. По крайне мере, таким способом можно более объективно оценить уровень влияния той или иной страны на состояние воздушной атмосферы, чем подсчитывать только промышленные выбросы. Другой вопрос – согласятся ли развитые страны платить за импортируемый ими кислород?
Однако, на мой взгляд, более справедливого распределения ответственности за экологическую безопасность, чем определение истинной стоимости потребляемого промышленностью кислорода, в настоящее время не существует. Я повторяю – истинной стоимости, которая должна учитывать не только объем потребления кислорода, но и объем его воспроизводства. Именно такой подход позволит разрешить конфликт между развитыми и развивающимися странами, так наглядно проявившийся на саммите ООН в Копенгагене. В основном воспроизводство кислорода происходит на территории развивающихся стран, а львиная доля его потребления приходится на развитые страны. Только разрубив этот узел противоречий, можно решить глобальную проблему экологической ответственности. А разрубить его в принципе просто: необходимо включить в себестоимость продукции стоимость потребленного кислорода за вычетом стоимости объема его воспроизводства в той или иной стране. Если страна не воспроизводит кислород, вычитания не происходит, соответственно увеличивается и цена продукции. Таким образом, на мировом рынке устанавливаются цены, объективно учитывающие не только технологический фактор, но и экологический. Развивающиеся страны получат реальную возможность приблизить свой экономический и промышленный уровень к развитым странам, а это в свою очередь послужило бы укреплению политической стабильности, которой человечеству так не хватает сегодня.
Казалось бы, предложенный подход к решению проблемы экологической ответственности должен давно заинтересовать и политиков, и экономистов. Однако этого не происходит. Предполагаю, что определение стоимости кислорода и включение ее в себестоимость продукции не нравится ни всесильным производителям, ни многочисленным потребителям органического топлива, уже привыкшим считать его бесплатным и неисчерпаемым даром природы. Но выиграет от этого – всё человечество, которое будет дышать более чистым воздухом и без страха смотреть в будущее.
Кто-то из ученых заметил, что если в природе есть бог – то это кислород. Может, было сказано в шутку, но, по сути, верно – без уважительного, бережного, достойного отношения к кислороду человечество погибнет раньше, чем опомнится и поймет его истинную, настоящую стоимость.
Водородное топливо
Широкомасштабное применение водородного топлива в автотранспорте пока не найдены неограниченные и дешевые источники энергии, лишено реальности…

Впервые на использование водорода в качестве моторного топлива было обращено внимание в 70-е годы в разгар энергетического кризиса, охватившего страны Западной Европы и США. И если в то время основной проблемой считалось сокращение мировых запасов углеводородных энергоносителей, то в настоящее время на первый план выдвигается угроза стремительно нарастающего над планетой экологического кризиса. Поэтому использование водорода в качестве энергоносителя рассматривается в большинстве проектов как фактор снижения экологического давления на окружающую среду, т. к. продуктами сгорания водорода с кислородом являются пары воды. Вода же рассматривается и основной сырьевой базой водорода.
Особенно критическая ситуация с загрязнением воздушного бассейна складывается в крупных городах и промышленных центрах. Анализ показывает, что несмотря на сравнительно небольшое в общем балансе энергоносителей потребление моторных топлив (14%), основным источником загрязнения окружающей атмосферы (60-70%) является городской автотранспорт. Причем значительная доля вредных выбросов приходится на грузовой и автобусный автопарки. Поэтому экологические проблемы в крупных городах в первую очередь связаны с работой автотранспорта, а точнее с использованием нефтяных моторных топлив.
В связи с актуальностью экологической проблемы крупных городов, во многих странах ведется работа по снижению токсичности автомобильных выхлопов. Рассматривается несколько направлений: создание новых модификаций бензина и искусственных моторных топлив, соответствующих более низкому уровню токсичности (ЕВРО-1, ЕВРО-2, Калифорнийский стандарт и т.д.). Объемы финансовых затрат на эти цели только в США исчисляются сотнями миллионов долларов. Для снижения токсичности выхлопных газов применяют каталитические дожигатели и фильтры, которые приводят к значительному удорожанию автомобиля, но мало эффективны в условиях эксплуатации российского автотранспорта. Правительством Москвы планируется перевод дизельных двигателей на диметилэфир, продукты сгорания которого менее токсичны по сравнению с дизельным топливом, в особенности по содержанию NОх .
Однако несмотря на дороговизну указанных проектов они не гарантируют полное исключение токсичности продуктов сгорания и являются источниками накопления в окружающей атмосфере диоксида углерода, относящегося к разряду парниковых газов. К коренному улучшению сложившейся в крупных городах экологической обстановки могло бы привести использование в автотранспортных системах водорода. Эффективность и особенность применения водорода в качестве моторного топлива подтверждена большим объемом экспериментальных исследований, в том числе непосредственно в условиях городской езды. Полученные результаты показывают возможность использования водорода в качестве моторного топлива не требуя создания нового двигателя. Особенности процесса горения водорода (например, высокие скорость и температура пламени) корректируются незначительной конструктивной доработкой и регулировкой двигателя.
Водород может применяться как в чистом виде, так и в смеси с углеводородным топливом. Благодаря его высокой физико-химической активности небольшая (5-10% масс.) добавка водорода к бензину позволяет снизить токсичность выхлопных газов на 65-75%.
Таблица
Выброс вредных веществ при сгорании различных топлив
|
Вид |
Выброс вредных веществ, г |
||
|
CO |
CH |
NOx |
|
|
Бензин |
42 |
8,5 |
9,1 |
|
Сжиженный нефтяной газ |
19 |
4,8 |
8,7 |
|
Сжатый природный газ |
8,5 |
4,5 |
8,5 |
|
Бензин в смеси с водородом |
3 |
2,8 |
4,55 |
|
Метанол |
28 |
4,6 |
4,4 |
|
Метанол в смеси с бензином |
32 |
5,4 |
7,6 |
|
Метанол в смеси с синтез-газом (H2+CO) |
5 |
2,5 |
3,5 |
|
Cинтез-газ (H2+CO) |
0 |
0,4 |
2,3 |
|
Водород |
0 |
0 |
2,5 |
|
ЕВРО-1 |
2,72 |
0,93 |
- |
Как следует из табл., из широкого перечня моторных топлив смесь бензина с водородом близко соответствует европейскому стандарту ЕВРО-1. При этом расход бензина снижается на 30-40%. Наиболее низкое содержание NОх в продуктах сгорания наблюдается при нагрузках менее 50% максимальной мощности, т.е. при рабочих параметрах двигателя, представляющих наибольший интерес для условий городской эксплуатации автомобилей.
В качестве сырья водород потребляется в больших объемах (порядка сотни миллионов тонн в год) в химической (для производства метанола, аммиака), нефтехимической (для гидроочистки, гидрокрекинга, каталитического риформинга, нефтехимического синтеза, получения синтетического топлива) и других производствах. Диаграмма распределения объемов использования водорода в различных отраслях промышленности представлена на рис. 1.
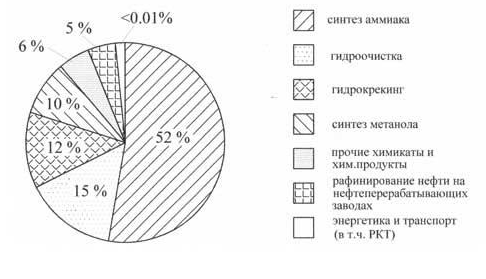
Рис.1. Диаграмма распределения использования водорода по отраслям промышленности.
В энергетике и на транспорте водород пока не нашел широкого применения, за исключением ракетно-космической техники, в качестве горючего, и для охлаждения мощных электрогенераторов (что составляет менее 0,01% от общего потребляемого объема). В качестве сырья используется в основном неочищенный (т.н. технический) водород, получаемый, в основном методом паровой конверсии природного газа непосредственно на месте его потребления, что не требует создания специальной инфраструктуры для его хранения, транспортировки, очистки, ожижения, заправки и т.д.
Поэтому стоимость такого водорода невелика, но при использовании его в качестве энергоносителя и последующего ожижения требуется дополнительная очистка (до 99,995% Н2), что приводит к удорожанию конверсионного водорода в 5-7 и более раз, приближая к стоимости более чистого электролитического водорода.
Использование водорода в автотранспорте потребует изыскания больших производственных и энергетических ресурсов. Масштабы их можно оценить взяв к примеру город с численностью населения 1 млн. чел. (чему соответствует примерно 250 тыс. единиц автотранспорта). С учетом более высокой энергоемкости и эффективности водорода по сравнению с бензином потребовалось бы производить примерно 500 т водорода в сутки. Энергетические затраты на производство электролитического водорода и его последующего ожижения составили бы порядка 15 млрд. кВтч в год. В мировом масштабе (примерно 500 млн. единиц автотранспорта) это соответствовало бы примерно 30000 млрд. кВтч в год. В то время, как мировая выработка электроэнергии составляет примерно 15000 млрд. кВт•ч. Из указанного примера следует, что широкомасштабное применение водородного топлива в автотранспорте (если не идти по пути использования для его получения углеводородного сырья), на сегодняшний день, пока не найдены неограниченные и дешевые источники энергии, лишено реальности.
Тем не менее, существует принципиальная возможность уже сегодня приступить, хотя и в ограниченных масштабах, к постепенному освоению водорода в автотранспортных системах. Заключается она в использовании для производства водорода избыточных мощностей крупных электростанций (АЭС, ТЭС, ГЭС), которые являются следствием двух основных причин: необходимостью снижения мощностей в ночные часы, выходные и праздничные дни (так называемых диспетчерских разгрузок), в связи с резким спадом в потреблении электроэнергии в указанные периоды, а также в уменьшении в последние годы энергетических потребностей некоторых промышленных предприятий.
Неиспользованные энергетические мощности могут быть направлены на производство электролитического водорода, что выгодно как с экономической точки зрения, так и с точки зрения повышения уровня безопасной работы агрегатов электростанций, и в первую очередь агрегатов АЭС. Например, энергетические потери за счет диспетчерского регулирования на Ленинградской атомной электростанции (ЛАЭС) составляют примерно 400 млн. кВтч в год, а по Северо-Западному региону в целом эта цифра возрастает до 20 млрд. кВт•ч.
Использование только избыточных мощностей ЛАЭС позволило бы вырабатывать примерно 7,2 тыс. т чистого водорода в год, достаточного для снабжения до 6 тыс. транспортных единиц (а при использовании водорода в качестве 5% добавки к основному топливу - до 50 тыс. единиц).
Стоимость электролитического водорода определяется не столько стоимостью электроэнергии, сколько капитальными затратами на создание специальной инфраструктуры (электролизеры, ожижители, средства транспортировки и т.д.). К примеру указанные затраты, рассчитанные на использование избыточных мощностей ЛАЭС (400 млн. кВт•ч), составят примерно 75-80 млн. долл. Отсюда реальная стоимость водорода составит примерно 93 руб./кг. При этом стоимость энергетической единицы, получаемой на водороде, составит 2,8 руб./кВт•ч. Для сравнения на бензине она равна 1,3 руб./кВтч и постоянно растет. При этом в расчете стоимости водорода не учитывается уменьшение экологического ущерба на окружающую среду, который по оценке составляет в масштабах города с численностью населения 1млн. чел. примерно 800-900 тыс. долл. в год (по данным – 13млн. долл.). Таким образом, при наличии соответствующих экономических механизмов, указанные капитальные затраты могли бы окупиться в течение нескольких лет за счет экономии бензина и снижения экологического ущерба.
Применение водорода на автотранспорте связано с решением такой важной проблемы как компактное и безопасное хранение водорода на борту транспортного средства. При больших количествах водорода (например, при использовании водорода в ракетно-космической или авиационной технике, где его запас на борту исчисляется тоннами), наиболее оптимальным является хранение его в криогенном виде. В автотранспортных системах, характеризующихся небольшими расходными характеристиками, более эффективными могут оказаться другие методы хранения: например, в сжатом или в связанном с интерметаллическими соединениями (ИМС) виде.
Из ИМС наиболее изучены соединения LaNi5 и ТiFе. Практическое использование их ограничено низкой массовой долей содержащегося водорода (1,4...1,7%) и высокой стоимостью (соответственно 50 и 25 долл./кг) .
Для хранения водорода под высоким давлением (до 20 МПа) может оказаться приемлемым использование металлопластиковых баллонов, предназначенных для природного газа (метана) с возможностью накопления водорода до 2,7% масс. В стадии разработки находятся металлопластиковые водородные баллоны, с рабочим давлением 39,2 МПа (накопление водорода до 7% масс.). Стоимость различных методов хранения водорода приведена на рис. 2.
Как отмечалось выше, отсутствие в обозримом будущем необходимых мощностей по производству водорода, рассматриваются методы непосредственного получения его на борту транспортного средства. Например, методом гидролиза алюминия, магния, гидрида лития. Однако указанные методы очень дороги (рис. 3) и могут рассматриваться лишь для уникальных энергоустановок. Например, для воздухонезависимых ЭУ подводных аппаратов, использующих электрохимические генераторы с топливными элементами (ТЭ). Для автотранспорта разрабатываются компактные бортовые установки риформинга углеводородного топлива.
В последние годы в США, Канаде, Германии, Китае, странах ЕЭС и многих других приняты программы создания экологически чистого автомобильного транспорта, использующего водородное топливо. Основное направлением работ - создание, помимо автомобилей с ДВС, автомобилей с твердополимерным ТЭ и электроприводом и автомобилей с гибридной двигательной установкой. Наиболее активно проводятся работы по созданию автомобилей с нулевым выбросом на базе твердополимерных ТЭ (с карбонизацией диоксида углерода в случае использования углеводородного топлива).
Водород в качестве нового источника возобновляемой энергии
Исследователи из Университета Айова, работающие на данный момент с коллегами из калифорнийской стартап-компании по производству чистой энергии, корпят над созданием новой технологии получения биологически чистой и безопасной энергии при помощи водорода. В рамках своего контрактного проекта с компанией HyperSolar, специалисты намереваются создать относительно дешевые системы получения безопасной энергии при помощи водорода. Так как водород является на данный момент наиболее безопасным источником получения энергии, он остается приоритетным в использовании в новейших системах возобновляемого типа – впрочем, традиционные способы получения водородной энергии остаются несколько “грязными”, так как выделяют углекислый газ.
Кроме того, водород для последующего использования в таких системах, может быть получен благодаря электролизу – процессу, при котором молекулы воды разделяются на молекулы водорода и кислорода, однако при этом требуется более чем качественно очищенная вода. Именно для того, чтобы сделать подобную технологию более доступной и дешевой, специалисты из Университета Айова под руководством профессора по химическому инжинирингу, Сиида Мубина, работают над проектом HyperSolar.
На данный момент ученые разработали специальное электрохимическое устройство, функционирующее благодаря проникающему солнечному свету, которое может располагаться в воде любой степень загрязненности. Когда солнечный свет попадает на воду и на это устройство в ней, энергия фотонов превращает воду в чистый водород, который может храниться в качестве своеобразных батарей в данном устройстве. А сама энергия вырабатывается ровно в тот момент, когда полученный водород вновь возвращается в свое прежнее состояние, то есть, когда становится водой.
Сейчас Мубин и его команда работает в основном над задачей постепенно понижения стоимости такой технологии, чтобы она стала более доступной и эффективной для любых целей. В конце концов, это может стать совершенно новым источником безопасной, а главное возобновляемой энергии, которая заменит невозобновляемые источники.
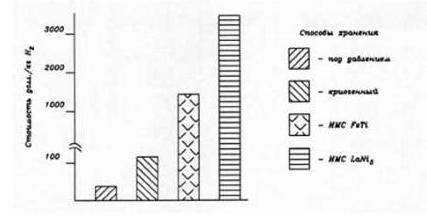
Рис.2. Стоимость различных методов хранения водорода.
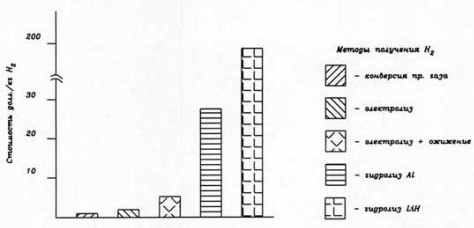
Рис.3. Стоимость водорода, получаемого различными методами.
Таблица
|
Параметры |
ДВС |
Аккумулятор свинцовый |
ТЭ |
|
КПД, % |
34-36 |
60-75 |
65-80 |
|
Nуд., Вт/кг |
150-170 |
30-40 |
60-200 |
|
Q, Втч/кг |
105 – 106 |
20-80 |
>105 |
Благодаря прямому преобразованию в ТЭ химической энергии топлива в электрическую, КПД установок с ТЭ может достигать 70-80%, а продолжительность работы определяется (в отличие от аккумуляторов) лишь запасом топлива. Практически все крупные автомобильные компании мира проводят работы в этом направлении. В нашей стране аналогичные работы в небольшом объеме проводятся в ОАО «АвтоВАЗ». Для массового применения ТЭ в автотранспорте их стоимость должна быть снижена до 50-100 долл./кВт (при современной стоимости примерно 1000 долл./кВт). Прогнозируется, что потенциальный рынок ТЭ на транспорте к 2020 году будет соответствовать мощности 57000 МВт. Наша страна, в связи с отсутствием требуемого финансирования, по данным разработкам отстает примерно на 10 лет.
Приведенные результаты подтверждают реальную техническую и экономическую возможность уже сегодня на базе избыточных электрических мощностей приступить к практическому использованию водорода в качестве моторного топлива и тем самым не только оздоровить экологическую обстановку в крупных городах, но и приблизить сроки более широкого освоения водородной энергетики.
Плюсы и минусы водородного топлива

Водородное топливо уже давно занимает ведущие позиции среди других источников энергии. Обладающий уникальными свойствами, водород по праву называют топливом ближайшего будущего. По сравнению с дизельным и бензиновым топливом, у него больший КПД, а также экологичность. Попытаемся разобраться, почему его до сих пор не используют?
Водородный коктейль
Хотя водород обладает чудесными характеристиками, его почти не применяют на автотранспорте потому, что люди привыкли использовать бензин, хотя он и дорожает с каждым днем. Также ведущие автокомпании постоянно откладывают сроки перехода на водородное топливо, мотивируя это тем, что установки для получения водорода появятся только к 2030 году. Европейские и американские аналитики могут быть правы в этих подсчетах, но есть множество доказательств экстренного перевода на водород целого автопарка, причем буквально за 10 -12 дней!
История двигателя внутреннего сгорания на водороде
Применение водорода в качестве топлива началось еще в XIX веке, когда французский изобретатель Франсуа Исаака де Риваз в 1806 году разработал самый первый в мире ДВС, потребляющий водородное топливо. Необходимую электрическую энергию он получал методом электролиза воды. Позже бельгийский изобретатель Жан Жозеф Этьен Ленуар заставил самоходный экипаж двигаться с помощью энергии водорода. Так бы водород и служил бы человечеству в качестве основного топлива, но в 1870 году в ДВС стали применять бензин, сведя на нет первые опыты с водородным топливом.
Водородное топливо в блокадном Ленинграде
О водороде вспомнили только в блокадном Ленинграде в конце 1941 года, благодаря военному технику Б. И. Шелищу, который предложил использовать отработанный водородный газ для заправки автотранспорта. От налетов вражеской авиации Ленинград защищался зенитными орудиями, а также заградительными аэростатами, наполненными водородом, чтобы помешать прицельной бомбардировке города.
Когда водородные аэростаты спускались на землю, их использовали в качестве альтернативного источника топлива. Всего лишь за неделю группа техников переоборудовала на водородное топливо 600 грузовиков ГАЗ. После войны об этом изобретении снова забыли, перейдя опять на бензин.
В 1970 годах, когда произошел энергетический кризис, люди опять оценили необходимость альтернативных источников энергии. Так, Украинским ИПМ был переоборудован весь свой автомобильный парк водородное топливо, отлично справившись с топливным кризисом. Об успешных экспериментах снова забыли после распада советского союза.
Современные автомобили на водороде находятся пока в стадии проектирования, а вернее выпускать серийно опытные модели пока не собираются из-за неразвитой инфраструктуры заправок автотранспорта водородным топливом. В промышленных масштабах получить водород электролизом воды недешево, поэтому автокомпании пока не спешат на него переходить, ожидая более дешевый и простой способ получения топлива.
Преимущества водородных ДВС
- Главное неоспоримое преимущество автомобилей на водороде – это высокая экологичность, так как продуктом горения водорода является водяной пар. Конечно, при этом сгорают еще различные масла, но токсичных выбросов гораздо меньше, чем у бензиновых выхлопов.
- Простая конструкция.
- Отсутствие дорогостоящих систем топливоподачи, которые к тому же опасны и ненадежны.
- Бесшумность.
- КПД электродвигателя на водородном топливе намного выше, чем у ДВС.
Недостатки
Имеются и недостатки у автомобилей на водородном топливе:
- Дорогой и сложный способ получений топлива в промышленных объемах.
- Отсутствие водородной инфраструктуры заправок автотранспорта.
- Не разработаны стандарты транспортировки, хранения и применения топлива на водороде.
- Несовершенство технологий хранения такого топлива.
- Дорогие водородные элементы.
- Большой вес транспорта. Работа электродвигателя на водородном топливе требуют водородные преобразователи тока и мощные аккумуляторные батареи, которые весят не мало, а также обладают внушительными габаритами.
- Существует опасность возгорания и взрыва при работе водорода с традиционным топливом.
Ознакомившись с достоинствами и недостатками водородного топлива можно понять, почему до сих пор откладывается серийный выпуск водородных автомобилей. Однако из-за ухудшающейся экологии этот альтернативный источник энергии может оказаться единственным решением проблемы.
Производители транспорта на водородном топливе
Мировые производители все же проводят испытание в этой сфере и даже выпускают автотранспорт на водородном топливе:
- Toyota — модель Toyota Highlander FCHV;
- Ford Motor Company проводит испытания с концептом Focus FCV;
- Honda со своей моделью Honda FCX;
- Hyundai выпускает Tucson FCEV;
- Daimler AG отвечает за модель Mercedes-Benz A-Class;
- General Motors.
Перспективы развития
Все же водород является единственной приемлемой экологической энергией с огромным будущим. От ученых зависит только разработать инфраструктуру, обнаружить способ добычи водорода, наладить порядок в инструкциях по эксплуатации топлива, и тогда навсегда уже забыть о выхлопных газах, нефтяных вышках и других проблемах бензиновой зависимости.
Тема «Основные классы неорганических соединений»
В результате изучения данной темы вы узнаете:
- Какими способами получают оксиды, основания, кислоты и соли.
- К каким классам неорганических веществ относятся такие соединения, как Fe3O4, Pb2O3.
- Чем отличаются друг от друга основные, кислые, двойные и смешанные соли.
В результате изучения данной темы вы научитесь:
- Составлять уравнения реакций получения различных классов неорганических соединений.
- Описывать свойства различных классов неорганических соединений.
- Составлять уравнения реакций с участием различных неорганических соединений.
Оксиды
Оксидами называют сложные вещества, состоящие из двух элементов, одним из которых является кислород, находящийся в степени окисления -2. Примерами оксидов являются Al2O3 - оксид алюминия, SiO2 - оксид кремния, NO - оксид азота(II).
Согласно международной номенклатуре рассматриваемые соединения называют оксидами с указанием степени окисления элемента, если этот элемент образует несколько оксидов. При написании названия степень окисления обозначается римскими цифрами в скобках, например, FeO – оксид железа (II), Fe2O3 – оксид железа (III), SO2 – оксид серы (IV), SO3 – оксид серы (VI). Очень часто в литературе встречаются и тривиальные названия оксидов – сурик (Pb3O4), веселящий газ (N2O), железная окалина (Fe3O4) и многие др.
Оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие оксиды принято делить на основные, амфотерные и кислотные.
От оксидов следует отличать пероксиды, например, H2O2, Na2O2 и надперокиды КО2, СsО2. В этих соединениях степень окисления кислорода по абсолютной величине меньше двух и может быть дробной.
Основные оксиды
Основные оксиды образуются только металлами, им в качестве гидратов соответствуют основания. Например, CaO, FeO, CuO являются основными оксидами, поскольку им соответствуют основания Ca(OH)2, Fe(OH)2, Cu(OH)2.
Получение основных оксидов
Основные оксиды получаются:
- окислением металлов кислородом:
4 Li + O2 ->2 Li2O,
2 Mg + O2->2 MgO;
при окислении щелочных металлов кислородом только литий образует Li2O. Натрий дает пероксид (Na2O2), остальные - надпероксиды (КО2 , RbO2 , CsO2).
- разложением при нагревании кислородных соединений: гидроксидов, нитратов, карбонатов:
2 Fe(OH)3-> Fe2O3 + 3 H2O,
2 Cu(NO3)2 ->2 CuO + 4 NO2 + O2,
CaCO3-> CaO + CO2 (кроме карбонатов щелочных металлов).
- обжигом сульфидов:
2 ZnS + 3 O2 ->2 ZnO + 2 SO2.
Химические свойства основных оксидов
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Na2 O + H2 O ->2 NaOH,
BaO + H2O ->Ba(OH)2.
Основные оксиды взаимодействуют с кислотами, образуя соль и воду, например:
FeO + 2 HCl ->FeCl2 + H2O;
Основные оксиды реагируют также с кислотными оксидами:
BaO + CO2-> BaCO3;
Основные оксиды могут также вступать в окислительно–восстановительные реакции:
Fe2O3 + 3 C ->2 Fe + 3 CO,
CuO + H2 ->Cu + H2O.
Кислотные оксиды
Кислотные оксиды образуются неметаллами (SO2, SO3, CO2, P4O10 и т.д.) или переходными металлами, находящимися в высоких степенях окисления (например, CrO3, Mn2O7).
Кислотные оксиды получают теми же способами, что и основные оксиды. Например:
C + O2-> CO2,
4 FeS2 + 11O2 ->2 Fe2O3 + 8 SO2,
Zn2(OH)2CO3 ->2 ZnO + CO2 + H2O,
а также разложением кислот:
H2SiO3-> SiO2 + H2O.;
Химические свойства кислотных оксидов
- Некоторые кислотные оксиды образуют кислоты при взаимодействии с водой:
SO3 + H2O ->H2SO4,
N2O5 + H2O ->2 HNO3.
Некоторые кислотные оксиды являются ангидридами кислот. Например, SO3 – ангидрид серной кислоты, SO2 – ангидрид сернистой кислоты, CO2 – ангидрид угольной кислоты, P4O10 является ангидридом трех кислот (метафосфорной НРО3, ортофосфорной Н3РО4, пирофосфорной Н4Р2О7).
- Кислотные оксиды взаимодействуют с основными, образуя соли:
SO3 + СаO-> CaSO4.
- Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + 2 NaOH-> Na2CO3 + H2O.
- Как и другие типы оксидов, кислотные оксиды могут вступать в окислительно–восстановительные реакции:
CO2 + 2 Mg-> C + 2 MgO.
SO2 + 2 H2S ->3 S + 2H2O.
Амфотерные оксиды
Амфотерные оксиды обладают двойственными свойствами, т.е. в зависимости от условий проявляют основные или кислотные свойства. К ним относятся: ZnO, Al2O3, BeO, Cr2O3 и т. д. Амфотерные оксиды с водой не взаимодействуют, но реагируют и с кислотами, и с основаниями. Например:
ZnO + H2SO4 ->ZnSO4 + H2,
ZnO+ 2 NaOH + H2O ->Na2[Zn(OH)4].;
Амфотерные оксиды могут взаимодействовать как с основными, так и с кислотными оксидами:
BeO + Na2O-> Na2BeO2
ZnO + SO3 ->ZnSO4
Амфотерные оксиды при сплавлении со щелочами или карбонатами щелочных металлов образуют соли:
ZnO + 2 NaOH ->Na2ZnO2 + H2O,
Al2O3 + 2 NaOH ->2 NaAlO2 + H2O.
Al2O3 + Na2CO3 ->2 NaAlO2 + CO2
Физические свойства оксидов очень разнообразны. Все основные и амфотерные оксиды, а также некоторые кислотные оксиды (SiO2, Р4О10 и др.) являются твердыми веществами. Многие кислотные оксиды при обычной температуре являются газами (SO2, CO2) или жидкостями (Cl2O7, Mn2O7).
Свойства несолеобразующих оксидов (СO, NO, N2O и др.) будут описаны в следующих разделах, которые посвящены химии соответствующих элементов.
Следует упомянуть о смешанных оксидах (Pb2O3, Pb3O4 и др.), в которых один и тот же элемент (Pb) находится в различных степенях окисления. Эти соединения можно также отнести к солям: Pb+2Pb+4O3, Pb2+2Pb+4O2.
Основания
Основаниями с точки зрения теории электролитической диссоциации являются соединения, при диссоциации которых в качестве анионов образуются гидроксо-группы ОН–. Свойствами оснований могут обладать не только гидроксиды металлов, но и некоторые другие вещества, например, NH3, молекула которого может присоединить протон:
NH3 + H-> NH4
Номенклатура оснований
По международной номенклатуре основания принято называть гидроксидами элементов: NaOH – гидроксид натрия, CsOH – гидроксид цезия.
Если элемент может образовывать несколько оснований, то в названиях в скобках римской цифрой указывается его степень окисления. Например, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III).
Большинство оснований мало растворимы в воде. Растворимые в воде основания называются щелочами . Щелочами являются, например, NaOH, KOH, Ba(OH)2.
Получение оснований
Общим способом получения оснований является реакция обмена между солью и щелочью:
Cu(NO3)2 + 2 KOH ->Cu(OH)2 + 2KNO3 ,
Na2CO3 + Ba(OH)2-> BaCO3 + 2 NaOH.
Щелочи образуются при взаимодействии щелочных и щелочноземельных металлов, а также их оксидов с водой:
2 Na + 2 H2O ->2 NaOH + H2 ,
BaO + H2O ->Ba(OH)2.
В промышленности щелочи обычно получают электролизом водных растворов хлоридов:
2 KCl + 2 H2O ->2 KOH + H2 + Cl2.
Свойства оснований
Растворы щелочей изменяют окраску индикаторов: бесцветный фенолфталеин переходит в малиновый цвет, метилоранж – в желтый, лакмус – в синий.
Большинство малорастворимых в воде оснований при нагревании легко разлагаются:
Cu(OH)2 ->CuO + H2O.
Щелочи термически устойчивы и плавятся без разложения. Исключение составляет гидроксид лития, который также разлагается при нагревании:
2 LiOH ->Li2O + H2O.
Как щелочи, так и нерастворимые основания могут реагировать с кислотами (реакция нейтрализации):
NaOH + 2 HCl-> NaCl + H2O,
2 Fe(OH)3 + 3H2SO4 ->Fe2(SO4)3 + 6H2O.
Взаимодействие оснований с кислотными и амфотерными оксидами рассмотрено в разделе
Амфотерные гидроксиды взаимодействуют как с кислотами, так и с основаниями. Например:
Al(OH)3 + 3 HCl-> AlCl3 + H2O
Al(OH)3 + 3 NaOH ->Na3[Al(OH)6]
В водных растворах, содержащих щелочь, наряду с [Al(OH)6]3–, существуют и другие ионы, в частности, [Al(OH)5]2–, [Al(OH)4]–, [Al О(OH)4]3– и др. В гидрооксокомплексах алюминия содержатся также молекулы Н2О, которые в формулах обычно не указывают.
К амфотерным гидроксидам относятся Zn(OH)2, Al(OH)3, Cr(OH)3, Be(OH)2, Pb(OH)2 и др.
В заключение следует отметить способность щелочей взаимодействовать с некоторыми неметаллами и оксидами:
6 KOH + 3 S ->K2SO3 + 2 K2S + 3 H2O,
6 NaOH + 3 Cl2 ->5 NaCl + NaClO3 + 3 H2O,
2 KOH + NO2 ->KNO2 + KNO3 + H2O.
Приведенные выше реакции относятся к окислительно-восстановительным реакциям и рассматриваются в разделе 7.
Кислоты
С точки зрения теории электролитической диссоциации кислота – химическое соединение при диссоциации в воде которого в качестве катионов образуются только ионы Н+. Представления о кислотах и основаниях, вытекающих из теории электролитической диссоциации Аррениуса, применимы только для водных растворов. Исследование процессов, протекающих в неводных средах, без участия растворителя, потребовало существенных дополнений и привело появлению различных теорий кислот и оснований.
Классификация и номенклатура кислот
Различают бескислородные (H2S, HBr, HCl) и кислородсодержащие (H3PO4, HNO3, HClO3) кислоты.
В свободном состоянии неустойчивы угольная (H2CO3) и сернистая (H2SO3) кислоты. Различают также сильные (H2SO4, HNO3, HCl, HBr, HI, HClO4 и др.) и слабые (H2S, H2CO3, HCN, H2SO3, HClO и др.) кислоты.
Число ионов водорода, образующихся при диссоциации формульной единицы кислоты, определяет ее основность.
Названия кислородсодержащих кислот производятся от названия неметалла с добавлением окончания -ная, -вая, если степень окисления неметалла является максимальной. По мере понижения степени окисления суффиксы меняются следующим образом: -оватая, -истая, -оватистая.
Примеры названий некоторых кислородсодержащих кислот приведены в табл.
Таблица
Названия некоторых кислородсодержащих кислот
|
Формула кислоты |
Название кислоты |
Формула кислоты |
Название кислоты |
|
HClO |
Хлорноватистая |
HNO2 |
Азотистая |
|
HClO2 |
Хлористая |
HNO3 |
Азотная |
|
HClO3 |
Хлорноватая |
H2SO3 |
Сернистая |
|
HСlO4 |
Хлорная |
H2SO4 |
Серная |
Названия бескислородных кислот состоят из названия неметалла с добавлением соединительной гласной о и слова –водородная. Например:
HF – фтороводородная кислота,
HCl – хлороводородная кислота,
H2S – сероводородная кислота.
Получение кислот
- Большинство кислородсодержащих кислот получают при взаимодействии кислотных оксидов с водой.
- Для получения нерастворимых в воде кислот используют косвенный метод (действием кислоты на соответствующую соль):
Na2SiO3 + H2SO4 ->H2SiO3 + Na2SO4.
- Некоторые бескислородные кислоты получают при непосредственном соединении неметаллов с водородом:
H2 + Cl2 ->2 HCl,
S + H2 ->H2S.
или по реакции обмена между солью и кислотой:
NaCl + H2SO4(конц)-> HCl + NaHSO4
Общие свойства кислот
Кислоты представляют собой жидкости (H2SO4, HNO3, HCl и т.д.) или твердые вещества (H3PO4, H3BO3 и др.).
Растворы сильных кислот могут разрушать ткани и кожу.
Растворы кислот изменяют цвет индикаторов, что используется для их качественного обнаружения. В качестве индикаторов используют лакмус (в нейтральной среде – фиолетовый, в кислой – красный, в щелочной – синий), метилоранж (в нейтральной среде – оранжевый, в кислой – красный, в щелочной – желтый) и другие.
Сила бескислородных кислот, например, в ряду HCl – HBr – HI, возрастает с увеличением радиуса аниона, поскольку анион большего радиуса слабее удерживает протон, облегчая тем самым диссоциацию кислоты. Таким образом, в главных подгруппах периодической системы сверху вниз сила бескислородных кислот возрастает с увеличением радиуса центрального атома.
Наоборот, в ряду HClO – HClO2 – HClO3 – HClO4 с уменьшением радиуса катиона С1z+ и увеличением его заряда сила кислородсодержащих возрастает.
Важнейшими химическими свойствами кислот являются:
взаимодействие с основными и амфотерными оксидами, основаниями и солями:
CaO + H2SO4 ->CaSO4 + H2O,
ZnO + H2SO4-> ZnSO4 + H2O,
2 Fe(OН)3 + 3 H2SO4 ->Fe2(SO4)3 + 6 H2O,
BaCl2 + H2SO4 ->BaSO4 + 2HCl;
взаимодействие кислоты с основанием – реакция нейтрализации;
взаимодействие с металлами с образованием соли и выделением водорода:
Mg + 2 HCl ->MgCl2 + H2,
Fe + H2SO4(разб) ->FeSO4 + H2.
Водород из кислот не вытесняют металлы, стоящие в ряду стандартных электродных потенциалов (в ряду напряжений) правее водорода. При взаимодействии металлов с концентрированной серной кислотой и азотной кислотой водород как правило не выделяется.
Свойства концентрированной серной кислоты
Концентрированная серная кислота в реакциях с металлами может восстанавливаться до SO2, S или H2S. Состав продуктов восстановления определяется активностью металла, концентрацией кислоты и температурой реагирующей системы. При обычной температуре концентрированная H2SO4 не реагирует с золотом и платиной, а некоторые металламы (Fe, Cr, Al) пассивируются в концентрированной серной кислоте.
Малоактивные металлы (стоящие в ряду стандартных электродных потенциалов правее водорода) восстанавливают концентрированную серную кислоту до SO2:
Cu + 2 H2SO4(конц)-> CuSO4 + SO2 + 2 H2O.
Активные металлы (Ca, Mg, Zn и др.) восстанавливают концентрированную H2SO4 до свободной серы или H2S:
3 Zn + 4 H2SO4(конц) ->3 ZnSO4 + S + 4H2O,
4 Ca + 5 H2SO4(конц) ->4 CaSO4 + H2S + 4H2O.
При взаимодействии серной кислоты с неметаллами образуется SO2:
C + H2SO4(конц) ->2 SO2 + CO2 + 2H2O,
S + 2 H2SO4(конц)-> 3 SO2 + 2H2O,
2 P + 5 H2SO4(конц) ->5 SO2 + 2 H3PO4 + 2H2O.
При взаимодействии концентрированной H2SO4 с соединениями, содержащими катионы металлов, находящимися в низшей степени окисления, происходит дальнейшее окисление этих металлов:
2 FeO + 4 H2SO4(конц) ->Fe2(SO4)3 + SO2 + 4 H2O.
Свойства азотной кислоты
Азотная кислота окисляет большинство элементов до их высшей степени окисления. Взаимодействие HNO3 различной концентрации с металлами различной активности представлено в виде следующей схемы:
|
Разбавленная |
HNO3 |
Концентрированная |
||
|
С тяжелыми металлами |
С щелочноземельными металлами, а также с Zn, Fe, Sn |
Не действует на Fe, Cr, Al, Au, Pt |
С щелочными и щелочноземельными металлами |
С другими тяжелыми металлами |
|
NO |
NH4NO3 |
|
N2O |
NO2 |
Таким образом, при взаимодействии концентрированной HNO3 с малоактивными металлами образуется NO2:
Ag + 2 HNO3(конц)-> AgNO3 + NO2 + H2O.
При действии разбавленной HNO3 на малоактивные металлы выделяется NO:
3 Cu + 8 HNO3(разб) ->3 Cu(NO3)2 + 2 NO + 4 H2O,
а в случае активных металлов образуется NH4NO3:
4 Ca + 10 HNO3(разб)-> 4 Ca(NO3)2 + NH4NO3 + 3 H2O.
При взаимодействии концентрированной азотной кислоты с неметаллами образуется, как правило, NO:
3 C + 4 HNO3(разб) ->3 CO2 + 4 NO + 2H2O,
P + 5 HNO3(разб) + 2 H2O ->3H3PO4 + 5NO.
При взаимодействии концентрированной HNO3 с соединениями, содержащими катионы металлов, находящимися в низшей степени окисления, происходит дальнейшее окисление этих металлов:
FeO + 4 HNO3(разб) ->Fe(NO3)3 + NO2 + 2 H2O.
Следует отметить, что продуктами восстановления азотной кислоты с металлами являются и азот, и даже водород, причем, как правило, образуется смесь веществ. Чем активнее металл и чем меньше концентрация , тем глубже она восстанавливается.
Соли
Классификация и номенклатура солей
С точки зрения теории электролитической диссоциации соли это соединения, при диссоциации которых образуются катионы металлов и анионы ОН– (см. раздел 9).
Различают следующие типы солей: средние, кислые, основные, двойные, смешанные и комплексные .
Средние соли
В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла. Уравнение диссоциации средней соли Na2SO4 в разбавленном растворе записывается следующим образом:
Na2SO4 ->2 Na+SO42
(NH4)2Cr2O7 ->2 NH4+ Cr2O72
при этом указывается, что степень диссоциации стремится к единице (α 1)&
Кислые соли
В кислых солях атомы водорода соответствующей кислоты не полностью замещены на металл. Кислая соль получается по реакции неполной нейтрализации кислоты:
H2SO3 + NaOH(недостаток)-> NaHSO3 + H2O,
или при взаимодействии средней соли с избытком кислоты:
Ca3(PO4)2 + 4 H3PO4(избыток) ->3 Ca(H2PO4)2.
Для перевода кислой соли в среднюю следует добавить основание:
NaHSO4 + NaOH ->Na2SO4 + H2O,
Са(НСО3)2 + Са(OH)2-> СаСО3 + 2H2O.
Диссоциацию кислой соли можно выразить уравнением:
NaHCO3 ->Na+HCO3; α 1
Анион HCO3 - будет диссоциировать в незначительной степени:
HCO3->H + CO32.
Кислые соли образуются многоосновными кислотами.
Основные соли
Основные соли – это продукт неполного замещения групп ОН– основания на кислотные остатки:
Mg(OH)2 + НС1(недост) ->MgOHС1 + H2O.
Основные соли образуют основания, содержащие две и более гидроксо-групп.
Для перевода основной соли в среднюю необходимо добавить кислоту:
Mg(OH)Cl + HCl ->MgCl2 + H2O.
Диссоциация основной соли выражается уравнением:
Mg(OH)Cl ->MgOH + Cl; α 1.
Катион MgOH+ подвергается дальнейшей диссоциации как слабый электролит:
MgOH->Mg2+ OH.
Двойные и смешанные соли
Двойные соли – это соли, состоящие из двух различных катионов и одного аниона. Примерами двойных солей являются: алюмокалиевые квасцы KAl(SO4)2 и сильвинит KCl·NaCl.
Диссоциацию двойной соли в разбавленном растворе можно выразить уравнением:
KAl(SO4)2 ->K + Al3+ 2SO42; α 1.
Смешанные соли – это соли, состоящие из одного катиона и двух различных анионов. Хлорная известь CaOCl2, например, является солью хлорноватистой (НС1О) и хлороводородной (НС1) кислот.
Комплексные соли
В состав комплексных солей входит комплексный ион (в формулах он заключается в квадратные скобки), состоящий из центрального атома - комплексообразователя, окруженного несколькими частицами – молекулами или ионами (лигандами). В разбавленных растворах комплексная соль диссоциирует следующим образом:
K3[Fe(CN)6] ->3 K + [Fe(CN)6]3– ; α 1.
В свою очередь, комплексный ион является слабым электролитом и в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3->Fe3+ 6 CN.
Номенклатура солей
Название солей состоит из названия аниона в именительном падеже, за которым следует название катиона в родительном. Если один и тот же металл может проявлять в соединении различную степень окисления, то ее указывают в скобках римской цифрой.
В названии солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание –ат (для высших степеней окисления), -ит для более низких. Например, KNO3 – нитрат калия, KNO2 – нитрит калия, FeSO4 – сульфат железа (II), Fe2(SO4)3 – сульфат железа (III).
Суффикс –ид добавляется к названию неметалла при наименовании солей бескислородных кислот, например, NaCl – хлорид натрия.
Названия кислых солей образуют, добавляя к наименованию аниона приставку гидро-. Например, NaHS – гидросульфид натрия, KH2PO4 – дигидрофосфат калия.
Названия основных солей образуют прибавлением к названию аниона приставки гидроксо–: Mg(OH)SO4 – гидроксосульфат магния, Al(OH)2Cl – дигидроксохлорид алюминия.
Получение солей
Большинство способов получения солей обсуждено выше, при рассмотрении свойств оксидов, оснований и кислот. Ниже приводятся важнейшие реакции получения солей:
Реакция нейтрализации:
КОН + НС1 = КС1 + H2O,
Al(OH)3 + 3 HNO3->Al(NO3)3 + 3H2O,
Cu(OH)2 + 2 HCl ->CuCl2 + 2H2O.;
Взаимодействие металлов с кислотами:
Zn + 2 HCl ->ZnCl2 + H2,
Ca + H2SO4(разб) ->CaSO4 + H2 .
Взаимодействие кислот с основными оксидами:
2 HNO3 + CaO ->Ca(NO3)2 + H2O,
3 H2SO4 + Fe2O3 ->Fe2(SO4)3 + 3H2O.
Взаимодействие кислот с солями:
H2SO4 + Na2CO3 ->Na2SO4 + CO2 + H2O,
HCl + AgNO3 ->AgCl + HNO3.;
Взаимодействие растворимых оснований с солями:
Fe2(SO4)3 + 6 KOH ->2 Fe(OH)3 + 3 K2SO4,
NiCl2 + 2 KOH ->Ni(OH)2 + 2KCl.
Взаимодействие основных оксидов с кислотными:
CaO + CO2 ->CaCO3,
BaO + SiO2-> BaSiO3 .
Взаимодействие оснований с кислотными оксидами:
Ba(OH)2 + N2O5 ->Ba(NO3)2 + H2O,
2 KOH + SO2 ->K2SO3 + H2O.
Взаимодействие двух растворимых солей:
CaCl2 + K2CO3 ->CaCO3 + 2 KCl.
3 Ba(NO3)2 + 2 K3PO4-> Ba3(PO4)2 + 6 KNO3.
При непосредственном взаимодействии металлов и неметаллов могут быть получены соли бескислородных кислот.
Zn + S ->ZnS,
2 Fe + 3 Cl2 ->2 FeCl3.
Помимо приведенных выше, существуют и другие способы получения солей.
Свойства солей
Соли, как правило, являются твердыми кристаллическими веществами, с различной растворимостью в воде. По растворимости в воде соли можно разделить на хорошо растворимые и малорастворимые. Хорошо растворяются в воде все нитраты, соли аммония и большинство солей щелочных металлов. К числу малорастворимых солей относятся большинство карбонатов, фосфатов и силикатов (кроме солей щелочных металлов и аммония).
Многие растворимые соли взаимодействуют между собой в растворах при условии образования осадков малорастворимых солей или выделения газов:
BaCl2 + Na2SO4-> BaSO4 + 2NaCl,
Na2CO3 + Ca(NO3)2 ->CaCO3 + 2NaNO3,
2 NH4HSO4 + Ba(HCO3)2-> BaSO4 + (NH4)2SO4 + 2 H2O + CO2 .
Растворы некоторых солей реагируют с металлами. При составлении уравнений реакций необходимо пользоваться рядом электродных потенциалов (рядом напряжений) металлов, поскольку более активные металлы, например цинк и железо, вытесняют менее активные (Сu, Ag) из растворов их солей:
Fe + CuSO4 ->Cu + FeSO4,
Zn + Pb(NO3)2->Pb + Zn(NO3)2.
Растворы солей реагируют со щелочами при условии образования осадков малорастворимых оснований:
FeCl3 + 3 KOH ->Fe(OH)3 + 3 KCl,
Pb(NO3)2 + 2NaOH ->Pb(OH)2 + 2 NaNO3.
Cоли слабых кислот реагируют с сильными кислотами:
Na2SiO3 + 2 HCl ->H2SiO3 + 2 NaCl,
NiCl2 + H2S ->NiS + 2 HCl,
CaCO3 + 2 HCl ->CaCl2 + CO2 + H2O.
Термически неустойчивы и разлагаются при нагревании все нитраты, соли аммония и кислые соли (при разложении последних всегда выделяется вода):
2 KNO3->2 KNO2 + O2,
4 Fe(NO3)3 ->2 Fe2O3 + 12 NO2 + 3 O2,
2 AgNO3 ->2 Ag + 2 NO2 + O2,
NH4NO3 ->N2O + 2H2O ,
NH4Cl ->NH3 + HCl ,
2 NaHCO3 ->Na2CO3 + CO2 + H2O.
Кислотные дожди
Термин «кислотные дожди» был введен английским химиком Р.Э.Смитом более 100 лет назад.
В 1911 г. в Норвегии зафиксировали случаи гибели рыб в результате подкисления природной воды. Однако только в конце 60-х гг., когда аналогичные случаи в Швеции, Канаде, США привлекли внимание общественности, возникло подозрение, что причина — дождь с высоким содержанием серной кислоты.
Кислотные дожди — это атмосферные осадки (дождь, снег) с рН менее 5,6 (повышенной кислотностью).
Образуются кислотные дожди при промышленных выбросах в атмосферу диоксида серы и оксидов азота, которые, соединяясь с атмосферной влагой, образуют серную и азотную кислоты. В результате дождь и снег оказываются подкисленными (число рН ниже 5,6). В Баварии (ФРГ) в августе 1981 г. выпадали дожди с кислотностью рН = 3,5. Максимальная зарегистрированная кислотность осадков в Западной Европе — рН =2,3.
Суммарные мировые антропогенные выбросы оксидов серы и азота составляют ежегодно более 255 млн т (1994). Кислотообразующие газы надолго остаются в атмосфере и могут передвигаться на расстояния в сотни и даже тысячи километров. Так, значительная часть выбросов Великобритании попадает в северные страны (Швецию, Норвегию и др.), т.е. с трансграничным переносом, и наносит ущерб их экономике.
На огромной территории природная среда закисляется, что весьма негативно отражается на состоянии всех экосистем. Выяснилось, что природные экосистемы подвергаются разрушению даже при меньшем уровне загрязнения воздуха, чем тот, который опасен для человека.
Опасность представляют, как правило, не сами кислотные осадки, а протекающие под их влиянием процессы.
Кислотные дожди вымывают биогены из почвы. Частицы гумуса и глины обычно заряжены отрицательно и удерживают такие положительные ионы, как Са2+, К+, NH+. Просачивающаяся кислота уносит биогенные ионы, т. к. их вытесняет ионы водорода.
Под действием кислотных осадков из почвы выщелачиваются не только жизненно необходимые растениям питательные вещества, но и токсичные тяжелые и легкие металлы — свинец, кадмий, алюминий и др. Впоследствии они сами или образующиеся токсичные соединения усваиваются растениями и другими почвенными организмами, что ведет к весьма негативным последствиям. Например, возрастание в подкисленной воде содержания алюминия всего лишь до 0,2 мг на один литр летально для рыб, а токсичность тяжелых металлов (кадмия, свинца и др.) проявляется в еще большей степени.
Пятьдесят миллионов гектаров леса в 25 европейских странах страдает от действия кислотных дождей. Так, например, гибнут хвойные горные леса в Баварии. Отмечены случаи поражения хвойных и лиственных лесов в Карелии, Сибири и в других районах нашей страны.
Воздействие кислотных дождей и других загрязнителей снижает устойчивость лесов к засухам, болезням, природным загрязнениям, что приводит к еще более выраженной их деградации как природных экосистем.
Ярким примером негативного воздействия кислотных осадков на природные экосистемы является закисление озер. Особенно интенсивно оно происходит в Канаде, Швеции, Норвегии и на юге Финляндии. Объясняется это тем, что:
- значительная часть выбросов серы в таких промышленно развитых странах, как США, ФРГ и Великобритания, выпадает именно на их территории;
- коренные породы, слагающие ложе озер, обычно представлены гранитогнейсами и гранитами, не способными нейтрализовать кислотные осадки, в отличие, например, от известняков, которые создают щелочную среду и препятствуют закислению.
Закисление озер опасно не только для популяций различных видов рыб (в т. ч. лососевых, сиговых и др.), но часто влечет за собой постепенную гибель планктона, многочисленных видов водорослей и других обитателей водоемов. Озера становятся практически безжизненными. Так, в Канаде более 4 тыс. озер объявлены мертвыми, а еще 12 тыс. - на грани гибели. В южной части Норвегии в половине озер исчезла рыба. Кстати, если рН водной среды равно или меньше 4, то все живое в ней погибает.
В нашей стране площадь значительного закисления от выпадения кислотных осадков достигает нескольких десятков миллионов гектаров. Отмечены и частные случаи закисления озер (Карелия и др.). Повышенная кислотность осадков наблюдается вдоль западной границы (трансграничный перенос серы и других загрязняющих веществ) и на территории ряда крупных промышленных районов, а также фрагментарно на побережье Таймыра и Якутии.
Экологические проблемы, связанные с производством серной
кислоты, и способы их решения
В начале рассказа важно подчеркнуть, что в сернокислотном производстве перерабатывают и получают такие вещества, как сероводород H2S, оксид серы (IV) SO2, оксид серы (VI) SO3, серную кислоту H2SO4. Эти вещества, присутствуя в воздухе, вредно отражаются на здоровье людей, губительно действуют на растения, разрушают постройки и т. п. Именно поэтому уделяется серьезное внимание проблеме охраны окружающей среды от загрязнения.
Далее в ответе можно выделить целый ряд экологических проблем, связанных с производством серной кислоты. Первая связана с обжигом серного колчедана FeS2 и других сульфидных руд. При обжиге, протекающем в «кипящем слое», получающийся оксид металла, например, Fe2O3, выделяется в атмосферу:
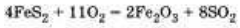
Это можно объяснить тем, что для аппаратов обжига в «кипящем слое» требуется порошок руды, подвергшийся сильному измельчению. В результате обжига образуется оксид железа или другого металла с очень маленькими частицами. С улавливанием этих частиц фильтры могут не справиться. Частицы оксида могут попасть в атмосферу при выгрузке из печи. Попадание в атмосферу измельченных оксидов железа или других металлов называют металлизацией атмосферы.
При производстве серной кислоты в атмосферу попадает много оксида серы (IV):
Это связано с тем, что производственные установки не всегда герметичны, а также с тем, что иногда автоматические системы управления не справляются с работой, что приводит к аварийным выбросам.
Для производства серной кислоты нередко используется сера, получаемая из сероводорода (это вещество является отходом ряда производств). Производится сера с помощью неполного окисления сероводорода Эта технологическая схема настолько несовершенна, что около 20% серы идет на образование оксида серы (IV), который выделяется в атмосферу.
В ходе производства возможны выбросы в атмосферу оксида серы (VI) и серной кислоты:
SO3 + Н2О = H2SO4
Эти выбросы считаются аварийными, но они возможны и, к сожалению, случаются нередко.
Один из способов разрешения экологических проблем — использование технологических схем, сводящих к минимуму загрязнение атмосферы:
1) непрерывность процесса;
2) циркуляционные процессы (непрореагировавшие вещества возвращаются в сферу реакции);
3) принцип противотока (увеличивается площадь поверхности реагирующих веществ и скорость реакции);
4) комплексное использование сырья, безотходная технология;
5) выбор оптимального сырья и режима его переработки.
Так, например, в мире около 80% серной кислоты производится из серы, а не из пирита FeS2. Это позволяет избежать металлизации атмосферы.
Еще один важный путь — это совершенствование технологического оборудования, в частности различных фильтров и поглотителей. Большое значение имеет профилактический ремонт оборудования, а также установка современных автоматических систем управления производством.
Соляная кислота: влияние на экологию и здоровье человека
Соляная кислота (хлористоводородная кислота) – водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты около 36% HCl; такой раствор имеет плотность 1,18 г/см3. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты.
Соляная кислота (хлористоводородная кислота) – водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты около 36% HCl; такой раствор имеет плотность 1,18 г/см3. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты.
Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот, растворяет (с выделением водорода и образованием солей – хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель.
Соли соляной кислоты – хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт.
Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной.
Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением. Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды.
Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод. Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту.
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Изучение теории химического строения органических веществ по данной методике принципиально отличается от общепринятого в наших школах. Прежде всего потому, что основные положения и следствия теории изучаются в начале курса, а не в связи с изучением конкретных веществ. Весь материал можно разбить на две подтемы: «Основные положения теории А. М. Бутлерова» и «Современные представления о химическом строении органических веществ». На изучение первой подтемы отводятся три урока: урок разбора нового материала и два комбинированных семинарских занятия. Вторую подтему изучают на четырех уроках: два урока – разбор нового материала и два – комбинированные семинарские занятия. Восьмой урок по теме отводится на урок обобщения и систематизации знаний. Главное и единственное внимание в процессе изучения темы должно быть уделено рассмотрению положений о том, каким образом атомы-органогены могут соединяться в молекулы и как от этого изменяется структура и наиболее общие свойства данной молекулярной структуры. За основу прогнозирования наиболее общих свойств молекул берем свойства химических связей между атомами, данной молекулы и взаимное влияние атомов друг на друга. Вначале нужно изучить способы образования и свойства углерод-углеродных связей, а затем приступить к изучению углерод-водородной, углерод-кислородной, углерод-азотной и некоторых других, характерных для органических соединений. Весь материал отрабатывается на шаростержневых моделях, схемах, рисунках и других наглядных средствах. В сфере воспитания главное внимание надо уделить формированию диалектико-материалистических взглядов на развитие природы, а также на расширение политехнического кругозора. Поскольку изучение теории химического строения органических веществ принципиально отличается от общепринятого, можно привести основные знания и умения, которыми должны овладеть учащиеся при ее изучении. Основные знания, которыми должны овладеть учащиеся:
- Основные положения теории химического строения органических веществ А. М. Бутлерова: соединение атомов в молекуле согласно их валентности; взаимное влияние атомов друг на друга и на свойства молекул в целом.
- Образование связей между атомами углерода в углеродных цепях: одинарные, двойные, тройные связи.
- Типы углеродных цепей: прямые, разветвленные, циклические.
- Понятие об изомерии. Виды изомерии. Изомеры.
- Структурные и полуструктурные формулы. Изображение строения молекул с помощью шаростержневых моделей.
- Понятие об sp3-, sp2- и sp-гибридизации электронных облаков, σ- и π-связи.
- Понятие о валентных углах и длине связи.
- Факторы, определяющие реакционную способность молекулы.
- Нахождение общих признаков сходства и различия в изучаемом предмете или явлении. Составление перечня признаков сравнения.
- Обобщение результатов сравнения в виде вывода.
Основные умения, которыми должны овладеть учащиеся:
- Уметь применять основные положения теории строения дляобъяснения структуры и общих свойств молекул.
- Изображать структурные, полуструктурные и электронные формулы органических веществ; изготавливать шаростержневые модели молекул.
- Применять модели для объяснения установленной закономерности. Уметь абстрагировать.
- Выбирать подходящие признаки в изучаемых объектах для сравнения и нахождения существующей закономерности.
- Решать расчетные задачи на нахождение простейшей молекулярной и структурной формул веществ по данным анализа.
Для примера рассмотрим только первую часть данного материала.
Урок 1. (Разбор нового материала). Тема: Основные положения теории А. М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Образование связей в соединениях углерода. Углеродные цепи, кольца. Изомерия.
Урок 2. (Практическое комбинированное семинарское занятие). Тема: Порядок соединения атомов в молекулы согласно валентности атомов. Виды углеродных цепей (прямые, разветвленные, циклические). Структурные формулы. Девиз: «Непрекращающийся процесс, изменения и перестройки характеризует естественное состояние материи».
Программа «А».
- Изготовьте шаростержневые модели возможных молекулярных структур, которые имеют состав: а) С4Н8; б) С4Н10; в) С4Н10О. Напишите структурные формулы этих веществ и отметьте виды углеродных цепей, присущие молекулам данного состава.
- Наблюдайте, какне изменения происходят в молекулах состава С4Н8 при перестройке углеродной цепи из прямой в циклическую. Выделите наиболее существенные. Продемонстрируйте на данном материале изменения веществ, связанные: а) с составом и химическим строением; б) только с химическим строением.
- Решите задачу. Сожгли органическое вещество массой 0,680 г, молекулы которого состоят из атомов углерода и водорода, и получили углекислый газ массой 2,2 г и воду массой 0,72 г. Относительная плотность паров вещества по aзоту равна 2,43. Установите молекулярную и структурную формулы этого вещества и изготовьте шаростержневую модель его молекулы.
Программа «В».
- Решите задачу. Массовые доли углерода и водорода в органическом веществе соответственно равны 84,51 и 15,49%. Относительная плотность вещества по кислороду равна 4,44. Установите молекулярную и структурную формулу этого вещества.
Программа «С».
- Изготовьте шаростержневые модели трех видов углеродных цепей молекул органических веществ: а) прямой; б) разветвленной; в) циклической. Зная, что углерод в органических соединениях всегда четырехвалентен, присоедините к свободным валентностям атомов углерода моделей необходимое количество шариков, символизирующих атомы водорода. Hапишите молекулярную и структурную формулы веществ, модели которых вы изготовили. При необходимости используйте шаростержневую модель, структурную и молекулярную формулы.
- Решите задачу. Анализ некоторого газообразного органического вещества показал, что массовая доля углерода в нем равна 81,81, а водорода 18,19 %. Относительная плотность этого вещества по водороду равна 22. Установите молекулярную и структурную формулы этого вещества.
Урок 3. (Практическое комбинированное семинарское занятие). Тема: Влияние на свойства веществ порядка соединения атомов в молекуле. Изомерия (углеродного скелета). Изомеры. Девиз: «Любое явление имеет свою причину».
Программа «А». 1. Вам выданы два вещества, которые имеют один и тот же состав: С2Н6О. Исследуйте: а) растворимость этих веществ в воде; б) отношение к кальцию. Свои наблюдения запишите в таблицу.
- Напишите формулы возможных изомеров веществ состава: а) С5Н12; б) С5Н12О. Составьте перечень признаков, по которым отличаются изомеры приведенных выше веществ. Сформулируйте в виде правила главную причину: а) явление изомерии; б) почему изомеры отличаются по свойствам друг от друга.
- Решите задачу. Сожгли смесь изомеров одного органического вещества массой 2,917 г. при этом углекислый газ массой 9,167 г и воду массой 3,750 г. Относительная плотность паров этой смеси по водороду равна 35. Определите молекулярную и структурную формулы изомеров, которые могли содержаться в смеси.
Программа «В». 1. Изготовьте шаростержневые модели изомеров пентана (С5Н12) и объясните причины, обуславливающие различия в температурах кипения данных изомеров. Что такое изомерия; изомеры?
- Напишите структурные и полуструктурные формулы изомеров гексана (С6Н14). На основании наблюдений за структурой молекул этих изомеров сформулируйте основные положения теории строения А. М. Бутлерова. Чем можно объяснить, что атом углерода соединяется в цепи трех видов?
- Покажите три возможные порядка соединения атомов в молекуле состава С4Н10О. Выявите причину существования явления изомерии органических веществ.
- Решите задачу. Сожгли газообразное органическое вещество объемом 5 л, в результате чего получили углекислый газ объемом 20 л и воду массой 12,1 г (у.н.). Относительная плотность этого газа по водороду 27. Установите молекулярную и структурную формулы вещества и изготовьте шаростержневую модель его молекулы.
Программа «С»
- Изготовьте шаростержневые модели бутанов (С4Н10). Ознакомьтесь с температурой кипения этих веществ по книге. Отметьте разницу в их температурах кипения. На основании теории строения органических веществ объясните причины существования двух изомеров бутана. Изложите главные положения теории строения органических веществ.
- Напишите структурные формулы трех пентанов (C5H12) и, используя их, ответьте на вопросы: а) чем отличаются друг от друга изомеры; б) какие виды углеродных цепей характерны для молекул органических соединений; в) что называется изомерией?
- Какое вещество изображено: а) СН3—СН2—СН2—СН2—ОН;
- Решите задачу. В результате анализа некоторого газообразного органического вещества объемом 10 л было обнаружено, что в нем содержится углерод массой 21,42 г и водород массой 2,68 г. Относительная плотность этого вещества по гелию равна 13,5. Определите массовую долю углерода и водорода в данном органическом веществе. Установите его молекулярную и структурную формулы.
Изучение темы Галогены можно провести, используя презентацию (приложение). Кроме того, можно добавить некоторый материал связанный с биологией галогенов.




© ООО «Знанио»
С вами с 2009 года.
![]()
