
Вариант №1
1. В процессе эксперимента внутренняя энергия газа уменьшилась на 40 кДж, и он совершил работу 35 кДж. Какое количество теплоты (в кДж) газ отдал окружающей среде?
2.
Идеальный
газ в количестве ν = 2 моля, получив некоторое количество
теплоты от нагревателя, изменил своё состояние, перейдя из состояния 1 в
состояние 2 так, как показано на pT-диаграмме. Какую работу
совершил газ в процессе 1–2? Ответ выразите в Дж. 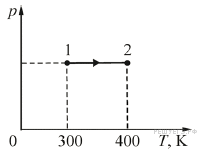
3. Идеальная тепловая машина за цикл работы получает от нагревателя 100 Дж и отдает холодильнику 40 Дж. Каков КПД тепловой машины? (Ответ дайте в процентах.)
4. В результате эксперимента по изучению циклического процесса, проводившегося с некоторым постоянным количеством одноатомного газа, который в условиях опыта можно было считать идеальным, получилась зависимость давления p от температуры T, показанная на графике. Выберите два утверждения, соответствующие результатам этого эксперимента, и запишите в таблицу цифры, под которыми указаны эти утверждения. 1) В процессе 2–3 газ не совершал работу.
2) В процессе 1–2 газ совершал положительную работу.
3) В процессе 2–3 газ совершал положительную работу.
4) В процессе 3–1 газ совершал положительную работу.
5) Изменение
внутренней энергии газа на участке 1–2 было равно модулю изменения внутренней энергии
газа на участке 3–1. 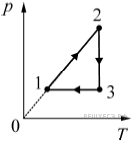
5.
В калориметре находится вода, масса которой 100 г и температура 0 °С. В него добавляют кусок льда, масса которого 20 г и температура –5 °С. Какой будет температура содержимого калориметра после установления в нём теплового равновесия? Ответ приведите в градусах Цельсия.
6. В закрытом сосуде находится идеальный газ. Как при охлаждении сосуда с газом изменятся величины: давление газа, его плотность и внутренняя энергия?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
|
Давление газа |
Плотность газа |
Внутренняя энергия газа |
Вариант №2
1. В процессе эксперимента газ отдал окружающей среде количество теплоты, равное 3 кДж. При этом внутренняя энергия газа уменьшилась на 13 кДж. Следовательно, газ расширился. Какую работу он при этом совершил? (Ответ дайте в кДж.)
2.
Какую
работу совершает идеальный газ при переходе из состояния 1 в состояние 2 (см.
рисунок)? Ответ выразите в кДж.
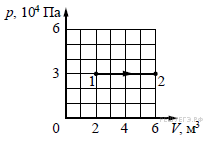
3.
Идеальная
тепловая машина с КПД ![]() за цикл работы
отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина
получает от нагревателя? (Ответ дайте в джоулях.)
за цикл работы
отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина
получает от нагревателя? (Ответ дайте в джоулях.)
4. В результате эксперимента по изучению циклического процесса, проводившегося с некоторым постоянным количеством одноатомного газа, который в условиях опыта можно было считать идеальным, получилась зависимость давления p от температуры T, показанная на графике. Выберите два утверждения, соответствующие результатам этого эксперимента, и запишите в таблицу цифры, под которыми указаны эти утверждения. 1) В процессе 1–2 газ совершал положительную работу.
2) В процессе 2–3 газ совершал положительную работу.
3) В процессе 3–1 газ совершал отрицательную работу.
4) Изменение внутренней энергии газа на участке 1–2 было больше изменения внутренней энергии газа на участке 2–3.
5) В процессе 3–1 работа не совершалась.
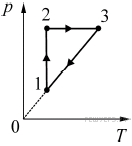
5.Кусок льда, имеющий температуру 0 °С, помещён в калориметр с электронагревателем. Чтобы превратить этот лёд в воду температурой 20 °С, требуется количество теплоты 100 кДж. Какая температура установится внутри калориметра, если лёд получит от нагревателя количество теплоты 75 кДж? Теплоёмкостью калориметра и теплообменом с внешней средой пренебречь.
6. В сосуде под поршнем находится идеальный газ. Если при нагревании газа его давление остается постоянным, то как изменятся величины: объем газа, его плотность и внутренняя энергия?
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
|
Объем газа |
Плотность газа |
Внутренняя энергия газа |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.