
Лабораторная работа № 9
Тема: «Измерение электрического заряда одновалентного иона»
Цель работы: экспериментально определять заряд электрона в процессе электролиза.
Оборудование: персональный компьютер, методические указания, рабочая тетрадь, электронный ресурс виртуальной лабораторной работы - https://multiring.ru/eor/html/651/content/47871/47871.htm
Ход работы:
Методические указания:
1. Краткое теоретическое описание
Пропуская электрический ток через раствор электролита, например CuSO4, происходит выделение вещества на электроды. Такое явление называется электролиз. Итак, пронаблюдаем процессы, которые происходят при электролизе. Диссоциация молекул сульфата меди в водном растворе протекает по следующей схеме:
![]()
Нейтрализовавшиеся атомы меди отлагаются в виде твердого осадка на катоде. Пройдя через электролит, масса вещества, выделившиеся на электроде, прямо пропорциональна общему заряду. В 1832 году Майкл Фарадей открыл эту закономерность:
m = kIt (1)
где:
·
![]() -
электрохимический эквивалент вещества, постоянная величина равная отношению
массы иона к его заряду
-
электрохимический эквивалент вещества, постоянная величина равная отношению
массы иона к его заряду
· n - валентность вещества (меди);
· М - его молярная масса. Молярная масса меди - 63,5 *10-3 кг/моль.
Вследствие этого, закон Фарадея будет таким:
![]() (2)
(2)
При помощи этого закона (закон Фарадея) вычисляется заряд электрона:
![]() (3)
(3)
Числом Фарадея назвали произведение заряда электрона на число Авогадро NA. Электрический заряд, переносимый в количестве 1 моль при электролизе:
F = eNA (5)
Формула 5 и есть число Фарадея.
2. Порядок выполнения работы
Электрохимический метод позволяет определить заряд электрона при помощи закона электролиза Фарадея. Следуя инструкциям, выполните лабораторную работу.
1. Запустить виртуальную лабораторную установку - https://multiring.ru/eor/html/651/content/47871/47871.htm. Если необходимо, то обнулить данные (Рисунок 1).
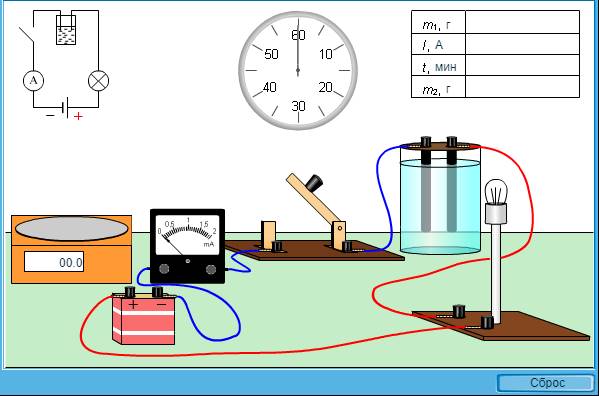
Рисунок 1 – Экспериментальная схема для определения заряда электрона
2. С помощью курсора, перенести катод на весы и взвесить до прохождения тока (m1, кг). Занести данные в Таблицу 1.
3. Замкнуть ключ. Записать показания амперметра в Таблицу 1.
4. Разомкнуть цепь по истечении 20 мин (это произойдёт автоматически). Записать показания времени на в Таблицу 1.
5. С помощью курсора, перенести электрод на весы и взвесить после электролиза – после прохождения через него электрического тока (m2, кг). Занести данные в Таблицу 1.
6. Вычислить заряд электрона используя Формулу 6. Полученные результаты и записать в Таблицу1. Все расчеты и вычисления поместить после Таблицы 1.
![]() (6)
(6)
Таблица 1 – Результаты измерений и вычислений
|
№ опыта |
m1, кг |
m2, кг |
I, А |
t, с |
e, Кл |
|
1 |
|
|
2 |
|
|
ВЫЧИСЛЕНИЯ:……
7. Рассчитать относительную погрешность измерения по Формуле 7 зная, что истинное значение заряда электрона е=1,6*10-19 Кл:
![]() (7)
(7)
3. Вывод:...
Прикрепить выполненную работу к порталу
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.