Методические указания к выполнению практических работ по химии



СОДЕРЖАНИЕ
1. Пояснительная записка……………………………………………. 4
2. Перечень практических работ по дисциплине «Химия»………... 5
3. Критерии оценивания практических работ………………………. 6
4. Инструкции к выполнению практических работ………………… 7
Инструкция к выполнению практической работы № 1…………. 7
Инструкция к выполнению практической работы № 2…………. 12
Инструкция к выполнению практической работы № 3…………. 17
Инструкция к выполнению практической работы № 4…………. 22
Инструкция к выполнению практической работы № 5…………. 30
Инструкция к выполнению практической работы № 6…………. 34
Инструкция к выполнению практической работы № 7…………. 44
Инструкция к выполнению практической работы № 8…………. 51
Инструкция к выполнению практической работы № 9…………. 56
Инструкция к выполнению практической работы № 10………. 62
Инструкция к выполнению практической работы № 11………. 70
Приложение А. Образец оформления титульного листа 74 практических работ………………………………………………...
Приложение Б. Образец оформления штампа листа 76 практических работ ………………………………………………..
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Практикум составлен на основе рабочей программы по химии и рассчитан на 22 часа.
В практикуме приведены описания методик выполнения практических работ, а также контрольные вопросы для активации самостоятельной работы и более глубокого усвоения учебного материала.
Целью практикума является оказание помощи обучающимся в изучении химии и овладении экспериментальными навыками при работе с химическими веществами.
В данной работе представлены разработки практических работ по темам курсов общей и органической химии. Методики практических работ представлены с конкретными заданиями, вопросами, что существенно облегчает работу студентов и преподавателя. В теоретической части каждой работы представлена главная информация по данной теме, которая потребуется студенту; список вопросов для самостоятельной проверки знаний.
Практические работы подобраны с учётом базовой программы для СПО. Это и опыты, освещающие важные вопросы базового курса и могут быть рекомендованы в качестве формы их практической отработки, а так же опыты, рассчитанные на домашнее экспериментальное исследование, как вариативные и дополнительные работы. Проведение таких опытов расширяет и углубляет содержание учебного материала, что даёт возможность не только повышать качество знаний студентов и их интерес к изучению химии, но и развивать индивидуальные способности студентов, и, следовательно, позволяет применять дифференцированный подход при химических исследованиях.
Как показывает практика, использование практикума является эффективным средством формирования не только интеллектуальных способностей, но и развитию познавательной активности студентов, что в свою очередь является одним из показателей социально-профессиональной мобильности студентов.
ПЕРЕЧЕНЬ
практических работ по дисциплине ОУД. 07 Химия
|
Наименование раздела |
Название практической работы |
Количество часов |
|
|
дневная форма |
заочная
форма |
||
|
Основы строения вещества |
Решение заданий на использование химической символики и названий соединений |
2 |
- |
|
Основы строения вещества |
Решение практико- ориентированных теоретических заданий на характеризацию химических элементов |
2 |
- |
|
Химические реакции |
Составление уравнений реакций ОВР методом электронного баланса |
2 |
- |
|
Химические реакции |
Количественные отношения в химии |
2 |
|
|
Химические реакции |
Реакции ионного обмена |
2 |
|
|
Строение и свойства неорганических веществ |
Классификация и номенклатура неорганических веществ |
2 |
|
|
Строение и свойства неорганических веществ |
Составление уравнений химических реакций с участием простых и сложных неорганических веществ |
2 |
|
|
Строение и свойства органических веществ |
Номенклатура отдельных классов органических соединений, моделирование их молекул |
2 |
|
|
Строение и свойства органических веществ |
Составление уравнений и схем химических реакций с участием органических веществ на основании их состава и строения |
2 |
|
|
Кинетические и термодинамические Закономерности протекания химических реакций |
Решение практико- ориентированных заданий на анализ факторов, влияющих на изменение скорости химической реакции, на применение принципа Ле Шателье |
2 |
|
|
Растворы |
Решение задач на приготовление растворов заданной концентрации |
2 |
|
|
|
Всего: |
22 |
- |
КРИТЕРИИ ОЦЕНИВАНИЯ практических работ Уровень качества выполнения практических работ по дисциплине определяется согласно существующему положению по четырехбалльной системе: «5», «4», «3», «2».
Оценка «5» (отлично) выставляется тогда, когда студент полностью, самостоятельно (в рамках, определенных преподавателем) выполнил задание, своевременно и правильно его оформил и составил отчет, а также ответил на все контрольные вопросы. Ответы студента свидетельствуют, что он обладает глубокими, крепкими, обобщенными, системными знаниями учебного материала по данной теме. Ответ студента полный, правильный, логичный, содержит анализ, систематизацию, обобщение. Студент умеет самостоятельно находить источники информации и пользоваться ими, оценивать полученную информацию. При выполнении практической работы допускает 1-2 неточности, самостоятельно обнаруживает и исправляет. Проявляет познавательно – творческий интерес к материалу практической работы.
Оценка «4» (хорошо) выставляется тогда, когда студент самостоятельно, с пониманием выполняет задачи практической работы, анализирует, сравнивает информацию и делает выводы. Работа студента в целом правильная, логичная и достаточно обоснована. Выполняет задачи практической работы по типовому алгоритму. Достаточно осознанно пользуется справочной информацией и технической документацией, анализирует и делает выводы. Во время выполнения заданий практических работ допускает несущественные ошибки, которые может исправить самостоятельно.
Оценка «3» (удовлетворительно) выставляется тогда, когда студент без достаточного понимания воспроизводит учебный материал и выполняет задачи практических работ в неполном объеме. Недостаточно обоснованно анализирует и сравнивает информацию. Неосознанно пользуется технической документацией. Во время выполнения заданий практических работ допускает ошибки, самостоятельно исправить не может.
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 1
Тема: решение заданий на использование химической символики и названий соединений.
Цель: совершенствование умений составлять формулы бинарных соединений, называть их; производить простейшие расчеты по молекулярным формулам.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
3. Калькулятор.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определения простым веществам.
1.2 Дать определения сложным веществам.
1.3 Привести примеры оксидов.
1.4 Привести примеры кислот.
1.5 Привести примеры оснований.
1.6 Привести примеры солей.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля. Теоретическая часть Бинарные соединения – это сложные вещества, состоящие из атомов двух химических элементов (как правило, на первом месте записывается элемент с положительной степенью окисления, на втором месте – с отрицательной степенью окисления).
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов.
Степень окисления показывает, сколько электронов смещается к более электроотрицательному элементу.
Электроотрицательность (ЭО) – свойство атомов данного химического элемента оттягивать к себе общие электронные пары.
Степень окисления может иметь положительное, отрицательное и нулевое значения.
Степени окисления расставляются: вверху над символом элемента, причем вначале пишется заряд (+ или -), а затем число (1,2,3).
Примеры веществ, в которых у элементов проставлены степени окисления:
Na2+1S-2, H2+1O-2, Cl20.
Для того, чтобы по формулам химических соединений рассчитать степени окисления с.о., необходимо знать определенные правила.
1. В соединениях отрицательное значение с.о. имеют элементы с большим значением электроотрицательности, а положительное значение с.о. – элементы с меньшим значением электроотрицательности.
2. Есть элементы с постоянной с.о. и элементы с переменной с.о. Элементы с постоянным значением с.о.:
а) металлы всегда имеют положительное значение с.о.
У металлов главных подгрупп: I группы во всех соединениях с.о. равна +1, II группы - +2, III группы - +3.
б) элемент фтор в соединениях всегда проявляет степень окисления -1 Элементы с переменным значением с.о.:
а) все остальные металлы (кроме перечисленных выше металлов);
б) почти все неметаллы;
в) кислород почти всегда имеет с.о. -2;
г) в большинстве соединений водород имеет с.о. +1.
3. У элементов, которые в бинарном соединении записываются на втором месте, с.о. отрицательна и рассчитывается по формуле: №группы элемента -8.
4. У простых веществ и свободных атомов с.о. всегда равна нулю (H2, N2, Fe, Al, Cl, N, Na).
5. В соединениях сумма всех степеней окисления элементов всегда равна нулю. То есть, сумма положительных и отрицательных зарядов в молекуле всегда равна нулю.
6. Для того, чтобы рассчитать с.о. одного элемента в соединении, надо знать с.о. другого элемента.
Нахождение с.о. по формуле вещества
Составим алгебраическое уравнение с одним неизвестным для определения значения с.о. в каком-либо соединении.
Найдем с.о. хлора в соединении Cl2O. Выпишем с.о. кислорода и обозначим неизвестную степень окисления хлора через х: Cl2xO-2 Составим уравнение:
2х+(-2)▪1=0; 2х=2; х=+1
Записываем степень окисления хлора: Cl2+1O-2
Составление формулы соединения по известным с.о.элементов
Например, составить формулу бинарного соединения алюминия с углеродом.
Запишем знаки алюминия и углерода: Al и C, причем вначале записываем элемент с положительным значением с.о. (какой это элемент в нашем примере?), а затем – элемент с отрицательным значением с.о. Теперь по порядку:
1. Алюминий находится в 3 группе, это металл, его с. о. всегда положительна и равна +3.
2. Углерод находится в 4 группе, его с.о. его будет равна -4 (4 – 8 = -4)
Запишем эти значения в формулу: Al+3C-4, найдем наименьшее общее кратное для них (оно равно 12). Затем рассчитаем индексы: Al +3 C -4 → Al4C3
Названия бинарных соединений образуются из двух слов – названий входящих в их состав химических элементов. Вначале произносят корень латинского названия элемента с отрицательной с.о. (у нас углерод, его латинское название - карбонеум), добавляя суффикс – «ид» (в именительном падеже), после этого добавляют название элемента с положительной с.о. в родительном падеже.
Например: NaCl – хлорид натрия, MgS – сульфид магния, KH – гидрид калия.
Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив с. о. римской цифрой, которую ставят в конце названия в скобках.
Например: Fe+2O-2 оксид железа(II); Fe2+3O3-2 оксид железа(III).
Если же соединение состоит из двух элементов-неметаллов, то к корню латинского названия более ЭО (находится в формуле на втором месте) из них прибавляют суффикс «ид», второй компонент называют в родительном падеже.
Например: O+2F2-1 – фторид кислорода, S+4O2-2- оксид серы (IV), S+6O3-2- оксид серы (VI).
В некоторых случаях число атомов элементов обозначают при помощи названий греческих числительных – моно, ди, три, тетра.
CO- монооксид углерода, CO2- диоксид углерода, PbCl4- тетрахлорид фтора.
Относительная молекулярная масса (Mr)- безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы изотопа углерода C12.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры:
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
Массовая доля химического элемента. Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греческой буквой «омега» - ω и рассчитывается по формуле:
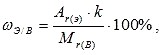
где k – число атомов этого эле мен та в молекуле.
Пример: рассчитать массовые доли водорода и кислорода в молекуле воды Н2О.
Решение:
1) Вычисляем относительную молекулярную массу воды: Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18 2) Вычисляем массовую долю водорода в воде:
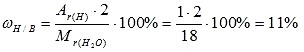
3) Вычисляем массовую долю кислорода в воде. Так как в со став воды входят атомы толь ко двух химических элементов, массовая доля кислорода будет равна:
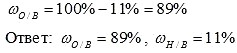
Образец оформления задачи:

Практическая часть
Задание 1. Составление формул и номенклатура бинарных соединений:
|
Вариант 1 |
Вариант 2 |
|
1. Определите степени окисления атомов элементов в соединениях, формулы которых SiO2, Nа2О, К2S, LiВг. Приведите названия каждого из веществ. |
1. Определите степени окисления атомов химических элементов в соединениях, формулы которых Н2O, АlСl3, N2О5, Nа3Р. |
|
2. Какая из следующих формул соответствует оксиду азота (II): NО, N2О5, NО2, N2О? |
2. Выберите формулу оксида марганца (IV): МnО, Мn2O7, МnF4, МnО2. |
|
3. Напишите формулы веществ: а) оксида серы (IV) б) оксида серы (VI). |
3. Напишите формулы веществ: а) оксида меди (II); б) оксида натрия. |
Задание 2. Вычисление массовой доли элемента.
|
Вариант 1 |
Вариант 2 |
|
1. Вычислите массовые доли элементов в cульфате натрия Na2SO4 |
1. Вычислите массовые доли элементов в карбонате калия K2CO3 |
|
2. Какой из оксидов FeO или Fe2O3 богаче железом? |
2. Какой из оксидов CuO или Cu2O богаче кислородом? |
Решения задач оформите в соответствии с образцом, приведенным в теоретической части.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание; - вывод.
4. Вопросы выходного контроля:
4.1. Бинарным веществом является:
1) HNO3 2) CO 3)NaOH 4)H2SO3
4.2. Степень окисления фосфора в соединении P2O5 равна:
1) -3 2) 0 3) +5 4) +3
4.3. Степень окисления +2 характерна для:
1) для металлов 1 группы 2) для металлов 3 группы 3) для металлов 2 группы 4) для неметаллов 6 группы
4.4. Атомы в молекулах простых веществ и атомы в свободном состоянии имеют степень окисления
1) 0 2) -1 3) +1 4) +2
4.5. Какую формулу имеет соединение, в котором элементы имеют степени окисления +1 и-3 соответственно? 1) P2О5 2)P2O3 3)PF3 4) K3P
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 2
Тема: решение практико-ориентированных теоретических заданий на характеризацию химических элементов.
Цель: научиться делать описание химического элемента и вещества, используя периодическую систему химических элементов Д.И. Менделеева.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определение понятию химический элемент.
1.2 Дать определение понятию атом.
1.3 Дать определение понятиям «группа ПСХЭ», «период ПСХЭ.
1.4 Объяснить, как изменяются окислительно-восстановительные свойства химических элементов по группе сверху вниз.
1.5 Объяснить, как изменяются окислительно-восстановительные свойства химических элементов в периоде слева направо.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
План – алгоритм характеристики элемента
по его положению в ПСХЭ Д. И. Менделеева
1. Название.
2. Химический знак, относительная атомная масса (Ar)
3.Порядковый номер
4. Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б») 6. Состав атома: число электронов, число протонов, число нейтронов Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f) Подсказка! s-элементы: это первые два элемента в 1-7 периодах; p-элементы: последние шесть элементов1-6 периодов; d-элементы: это элементы больших периодов (по 10 штук) между s-
и p-элементами; f-элементы: это элементы 6 и 7 периодов – лантаноиды и
актиноиды, они вынесены вниз таблицы.
8. Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы "А" - Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно двум (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат один электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
9. Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 pэлементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11. Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12. Летучее водородное соединение (только для s, p) Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
Для составления характеристики элемента воспользуйтесь Периодической системой химических элементов Д.И. Менделеева.
Каждый элемент находится в ней в своей ячейке. Большая часть описания берется именно оттуда.
1- обозначение химического элемента.
2-
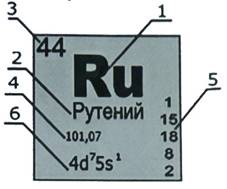 русское название
русское название
3- порядковый номер химического элемента (равен количеству протонов в атомном ядре, равен заряду ядра).
4- атомная масса (массовое число) = масса протонов + масса нейтронов.
5- распределение электронов по энергетическим уровням.
6- электронная конфигурация; число
электронных оболочек равно номеру периода.
При расчете количества нейтронов можно воспользоваться следующей таблицей:
|
частица |
заряд |
характеристика |
|
Протон (р+) |
+ |
Сумма протонов (Z) = заряд ядра = количество электронов – порядковый номер элементов |
|
Нейтрон (n0) |
Нет заряда |
Масса протона = масса нейтрона; в сумме – атомная масса ( массовое число – А) |
|
Электрон (е-) |
- |
Масса ничтожна |
Практическая
Вариант 1
Дайте общую характеристику элементов с порядковыми номерами 15, 25, 38, 56 по плану приведенному выше.
Вариант 2
Дайте общую характеристику элементов с порядковыми номерами
14, 26, 37, 55 по плану приведенному выше.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Сколько электронов может максимально находиться на одной электронной орбитали?
4.2. Сколько электронов максимально может находиться на s-, р-, dподуровне?
4.3. Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали?
4.4. Сколько электронов находится на внешнем энергетическом уровне атомов: а) Гелия; б) Лития; в) Бериллия; г) Бора; д) Углерода.
4.5. Сколько энергетических уровней заняты электронами в атомах:
а) Лития, Натрия, Калия; б) Бериллия, Магния, Кальция; в) Фтора, Хлора, Брома?
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 3
Тема: составление уравнений реакций ОВР методом электронного баланса.
Цель: составление окислительно-восстановительных реакций методом электронного баланса, определение окислителя, восстановителя.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определение понятию «химические реакции».
1.2 Привести классификацию химических реакций по числу и составу исходных веществ и продуктов реакции.
1.3 Привести классификацию химических реакций по тепловому эффекту.
1.4 Привести классификацию химических реакций по изменению степени окисления
1.5 Привести классификацию химических реакций по признаку обратимости.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая
Степень окисления элемента - это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Реакции, в ходе которых происходит изменение степени окисления элементов, называются окислительно-восстановительными.
Например:
Zn + H2SO4= ZnSO4 + H2
Zn0 – 2e = Zn+2 процесс окисления; Zn0 - восстановитель
2H+1 + 2e = H20 процесс восстановления; Н+ - окислитель
Металлический цинк Отдает электроны, Окисляется, а сам является Восстановителем (восстановитель – это тот, кто электроны отдает).
Катионы водорода Взяли электроны, Восстановились, а сами являются Окислителями.
Соединение, содержащее элемент в высшей степени окисления, может быть только окислителем (например: KMnO4).
Соединение, содержащее элемент в низшей степени окисления, может быть только восстановителем (например: H2S).
Соединение, содержащее элемент в промежуточной степени окисления, может быть и окислителем, и восстановителем, в зависимости от его роли в конкретной химической реакции (например: H2SO3).
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Алгоритм составления уравнений. Напишем уравнение реакции между алюминием и кислородом и определим степени окисления элементов
Al0 + O20 = Al2+3 O3-2
Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
Al0 - 3e = Al+3 4 восст-ль, ок-ся O20 + 4e = 2O-2 3 ок-ль, восст-ся
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12.
Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2.
Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях:
KMnO4 + KCl + H2SO4 = Cl2 + MnSO4 + K2SO4 +H2O
![]()
Электронный баланс:
Mn+7 + 5e = Mn+2 2 ок-ль, восст-ся 2Cl-1 - 2e = Cl2 5 восст-ль, ок-ся
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4+8H2O Практическая
Задание 1: Какие соединения и простые вещества могут проявлять только окислительные свойства? Выпишите такие вещества из предложенного перечня, укажите степень окисления элемента-окислителя:
|
Вариант 1 |
Вариант 2 |
|
NH3, CO, SO2, KMnO4, Сl2, HNO2. |
H2S, SiO, P2O3, H2SO4, H2SO3, N2 |
Задание 2: Какие соединения и простые вещества могут проявлять только восстановительные свойства? Выпишите такие вещества из предложенного перечня, укажите степень окисления элементавосстановителя:
|
Вариант 1 |
Вариант 2 |
|
H2S, HMnO4, Mg, Al2O3, KNO3 |
H2SO3, NH3 , SiO2, P2O5, Fe |
Задание 3: Подберите коэффициенты в следующих уравнениях окислительно-восстановительных реакций методом электронного баланса, укажите окислитель и восстановитель:
Вариант 1
1. NH3 + O2 → NO + H2O
2. PH3 + Cl2 → PCl3 + HCl
3. CuO + NH3 → Cu + N2 + H2O
4. Zn + H2SO4 → ZnSO4+ H2S + 4H2O
5. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
Вариант 2
1. P + N2O→ N2 + P2O5
2. Н2S + Cl2 → S + HCl
3. HCl + MnO2 → Cl2 + MnCl2 + H2O
4. Cu + HNO3 → Cu(NO3)2 +NO + H2O
5. H2S + KMnO4 + H2SO4 → MnSO4 + S + K2SO4 + H2O
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Высшая степень окисления элемента определяется:
а) по номеру периода б) по номеру группы
в) по порядковому номеру г) по подгруппе
4.2. Степень окисления восстановителя в окислительновосстановительной реакции:
а) повышается б) понижается
в) остается без изменения г) сначала повышается, затем понижается 4.3. Схема, отражающая процесс окисления:
а) S0 → S-2 б) S+6 → S+4
в) S+4→ S+6 г) S+6 → S-2
4.4. Укажите вещество, в котором атом углерод имеет наибольшую степень окисления:
а) CО2 б) CH4
в) СО г) СаС2
4.5. Степень окисления атома азота в ионе аммония NH4+:
а) – 3 б) - 4
в) +3 г) + 4
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 4
Тема: количественные отношения в химии.
Цель: закрепить умения решать количественные задачи по нахождению количества вещества, молярной массы, молярного объема, относительной плотности газов, массовой доли элементов в соединении.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определение понятиям: химический элемент, атом, атомная масса, молекула, молярная масса.
1.2 Дать определение понятию «количество вещества», какова его размерность.
1.3 Привести значение постоянной Авогадро.
1.4 Привести единицы измерения массы, молярной массы и объема вещества.
1.5 Объяснить, что называется нормальными условиями (н.у.).
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Обозначение: Ar
Относительна атомная масса - это отношение массы данного атома к массе атома водорода:
Ar = 𝒎ат. /𝒎ат𝑯
Показывает во сколько раз масса данного атома больше массы атома водорода
Является безразмерной величиной.
Определяется по Периодической системе:
Ar(H) = 1
Ar(O) = 16
Ar(C) = 12
Ar(S) = 32
Ar(Na) = 23
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА
Обозначение: Мr
Относительна молекулярная масса - это отношение массы данной молекулы к массе атома водорода:
Мr = 𝒎молек. /𝒎ат𝑯
Показывает во сколько раз масса молекулы больше массы атома водорода
Является безразмерной величиной.
Определяется по Периодической системе:
Мr(H2) = 2
Мr(O2) = 32
Мr(CО2) = 12 + 16*2 = 44
Mr(H2SO4) = 1*2 + 32 + 16*4 = 98
Mr(Na2CO3) = 23*2 + 12 + 16*3 = 106
КОЛИЧЕСТВО ВЕЩЕСТВА
В процессе химических реакций атомы (или молекулы) вещества друг с другом взаимодействуют, образуя новые молекулы. Но определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооруженным глазом.
Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества (n – «эн»).
Единицей количества вещества является моль (от слова «молекула»).
1 моль любого вещества содержит 6,02·1023 частиц (молекул, атомов, ионов), т. е. число частиц в 1 моле – это и есть постоянная величина (NA постоянная Авогадро).
Например:
1 моль Са имеет массу 40 г и содержит 6,02·1023 атомов кальция 1 моль CaCl2 (ионное соединение) имеет массу 111 г и содержит 6,02·1023 ионов кальция и 12,04·1023 ионов хлора.
1 моль H2O имеет массу 18 г и содержит 6,02·1023 молекул воды или
6,02·1023 атомов кислорода и 12,04·1023 атомов водорода.
Используя постоянную Авогадро, можно находить количество вещества, если известно число молекул в нем, и наоборот.
Количество вещества равно отношению общего числа его молекул к постоянной Авогадро. n =N / NA
Зная количество вещества, находят число структурных единиц N. Зная число структурных единиц, находят количество вещества n.
Задача. Рассчитайте, сколько атомов содержится в 0,5 моль метана СН4?
Рассуждаем, если 1 моль СН4 содержит 6,02·1023 молекул, то 0,5 моль СН4 содержит 3,01·1023 молекул
1 молекула СН4 содержит 5 атомов, следовательно
3,01·1023·5=15,5·1023 молекул.
Если считать отдельно атомов углерода, то видно, что их будет
3,01·1023, а атомов водорода будет 3,01·1023·4=12,04·1023
Задача. Рассчитайте количество вещества, которое соответствует 0,6·1023 молекул аммиака NH3 ?
n (NH3)= N / NA = 0,6·1023 /6,02·1023 = 0,099 моль
МОЛЯРНАЯ МАССА
Установлено, что масса одного моля вещества численно равна его относительной молекулярной массе. Такая величина называется молярной массой вещества, М. Молярная масса измеряется в г/моль.
Например, молярная масса азота N2 равна 28 г/моль.
Количество вещества можно вычислить, разделив массу порции вещества на молярную массу этого вещества:
n =m / М.
Задача. Какое количество оксида кальция содержится в 112 г этого вещества?
|
Дано: m (СаО )=112г Найти: n (СаО) – ? |
Решение: Химическая формула оксида кальция – СаО. n(CaO) = m(CaO)/М(СаО) Mr(CaO) = 40 + 16 = 56 n(CaO) = 112 г/ (56г/моль) = 2 моль |
|
Ответ: 2 моль СаО. |
|
Задача. Вычислите массу порции воды, в которой содержится столько же молекул, сколько их в 22 г углекислого газа.
|
Дано: m(CO2) = 22 г n(CO2) = n(H2O) |
Зная массу углекислого газа, рассчитывают его количество. Затем находят количество воды (оно будет равно количеству углекислого газа). А потом, зная количество воды, вычисляют ее массу: m(CO2) → n(CO2) → n(H2O) → m(H2O) Решение 1. n(CO2) = m(CO2)/М(СО2) Mr(CO2) = 12 + 16·2 = 44 n(CO2) = 22 г/ 44 г/моль = 0,5 моль 2. n(H2O) = n(CO2) = 0,5 моль 3. m(H2O) = n(H2O)·M(H2O) Mr(H2O) = 1·2+16 = 18 m(H2O) = 0,5 моль·18 г/моль = 9 г
|
|
Найти: m(H2O) – ?
|
|
|
Ответ: 9 г Н2О.
|
|
МОЛЯРНЫЙ ОБЪЕМ
В 1811 году итальянский ученый Амедео Авогадро сформулировал основной газовый закон, который назвали его именем.
Закон Авогадро звучит так: в равных объемах газов при одинаковых условиях содержится равное число молекул.
Следовательно, при одинаковых условиях равные количества различных газов занимают равные объемы.
При нормальных условиях (при температуре 0 °С и давлении 1 атм.) 1 моль любого газа занимает объем 22,4 л.
Эта физическая постоянная – молярный объем газа при н. у.:
Vm = 22,4 л/моль при нормальных условиях.
Количество газообразного вещества равно отношению объема порции газа к молярному объему газа при данных условиях.
n = V / Vm.
Задача. Вычислите массу метана СН4, объем которого при н. у.
|
составляет 67,2 л. |
|
|
Дано: V(CН4) = 67,2 л Найти: m(CН4) – ?
|
Решение. Алгоритм решения V(CН4) → n(CН4) → m(CН4) 1) n(CН4) = V(CН4)/Vn = 67,2 л/ 22,4 (л/моль) = 3 моль 2) m(CН4) = n(CН4)·M(CН4) Mr(CН4) = 12 + 1·4 =16 m(CН4) = 3 моль·16 г/моль = 48 г
|
|
Ответ: 48 г CН4. |
|
ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ ГАЗА
Относительная плотность газа — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
D = M1 / M2
Эта постоянная величина выводится из следствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей): m1/m2 = M1 / M2 = D
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Очень часто определяют относительную плотность газа по воздуху.
М (воздуха) = 29 г/моль
Зная относительную плотность газа, можно определить его молярную массу:
М (газа1) = М(газа 2) • Dгаза 2 (газа 1)
Задача. Определить относительную плотность аммиака по водороду.
Решение:
DH2(NН3) = М(NН3) / М(Н2)
М(NH3) = 17г/моль, М(Н2) = 2г/моль
DH2(NН3) =17г/моль / 2г/моль = 8,5
Задача. Определите молярную массу газа, если его относительная плотность по воздуху равна 2,207.
Решение:
Из Dвозд.(газа) = Мгаза / М(воздуха) имеем:
Мгаза = М(воздуха) · Dвозд. = 29 г/моль · 2,207 = 64,0 г/моль.
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА
Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = n·Ar(элемента) / Mr(вещества) ·100 %
где w – массовая доля элемента в веществе, Ar– относительная атомная масса, n– индекс в химической формуле,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях: w (элемента) = 20% или 0,2.
Задача. Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
|
Дано: Фосфорная кислота H3PO4
Найти: w%(H) w%(P) w%(O)
|
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты Ar(H)=1, Ar(P)=31, Ar(O)=16 2.Записываем формулу расчета в общем виде Mr(H3PO4): Mr(H3PO4) = n1·Ar(H) +n2·Ar(P) + n3·Ar(O) 3.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем: Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 4. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) для водорода: w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% для фосфора: w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% для кислорода: w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка: Сумма значений массовых долей всех элементов должна составить 100%. w(H) + w(P) + w(O) = 100% Подставляем значения: 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Ответ: w(H) = 3,06%, w(P) = 31,63%, w(O) = 65,31%
|
|
|
|
Практическая часть
Вариант 1
1.Пользуясь значениями атомных масс элементов из Периодической таблицы, рассчитайте молярную массу (г/моль) для следующих веществ: NaF, BaSO4, NaOH,, Ca3(PO4)2 .Сколько молекул содержится в 1 моле каждого из этих веществ?
2.Определить какое число молекул содержится в 3 моль Н2SO4.
3.Масса газа объемом 300 л составляет 214 г. Определить молярную массу этого газа.
4..Вычислить массовые доли (в %) элементов в веществах: MgO, CuSO4.
5.Рассчитать количество моль CO2, которое содержится при нормальных условиях в 10 л емкости.
6.Определить относительную плотность хлороводорода по аммиаку.
Вариант 2
1. Найти относительную молекулярную массу веществ: Fe(OH)3, KCl, Na2SO4, Mg3(PO4)2.
2. Определить какое число молекул содержится в 5 моль Fe.
3. Масса газа объемом 448 л составляет 88 г. Определить молярную массу этого газа.
4. Вычислить массовые доли (в %) элементов в веществах: NaOH, KCl.
5. Рассчитать количество моль NH3, которое содержится при нормальных условиях в 15 л емкости.
6. Определить относительную плотность метана по воздуху.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Наибольшую относительную молекулярную массу имеет вещество с формулой: MgO, Al2O3, NaOH
4.2. Вычислить массу железа, взятого количеством 1,5 моль.
4.3. Записать формулу, связывающую объём, количество вещества и молярный объём.
4.4. Записать формулу, связывающую массу, количество вещества и молярную массу.
4.5. Определить относительную плотность аммиака (NH3) по водороду
(Н2).
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 5
Тема: реакции ионного обмена.
Цель: закрепить и расширить знания об особенностях и условиях протекания реакций ионного обмена, закрепить умения составлять ионные уравнения.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
3. Таблица растворимости.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определения понятию ион, катион, анион.
1.2 Объяснить, что представляет собой процесс диссоциации.
1.3 Объяснить, на какие ионы распадаются в результате диссоциации кислоты.
1.4 Объяснить, на какие ионы распадаются в результате диссоциации основания.
1.5 Объяснить, на какие ионы распадаются в результате диссоциации соли.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Многие химические реакции происходят в растворах, которые содержат ионы. Поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
Реакции ионного обмена – это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Реакции ионного обмена протекают до конца в следующих случаях:
1. Если образуется осадок (нерастворимое в воде вещество):
р р н р NaCl + AgNO3 = AgCl + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl + Na+ + NO3-
Ag+ + NO3- = AgCl
2. Если образуется газообразное вещество :
Na2CO3 + 2НCl =2NaCl + Н2O + СО2
2Na+ + C O3 2-+ 2Н++ 2С l - = 2Na+ + 2Cl - + Н2O + СО2 C O3 2-+ 2Н+= Н2O + СО2
3. Если образуется малодиссоциирующее вещество - Н2O:
КОН + НNO3 = КNO3 + Н2O
К+ + ОН - + Н + + NO3- = Н2O + К+ + NO3-
ОН - + Н + = Н2O
Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка, газа, или воды Н2O, то реакция является обратимой.
Правила cоставление ионных уравнений
1.Простые вещества, оксиды, нерастворимые кислоты, основания и соли не диссоциируют.
2.Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3.Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
Алгоритм составления ионного уравнения реакции
|
Алгоритм составления ионного уравнения реакции |
Пример |
|
1. Записать молекулярное уравнение реакции. Расставить коэффициенты. 2. С помощью таблицы растворимости определить растворимость каждого вещества 3. Составить полное ионное уравнение, записывая растворимые в воде вещества в виде ионов, а нерастворимые вещества, газообразные вещества и воду в виде молекул. 4. Составить сокращённое ионное уравнение, найдя одинаковые ионы в уравнении слева и справа и сократив их. |
3NaОН + FeCl3 = Fe(ОН)3 + 3NaCl
р р н р 3NaОН + FeCl3 = Fe(ОН)3 + 3NaCl
3Na++3ОН- + Fe3++3Cl - = Fe(ОН)3 + 3Na+ +3Cl-
+ 3ОН- + Fe3+ = Fe(ОН)3 |
Практическая часть
Вариант 1
Задание 1. Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
1) К2CO3 + Н2SО4 = … + … + СО2
2) AgNO3 + Н3РO4 = … + …
3) Ва(ОН)2 + НCl = … + …
Задание 2. Напишите молекулярные и ионно-молекулярные уравнения взаимодействия пар веществ: - гидроксид магния и азотная кислота; - карбонат кальция и соляная кислота.
Задание 3. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ:
иодид калия, гидроксид калия, серная кислота, азот, сульфат натрия.
Задание 4. Рассчитайте массу соли, полученной при взаимодействии 200 г 10% раствора нитрата серебра с 100 г 5% раствора хлорида магния.
Вариант 2
Задание 1. Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
1) Nа2C O3 + НCl = … + … + СО2
2) Ва(NO3)2 + Н2SО4 = … + …
3) Са(ОН)2 + НNO3 = … + …
Задание 2. Напишите молекулярные и ионно-молекулярные уравнения взаимодействия пар веществ:
- гидроксид натрия и азотистая кислота; - сульфид калия и серная кислота.
Задание 3. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ:
сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III).
Задание 4. Рассчитайте массу соли, полученной при взаимодействии
100г 2% раствора гидроксида натрия и 200г 5% раствора нитрата железа
(II).
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Объяснить, в каких случаях реакции ионного обмена идут до конца. 4.2. Привести пример уравнения реакции, идущей с выделением газообразного вещества.
4.3. Привести пример уравнения реакции, идущей с образованием осадка. 4.4. Привести пример уравнения реакции, идущей с образованием малодиссоциирующего вещества.
4.5. Написать уравнения реакций диссоциации хлорида меди, гидроксида бария, серной кислоты.
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 6
Тема: классификация и номенклатура неорганических веществ.
Цель: закрепить и расширить знания о классификации и номенклатуре неорганических веществ различных классов.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определения понятиям: простые вещества, сложные вещества.
1.2 Привести примеры оксидов.
1.3 Привести примеры оснований.
1.4 Привести примеры кислот.
1.5 Привести примеры солей.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Классификация неорганических веществ основана на их способности к разложению. Простые вещества, состоящие из атомов только одного химического элемента (O2, H2, Mg), не распадаются. Легко разлагаются сложные вещества, состоящие из атомов двух и более элементов (CO2, H2SO4, NaOH, KCl). К важнейшим классам неорганических веществ по традиции относят:
• простые вещества (металлы и неметаллы),
• оксиды (кислотные, основные и амфотерные),
• гидроксиды (часть кислот, основания, амфотерные гидроксиды),
• соли.
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
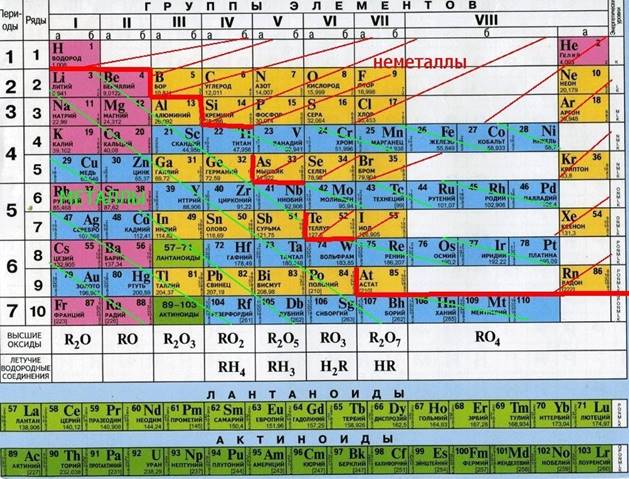
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
ОКСИДЫ
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
|
Основные |
Амфотерные |
Кислотные |
Несолеобразующие |
Солеобразные (двойные) |
|||
|
|
Оксиды металлов в степенях окисления +2: толькоBe, Zn, Sn, Pb; +3 (все, кроме La2O3), +4 |
1) Оксиды неметаллов, кроме несолеобразующих; 2) Оксиды металлов в степенях окисления от +5 и выше. |
Оксиды неметаллов, которым не соответствуют кислоты.
NO, N2O, CO, (SiO)
|
Некоторые оксиды, в которых элемент имеет 2 степени окисления: Fe3O4
|
|||
|
С о л е о б р а з у ю щ и е |
|
||||||
|
|
|
|
|||||
|
|||||||
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания; Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
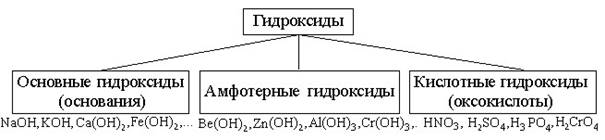
ГИДРОКСИДЫ
Гидроксиды – соединения, в состав которых входит группа Э–О-Н. И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды
– относятся к ГИДРОКСИДАМ!
Связь между оксидом и гидроксидами

Как составить формулу кислотного гидроксида:
А. Если чётная степень окисления элемента в оксиде:
ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO3 –(+H2O) = H2WO4
Б. Если нечетная степень окисления:
Мета-форма кислоты - ОДИН Орто-форма кислоты – отличается от МЕТАатом водорода: НЭОх формы на одну молекулу воды. Н3ЭОх+1
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 - это МЕТА-форма кислоты - мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТОформа. Прибавив к мета-форме Н2О, получим H3AsO4. Это ортомышьяковая кислота.
ОСНОВАНИЯ Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
|
Растворимые (Щелочи) |
Нерастворимые |
||
|
1) гидроксиды металлов первой группы главной подгруппы: LiOH, NaOH, KOH, RbOH, CsOH 2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Все остальные гидроксиды металлов. |
||
|
|
|
|
|
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле: однокислотные – содержащие только 1 гидроксогруппу двухкислотные – имеющие 2 гидроксогруппу; трёхкислотные – с тремя группами ОН.
КИСЛОТЫ
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Классификация кислот по составу
|
Кислородсодержащие кислоты |
Бескислородные кислоты |
|
1) высшие кислоты H2SO4 серная кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота 2) кислоты с меньшей степенью окисления неметалла H2SO3 сернистая кислота HNO2 азотистая кислота |
HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная |
H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
H3PO4 фосфорная |
Классификация по силе и устойчивости
|
Сильные кислоты |
Слабые кислоты |
|
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная HClO4 хлорная |
HF фтороводородная H3PO4 фосфорная HNO2 азотистая (неустойчивая) H2SO3 сернистая (неустойчивая) H2CO3 угольная (неустойчивая) H2S↑ сероводородная H2SiO3↓ кремниевая СН3СООН уксусная |
СОЛИ
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких) кислотных остатков.
Классификация солей.
|
|
|
СОЛИ |
|
|
|||
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
||
|
Продукт полного замещения атомов водорода в кислоте на металл |
Продукт непол-ного замещения атомов водоро-да в кислоте на металл |
Продукт неполного заме- щения ОНгрупп на кислотный остаток |
Содержат два разных металла и один кислотный остаток |
Содер-жат один металл и два кислотных остатка |
Содержат комплексный катион или анион – атом металла, связанный с несколькими лигандами. |
||
|
AlCl3 |
КHSO4 |
FeOHCl |
KAl(SO4)2 |
CaClBr |
K2[Zn(OH)4] |
||
|
Хлорид алюминия |
Гидросульфат калия |
Хлорид гидроксожелеза (II) |
Сульфат алюминиякалия |
Хлоридбромид кальция |
Тетрагидроксоцинкат калия |
||
|
|
|
|
|
|
|
|
|
Номенклатура солей. В названиях солей используются латинские названия образующих кислоты неметаллов.
|
Элемент |
Латинское название |
Корень |
|
Н |
гидрогениум |
ГИДР- |
|
С |
карбоникум |
КАРБ- |
|
N |
нитрогениум |
НИТР- |
|
S |
сульфур |
СУЛЬФ- |
Построение названий солей.
|
|
Соль какой кислоты |
Кислотный остаток |
Название солей |
Примеры |
|
Высшие кислоты |
Азотная HNO3 |
NO3- |
нитраты |
Ca(NO3)2 нитрат кальция |
|
Кремниевая H2SiO3 |
SiO32- |
силикаты |
Na2SiO3 силикат натрия |
|
|
Угольная H2CO3 |
CO32- |
карбонаты |
Na2CO3 карбонат натрия |
|
|
Фосфорная H3PO4 |
PO43- |
фосфаты |
AlPO4 фосфат алюминия |
|
|
Серная H2SO4 |
SO42- |
сульфаты |
PbSO4 сульфат свинца |
|
|
Бескислородные кислоты |
Бромоводородная HBr |
Br- |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I- |
иодиды |
KI иодид калия |
|
|
Сероводородная H2S |
S2- |
сульфиды |
FeS сульфид железа (II) |
|
|
Соляная HCl (хлороводородная) |
Cl-
|
хлориды |
NH4Cl хлорид аммония |
|
|
Фтороводородная HF |
F- |
фториды |
CaF2 фторид кальция |
|
|
Более низкая степень. ок. |
Cернистая кислота H2SO3 |
SO32- |
сульфиты |
К2SO3 сульфит калия |
|
Азотистая HNO2 |
NO2- |
нитриты |
КNO2 нитрит калия |
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку "гидро": NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо":
Mg(OH)Cl - гидроксохлорид магния (основная соль)
Двойные соли – имеют два разных катиона металла или аммония. В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их называют через дефис: СаOCl2 или CaCl(OCl) - хлоридгипохлорит кальция (традиционное название хлорная известь).
Комплексные соли – содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
Бытовые (тривиальные) названия некоторых солей.
|
Соль |
Международное название |
Традиционное название |
|
NaHCO3 |
Гидрокарбонат натрия |
Сода питьевая |
|
Na2CO3 |
Карбонат натрия |
Сода кальцинированная |
|
K2CO3 |
Карбонат калия |
Поташ |
|
Na2SO4 |
Сульфат натрия |
Глауберова соль |
|
KClO3 |
Хлорат калия |
Бертолетова соль |
|
Ca3(PO4)2 |
Фосфат кальция |
Фосфорит |
|
СаСО3 |
Карбонат кальция |
Известняк |
|
CuSO4∙5H2O |
Пентагидрат сульфата меди |
Медный купорос |
|
Na2CO3∙10Н2О |
Декагидрат карбоната натрия |
Сода кристаллическая |
Практическая часть
Вариант 1
Задание 1. Указать к какому классу принадлежат следующие неорганические соединения, дать им названия по систематической номенклатуре:
FeOHCl2, P2O5, CaCl2, NO, HCl, BaO, H3PO4, SrCO3.
Задание 2. Из задания № 1 выписать формулы кислот.
Задание 3. Составить формулы всех возможных оксидов для следующих элементов: Ca , S, O, Mg.
Задание 4. Составить формулы следующих соединений: оксид азота (I), гидроксид натрия, сульфат бария, оксид магния, хлорид алюминия, дигидрофосфат калия.
Задание 5. Установить соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
|
Формула вещества |
Класс/группа |
|
А) NH4HCO3 Б) KF В) NО |
1) соль средняя 2) оксид кислотный 3) оксид несолеобразующий 4) соль кислая |
Вариант 2
Задание 1. Указать к какому классу принадлежат следующие неорганические соединения, дать им названия по систематической номенклатуре:
CuSO4, NaHS, Mn2O7, B2O3, H2MnO4, Ni(OH)2, H2Se, Sn(OH)2.
Задание 2. Из задания № 1 выпишите формулы солей.
Задание 3. Составить формулы всех возможных оксидов для следующих элементов: C, Al, N, Fe.
Задание 4. Составить формулы следующих соединений: фтороводородная кислота, гидроксид бария, нитрат меди, оксид железа (III), оксид кремния, гидрофосфат натрия.
Задание 5. Установить соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
|
Формула вещества |
Класс/группа |
|
А) CrO3 Б) (CuOH)2CO3 В) (NH4)2HPO4 |
1) основная соль 2) оксид амфотерный 3) оксид кислотный 4) кислая соль |
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Кислотным и основным оксидом являются соответственно:
1) SO2 и MgO 2) CO2 и Al2O3
3) Na2O и FeO 4) ZnO и SO3
4.2. К кислым солям не относится вещество, формула которого:
1) NH4Cl 2) NaHS 3) Ca(HCO3)2 4) NaH2PO4
4.3. К амфотерным оксидам относится: 1) SO3 2) K2O 3) ZnO 4) N2O
4.4. Число гидроксидов среди перечисленных веществ равно:
Н2SO4 , Ni(OH)2 , Fe2(SO4)3 , Zn(OH)2 , SO2 , KOH , NaCl , H3PO4 1) 5 2) 2 3) 3 4) 4
4.5. Основные свойства проявляет высший оксид элемента 1) серы 2) азота 3) бария 4) углерода ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 7
Тема: составление уравнений химических реакций с участием простых и сложных неорганических веществ.
Цель: закрепить и обобщить теоретические и практические знания о неорганических соединениях.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
3. Калькулятор.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Привести примеры неорганических веществ.
1.2 Дать определения понятию «химическая реакция».
1.3 Дать определение понятию «уравнение химической реакции».
1.4 Привести примеры кислот.
1.5 Привести примеры оснований.
1.6 Привести примеры солей.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
ХИМИЧЕСКИЕ СВОЙСТВА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Кислотные оксиды
1. Кислотный оксид + вода = кислота (исключение - SiO2) SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4
2. Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Кислотный оксид + основный оксид = соль CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
1. Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH
2. Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основный оксид + кислотный оксид = соль MgO + CO2 = MgCO3
Амфотерные оксиды
1. Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O ZnO + H2SO4 = ZnSO4 + H2O
2. Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O
(Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4]) Al2O3 + 2NaOH = 2NaAlO2 + H2O
(Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
3. Амфотерный оксид + кислотный оксид = соль ZnO + CO2 = ZnCO3
4. Амфотерный оксид + основный оксид = соль (при сплавлении) ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
1. Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
2. Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O
3. Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O
4. Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
5. Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2 H2S + K2SiO3 = K2S + H2SiO3
6. Кислота + металл (находящийся в ряду напряжений левее водорода)
= соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
1. Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O Be(OH)2 + 2HCl = BeCl2 + 2H2O
2. Амфотерный гидроксид + щелочь = соль + вода (при сплавлении) Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
3. Амфотерный гидроксид + щелочь = соль (в водном растворе) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
1. Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O
2. Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
3. Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4])
4. Щелочь + амфотерный гидроксид = соль (в водном растворе) 2NaOH + Zn(OH)2 = Na2[Zn(OH)4] NaOH + Al(OH)3 = Na[Al(OH)4]
5. Щелочь + растворимая соль = нерастворимое основание + соль Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl
6. Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
1. Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3)
2. Растворимая соль + растворимая соль = нерастворимая соль + соль Pb(NO3)2 + K2S = PbS + 2KNO3СaCl2 + Na2CO3 = CaCO3 + 2NaCl
3. Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
4. Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Образец выполнения задания 1
1) Напишите уравнения реакций, характеризующие химические свойства BeO и HClO4.
BeO – амфотерный оксид, не растворяется в воде, взаимодействует с кислотами и щелочами, а также при сплавлении с основными и твердыми кислотными оксидами:
BeO + 2HCl → BeCl2 + H2O
BeO + 2 NaOH+ H2O → Na2[Be(OH)4]
𝑡
BeO + CaO→ CaBeO2
𝑡
BeO + SiO2→ BeSiO3
2) HClO4 – хлорная кислота проявляет общие химические свойства кислот, т.е. изменяет окраску индикаторов, взаимодействует с основаниями, основными оксидами, амфотерными оксидами и гидроксидами, солями, металлами:
2 HClO4 + Ca(OH)2 → Ca(ClO4)2 + 2 H2O
2 HClO4 + CaO→ Ca(ClO4)2 + H2O
2 HClO4 + ZnO → Zn(ClO4)2 + H2O
2 HClO4 + Zn(OH)2 → Zn(ClO4)2 + 2 H2O
2 HClO4 + CaCO3 → Ca(ClO4)2 + H2O + CO2↑ 2 HClO4 + Zn → Zn(ClO4)2 + H2↑
Образец выполнения задания 2
Запишите молекулярные, полные ионные и сокращенные уравнения реакций.
В молекулярной форме: 2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3
в полной ионной форме — с указанием всех существующих в
растворе ионов: 2Na+ + 2Cl− + Pb2+ + 2NO3− = PbCl2↓ + 2Na+ + 2NO3− в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов: Pb2+ + 2Cl− = PbCl2↓.
Образец выполнения задания 3
Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3л (н.у.), если выход оксида серы (IV) составляет 90%.
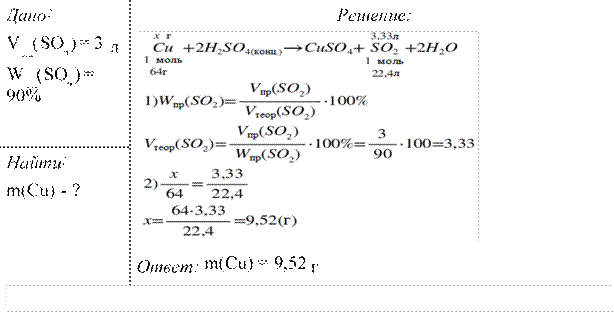
.
Практическая часть
Вариант 1
Задание 1. Написать уравнения реакций, характеризующие химические свойства предложенных веществ. CaO, HNO3.
Задание 2. Привести молекулярные и ионные уравнения тех реакций, которые возможны в растворе.
NaOH + CaCO3 →
CaSO4 + SrCl2 →
(CuOH)2SO4 + HCl → Cu(NO3)2 + H2S → CuCl2 + AgNO3 →
Задание 3 . Решить задачу.
При взаимодействии цинка с соляной кислотой образовался газ объемом 33,6 л. Определить массу цинка, вступившую в реакцию.
Вариант 2
Задание 1. Написать уравнения реакций, характеризующие химические свойства предложенных веществ. CO2, Ba(OH)2.
Задание 2. Привести молекулярные и ионные уравнения тех реакций, которые возможны в растворе.
Cu(OH)2 + Na2SO4 →
Na2SO4 + BaCl2 →
Fe(OH)3 + H2SO4 →
Al(OH)3 + NaOH →
Pb(NO3)2 + H2S →
Задание 3 . Решить задачу.
Сколько грамм оксида магния образуется при сжигании магния массой 12 г.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание; - вывод.
4. Вопросы выходного контроля:
4.1. Привести примеры получения оксидов.
4.2. Объяснить, какими химическими свойствами обладают основные оксиды.
4.3. Привести примеры получения оснований.
4.4. Перечислить основные химические свойства солей.
4.5. Записать способы получения солей
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 8
Тема: номенклатура отдельных классов органических соединений, моделирование их молекул.
Цель: приобрести навыки написания структурных формул изомеров и гомологов, научиться собирать шаростержневые модели молекул органических веществ.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Деревянные стержни.
3. Материал для лепки (пластилин),
4. Набор шаростержневых моделей.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Дать определения следующим понятиям: предельные углеводороды, непредельные углеводороды, структурная формула, изомеры, гомологи, радикалы.
1.2 Назвать общую формулу алканов.
1.3 Назвать общую формулу алкенов.
1.4 Назвать общую формулу алкинов.
1.5 Назвать общую формулу алкадиенов.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Для названия органических соединений используется две номенклатуры: рациональная и современная – систематическая, которую называют также международной или научной (предложена Международным союзом теоретической и прикладной химии IUPAK в 1957, 1965 гг.). Она имеет много общего с женевской номенклатурой, часто встречающейся в химической литературе.
По систематической номенклатуре первые четыре представителя ряда насыщенных углеводородов называются: метан, этан, пропан, бутан. Названия последующих углеводородов образуются из основы греческих числительных и окончания –ан, например С6Н14 – гексан и т.п.
Углеводородными радикалами называются заряженные частицы, полученные при отнятии от молекул предельных углеводородов атомов водорода. Названия однозарядных радикалов производят от названий соответствующих углеводородов, в которых окончание –ан заменяют на – ил.
Гомологический ряд предельных углеводородов и их радикалы
|
углеводород |
радикал |
углеводород |
радикал |
|
Метан СН4 |
Метил СН3- |
Гексан С6Н14 |
Гексил С6Н13- |
|
Этан С2Н6 |
Этил С2Н5- |
Гептан С7Н16 |
Гептил С7Н15- |
|
Пропан С3Н8 |
Пропил С3Н7- |
Октан С8Н18 |
Октил С8Н17- |
|
Бутан С4Н10 |
Бутил С4Н9- |
Нонан С9Н20 |
Нонил С9Н19- |
|
Пентан С5Н12 |
Пентил С5Н11- |
Декан С10Н22 |
Декил С10Н21- |
Общее название предельных углеводородов – алканы, непредельные углеводороды – алкены, алкины, алкадиены.
Названия сложных углеводородов с разветвленной цепью производятся по следующей схеме:
1. Выбираем самую длинную цепь атомов углерода.
2. Нумерацию цепи начинаем с того края, к которому ближе расположен радикал (разветвление) или заместитель.
3. Называем радикалы (заместители) начинаем с простейшего радикала (метил, затем этил и т.д.), если в соединении есть несколько одинаковых радикалов (заместителей), их количество указывается греческими числительными (ди, три, тетра и т.д.)
4. Называем основную углеродную цепь.
Так, соединение 1 2 3 4 5 6
СН3 – СН – СН – СН2 – СН – СН3
| | |
СН3 СН3 С2Н5 называется 2,3-диметил-5-этилгексан.
Практическая часть Вариант 1
Задание 1. Из шаро-стержневого набора смоделировать молекулу этана С2Н6.
Задание 2. Составить формулы:
2,2-дихлорпентан 2-метил-3,3-диэтилгептан
3-метил-4-этилоктан 3,3-диметилпентан
Задание 3. Привести названия алканов:
1)СН3-СН-СН-СН3 2)СН3-СН2-СН2-СН3
| |
СН3 СН3
Задание 4. Привести названия алкенов:
1)СН2=СН-СН3 2)СН3-СН=СН-СН2-СН3
Задание 5. Привести названия алкинов:
1)СН≡С-СН2-СН2-СН2 - СН3 2)СН3-СН2-С≡СН
|
СН3
Задание 6. Привести названия алкадиенов:
1)СН2=С=С- СН3 2)СН3-СН2-СН=С=СН2
|
СН3
Вариант 2
Задание 1. Из шаро-стержневого набора смоделировать молекулу метана СН4.
Задание 2. Составить формулы:
2,3-диметилпентан 1-хлор-2-метилбутан
2,2,4,4-тетраметилпентан 2,4-диметил-3-этилпентан
Задание 3. Привести названия алканов:
1)СН3-СН-СН-СН2- СН3 2)СН3- СН2-СН3
| |
СН3 СН3
Задание 4. Привести названия алкенов:
1)СН2=СН-СН2-СН3 2)СН3-СН2-СН=СН-СН2-СН3
Задание 5. Привести названия алкинов: 1)СН≡С-СН-СН2 -СН3 2)СН3-СН2-С≡С-СН3
|
СН3
Задание 6. Привести названия алкадиенов:
1)СН2=С=С -СН2-СН3 2)СН3-СН2-СН=С=СН-СН3
|
СН3
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Дополнить фразу: «Молекула представляет собой группировку атомов элементов, располагающих в строго определенном порядке, согласно правилам валентности» - отражает суть (выберите ответ):
а) периодического закона;
б) первого положения атомно-молекулярной теории;
в) второго положения теории А.М.Бутлерова;
г) первого положения теории А.М.Бутлерова о строении органических соединений.
4.2. Дополнить фразу: «Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разный порядок расположения атомов в молекуле, т.е. разное строение, а потому, и различные свойства, называются….»(выберите ответ):
а) гомологи;
б) изомерами;
в) радикалами;
г) молекулами;
д) функциональными группами.
4.3. Дополнить фразу: «Формулы СН3-(СН 2) 2 -СН 3 и СН3 СН(СН3)-СН3 отражают строение»(выберите ответ):
а) одного вещества- бутана;
б) двух веществ – н -бутана и изобутана, являющихся изомерами;
в) двух изомеров бутана: н-бутана и 2-метил-пропана;
г) углеводородов ряда метана (одно вещество).
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 9
Тема: составление уравнений и схем химических реакций с участием органических веществ на основании их состава и строения.
Цель: углубить знания о строении, химических свойствах углеводородов и кислородсодержащих веществ; научиться решать цепочки превращений, используя химические свойства веществ и способы их получения.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
3. Калькулятор.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Привести примеры предельных углеводородов.
1.2 Привести примеры непредельных углеводородов.
1.3 Привести примеры кислородсодержащих органических соединений.
1.4 Привести примеры азотсодержащих органических соединений.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
При изучении свойств органических соединений мы часто встречались с примерами взаимопревращений соединений различных классов. Так, с помощью реакции дегидрирования из алкана можно получить алкен, реакцией гидратации алкен превратить в спирт, спирт окислить до альдегида и далее до карбоновой кислоты и т. д. Получается целая цепь превращений веществ, которые объединяет одинаковое число атомов углерода в молекуле.
Генетической связью – называется связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ.
Что же означает понятие «генетическая связь»
1.Превращение веществ одного класса соединений в вещества других классов.
2.Химические свойства веществ.
3.Возможность получения сложных веществ из простых. 4.Взаимосвязь простых и сложных веществ всех классов веществ.
Генетическим ряд веществ – ряд представителей разных классов веществ являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающими общность происхождения этих веществ.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле.
Например:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3 – COOH →CH2Cl – COOH
→NH2CH2COOH
Этан →этен →этаналь → уксусная кислота → хлорэтановая кислота
→ аминоэтановая к-та алкан → алкен →алканол →алканаль→карбоновая кислота →хлоркарбоновая кислота →аминокислота
1. C2H6 → C2H4 + H2 ;
2. C2H4 + H2O → C2H5 OH
3. C2 H5OH + [O] → CH3CHO + H2O;
4. CH3CHO + [O] → CH3COOH
5. CH3COOH + Cl2 → CH2Cl - COOH;
6. CH2Cl - COOH + NH3 → NH2 CH2 – COOH + HCl
Между гомологическими рядами углеводородов существует генетическая связь, которая обнаруживается в процессе взаимного превращения этих веществ.
Для перехода от одной группы веществ к другой используют процессы: дегидрирование, гидрирование, циклообразование и другие.
Так можно осуществить большинство переходов, однако, этот способ получения углеводородов не является универсальным.
Стрелками в схеме указаны углеводороды, которые непосредственно можно превратить друг в друга одной реакцией.
Схематически это выглядит так:
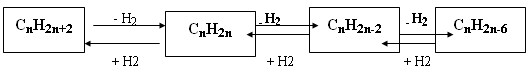
Углеводороды, спирты, альдегиды и карбоновые кислоты генетически связаны между собой. При этом можно проследить постепенное усложнение строения веществ. Перечисленными классами далеко не исчерпывается круг органических соединений. Разнообразные преобразования кислот и других веществ обусловливают появление новых классов и, таким образом, дальнейшее развитие разнообразия органических соединений.
Прослеживая связь веществ в направлении их усложнения, можно заметить, что простейшими первичными «кирпичиками» являются углеводороды, от которых можно перейти к галогенопроизводным, спиртам и т.д.
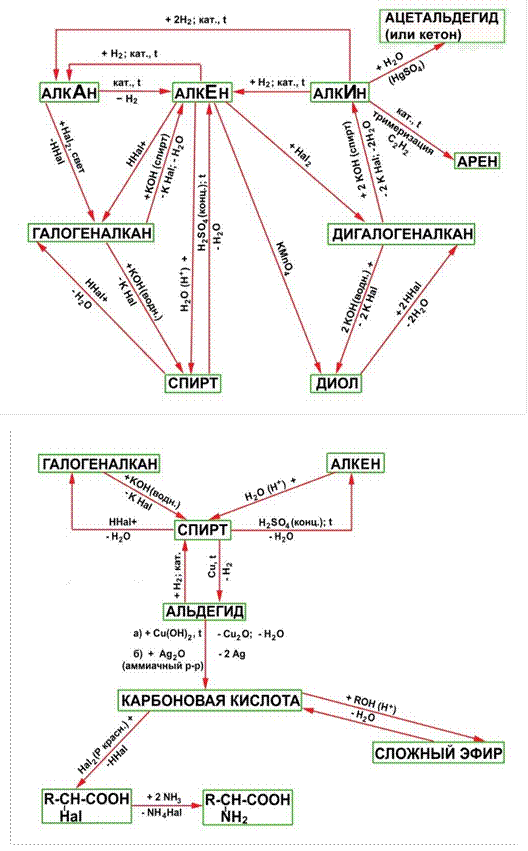
Практическая часть
Вариант 1
Задание 1. Осуществить цепочки химических превращений:
1) CH4 → HCOH → CH3OH → CH3Cl → C2H6
2) Карбид кальция → ацетилен → уксусный альдегид → уксусная кислота → ацетат натрия → метан → ацетилен → бензол → хлорбензол → фенол.
Задание 2. Установить соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
Реагирующие вещества |
Продукт взаимодействия |
|
А) 2-бромпропан и натрий Б) хлорэтан и КОН (спирт.) В) хлорэтан и КОН (водн.) Г) бутен-2 и водород |
1) гексан 2) 2,3-диметилбутан 3) этанол 4) бутан 5) этаналь 6) этен |
Задание 3. Из предложенных веществ состаить 2 генетических ряда:
С2Н2, С3Н8, С2Н4, С2Н6, С4Н10, СН3-СН=СН2, С6Н6, С9Н12, СН4,С2Н5СООН, С3Н4,С2Н5О-ОССН3,C2H5-OH. Задание 4. Решить задачу:
Какой объем хлора (н.у.) необходим для получения из пропана 31,4г.
2-хлорпропана?
Вариант 2
Задание 1. Осуществить цепочки химических превращений:
1) CH4 → C2H2 → CH3-COH → C2H5OH → CH3COOH
2) Этан → бромэтан → бутан → уксусная кислота → ацетат натрия → метан → ацетилен → уксусный альдегид → уксусная кислота → этиловый эфир уксусной кислоты.
Задание 2. Установить соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
Реагирующие вещества |
Продукт взаимодействия |
|
|
А) бутен-1 и вода Б) пропин и водород (изб.) В) пропин и вода Г) циклопропан и бром |
1) пропанон 2) пропан 3) бутанол-1 4) бутанол-2 5) 1,2-дибромпропан 6) 1,3-дибромпропан |
|
|
|
|
|
Задание 3. Из предложенных веществ составить 2 генетических ряда: С2Н2, С3Н8, С2Н4, С2Н6, С4Н10, СН3-СН=СН2, С6Н6, С9Н12, СН4,С2Н5СООН, С3Н4,С2Н5О-ОССН3,C2H5-OH. Задание 4. Решить задачу:
Найти массу воды, необходимой для получения метана из 1,8г. Карбида алюминия.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1. Дать определения понятиям: «генетическая связь», «генетический ряд веществ».
4.2. Объяснить, в чем выражается генетическая связь между углеводородами.
4.3. Перечислить названия реакций, которые встречались при выполнении заданий.
4.4. Объяснить, какая группа веществ лежит в основе большинства генетических цепочек
4.5. Объяснить, какой тип реакций характерен для предельных, а какой для непредельных углеводородов.
4.6. Объяснить, какой вид изомерии характерен для предельных, а какой для непредельных углеводородов
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 10
Тема: решение практико-ориентированных заданий на анализ факторов, влияющих на изменение скорости химической реакции, на применение принципа Ле Шателье.
Цель: углубить и обобщить знания о скорости химической реакции, химическом равновесии, константе равновесия, знать принцип Ле Шателье и уметь применять его для смещения химического равновесия.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Периодическая система химических элементов Д.И.Менделеева.
3. Калькулятор.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
|
1. Входной контроль: |
|
|
1.1 Объяснить, как классифицируются химические реакции тепловому эффекту. |
по |
|
1.2 Объяснить, как классифицируются химические реакции агрегатному состоянию реагирующих веществ. 1.3 Дать определение понятию «гомогенная химическая реакция». 1.4 Дать определение понятию «гетерогенная химическая реакция». |
по |
|
1.5 Объяснить, как классифицируются химические реакции |
по |
обратимости.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Известно, что одни химические реакции протекают за доли секунды, другие – за минуты, часы, сутки. Например, при сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:
ВаС12 + H2SО4 → BaSО4 + 2HC1
Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени.
Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которую обозначают буквой .
Скорость химической реакции () определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени:
![]()
где С1 и С2 − молярные концентрации реагирующих (или обра-
зующихся) веществ в момент времени t1 и t2 соответственно.
Количество вещества в единице объема называют молярной концентрацией; она измеряется в молях на литр (моль/л).
Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции:
1 моль/(л-с); 1 кмоль/(м3мин) и т.д.
Факторы, определяющие скорость химической реакции:
1. Природа реагирующих веществ.
2. Концентрация реагирующих веществ. Увеличение концентрации веществ обусловливает рост скорости реакции.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакций.
Для реакций аА+bB=cC=dD кинетическое уравнение реакции
согласно закону действия масс имеет вид
=k⌈𝑨⌉ 𝒂*⌈𝑩⌉𝒃
где – скорость химической реакции
⌈𝑨⌉ - концентрация вещества А
⌈𝑩⌉ - концентрация вещества В
𝒌 - константа скорости реакции
(𝒂и𝒃) коэффициенты в уравнении реакции.
Если ⌈𝑨⌉ = ⌈𝑩⌉=1 моль/л, то скорость химической реакции равна константе. Константа скорости реакции k зависит от природы реагирующих веществ температуры, но не от концентрации веществ.
Например, напишем кинетическое уравнение для реакции синтеза аммиака
𝑵𝟐(𝒓) + 𝟑𝑯(𝒓) ↔ 𝟐𝑵𝑯𝟑(𝒓)
𝒗 = 𝒌⌈𝑵𝟐⌉ ∗ ⌈𝑯𝟐⌉𝟑
Концентрации твердых веществ в кинетическое уравнения реакции не входят.
3. Температура. Известно, что при нагревании скорость химической реакции увеличивается.
В конце XIX в. голландский химик Я. Вант-Гофф сформулировал правило:
При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 − 4 раза:
![]() ,
,
где 2 - скорость реакции при конечной температуре t2; 1 - скорость реакции при начальной температуре t1.
Величину называют температурным коэффициентом реакции. Его физический смысл заключается в том, что он показывает, во сколько раз возрастает скорость реакции при увеличении температуры на каждые 10 градусов. Именно значение температурного коэффициента для большинства реакций составляет от 2 до 4.
4. Поверхность соприкосновения реагирующих веществ. Скорость гетерогенных реакций, т. е. реакций, протекающих на границе раздела фаз, зависит при прочих равных условиях от свойств поверхности веществ. Например, растертый в порошок мел быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
5. Использование катализаторов.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Большинство химических реакций являются обратимыми.
Обратимыми называются реакции, которые одновременно протекают в прямом и в обратном направлениях.
Например:
𝑯𝟐+𝑰𝟐↔𝟐𝑯𝑰
Состояние обратимой реакции при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является подвижным. При изменении условий оно нарушается. Переход их одного равновесного состояния в другое равновесное состояние называется смещением, или сдвигом равновесия.
Если при изменении условий увеличивается скорость прямой реакции, то говорят смещении равновесия вправо(⟶). Если при изменении условий изменений увеличивается скорость обратной реакции, то говорят о смещении равновесии влево(⟵).
Направление смещения равновесия определяется принципом французского ученого Ле-Шателье:
Принцип Ле–Шателье гласит о том, что если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя концентрацию, температуру или давление, то химическое равновесие сместиться в том направлении, при котором эффект произведённых воздействий будет минимальным.
Влияние концентрации:
✓ при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции (то есть, →)
✓ при уменьшении концентрации исходных веществ, равновесие смещается в сторону обратной реакции (то есть,←)
✓ при увеличении концентрации продуктов реакции, равновесие смещается в сторону обратной реакции (то есть, ←)
✓ при уменьшении концентрации продуктов реакции, равновесие смещается в сторону прямой реакции (то есть, →)
Влияние температуры:
✓ при повышении температуры, равновесие смещается в сторону эндотермической реакции (то есть, – Q)
✓ при понижении температуры, равновесие смещается в сторону экзотермической реакции (то есть, + Q)
Влияние давления:
✓ при увеличении давления, равновесие смещается в сторону меньшего числа молей (необходимо учитывать число молей только газов);
✓ при уменьшении давления, равновесие смещается в сторону большего числа молей (необходимо учитывать число молей только газов).
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2 + Cl2 = 2HCl, была равна 0,06 моль/л. Через 5 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
Дано: Решение:
![]() C1 (Cl2)
= 0,06 моль/л
C1 (Cl2)
= 0,06 моль/л
C2 (Cl2) = 0,02 моль/л
?t = 5 сек
Найти:
V = ?
Ответ: V = 0,008 моль/л.с.
Задача № 2. Как изменится скорость реакции при повышении температуры от 55 до 100?С, если температурный коэффициент скорости этой реакции равен 2,5?
Дано: Решение:
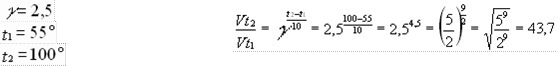
Найти: Ответ:
скорость реакции увеличивается в ![]() 43,7 раза.
43,7 раза.
Задача № 3. При повышении температуры на 30?С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?
Дано: Решение:
![]()
Ответ: температурный коэффициент Найти: скорости реакции равен 4.
![]()
Задача № 4. Запишите кинетическое уравнение для следующих уравнений реакций:
1) S(тв) + O2 (г) = SO2 (г)
2) 2SO2 (г) + O2 (г) = 2SO3 (ж)
Решение:
Согласно закону действующих масс, который действует для газов и жидкостей:
1) υ = к1 C[O2]
2) υ = к2 C2[SO2]·C[O2]
Задача № 5. Синтез оксида азота (II) является эндотермической реакцией. В какую сторону сместится равновесие системы при повышении температуры?
N2+O2 ↔ 2NO-108,5 кДж
Решение:
При повышении температуры равновесие в системе N2-O2-2NO свдигается в сторону образования оксида азота (вправо), поскольку этот процесс идет с выделением теплоты.
Задача № 6. Как будет меняться равновесие в системах с изменением давления?
N2+3H2 ↔ 2NH3
2HBr ↔ H2+Br2 N2O4 ↔ 2NO2 Решение:
В первой реакции из 4 молекул получается 2 - прямая реакция идет с уменьшением давления, обратная - с увеличением давления, поэтому, увеличение давления сместит равновесие системы в сторону прямой реакции, а уменьшение - в сторону обратной;
1) Во второй реакции из 2 молекул получается 2 молекулы - прямая и обратная реакции идут без изменения давления, поэтому, изменение давления не вызовет смещения реакции ни в какую сторону;
2) В третьей реакции из 1 молекулы получает 2 - прямая реакция идет с увеличением давления, обратная - с уменьшением, поэтому, увеличение давления сместит равновесие системы в сторону обратной реакции, а уменьшение - в сторону прямой.
Практическая часть
Вариант 1
Задание 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2 + Cl2 = 2HCl, была равна 0,01 моль/л. Через 10 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
Задание 2. Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30 градусов.
Задание 3. Температурный коэффициент реакции равен 2. На сколько градусов нужно увеличить температуру реакции, чтобы ее скорость увеличилась в 8 раз?
Задание 4. Определить как измениться скорость химической реакции синтеза аммиака 𝑁2(г)+3𝐻(𝑟) ⟺ 2𝑁𝐻3(𝑟) при увеличении концентрации исходных веществ в 2 раза.
Задание 5. Уксусная кислота сгорает по уравнению:
СН3СООН + 2О2↔ 2СО2+ 2Н2О +Q
Как изменится химическое равновесие в системе при повышении давления?
1) сместится в сторону прямой реакции
2) сместится в сторону обратной реакции
3) равновесие не сместится
Задание 6.Карбонат кальция разлагается по уравнению:
CaСО3(тв)↔ СаО(тв) + СО2(г) – Q
Как изменится химическое равновесие в системе при повышении температуры?
1) сместится в сторону прямой реакции
2) сместится в сторону обратной реакции
3) равновесие не сместится
Вариант 2
Задание 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2 + Cl2 = 2HCl, была равна 0,05 моль/л. Через 20 сек концентрация хлора составила 0,1 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
Задание 2. Температурный коэффициент реакции равен 2. Во сколько раз увеличится скорость реакции при увеличении температуры на 40 градусов.
Задание 3. На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 27 раз. Температурный коэффициент равен 3.
Задание 4. Определить как измениться скорость химической реакции синтеза аммиака 𝑁2(г)+3𝐻(𝑟) ⟺ 2𝑁𝐻3(𝑟) при уменьшении концентрации исходных веществ в 2 раза.
Задание 5. Уксусная кислота сгорает по уравнению:
СН3СООН + 2О2↔ 2СО2+ 2Н2О +Q
Как изменится химическое равновесие в системе при понижении давления?
1) сместится в сторону прямой реакции
2) сместится в сторону обратной реакции
3) равновесие не сместится
Задание 6. Карбонат кальция разлагается по уравнению:
CaСО3(тв)↔ СаО(тв) + СО2(г) – Q
Как изменится химическое равновесие в системе при понижении температуры?
1) сместится в сторону прямой реакции
2) сместится в сторону обратной реакции
3) равновесие не сместится
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4.1.Объяснить, как влияет поверхность соприкосновения реагирующих веществ на скорость реакции.
4.2.Охарактеризовать роль катализатора в химической реакции.
4.3.Назвать тип реакции, протекающей в присутствии катализатора.
4.4. Охарактеризовать влияние температуры на скорость химической реакции.
4.5. Аммиак образуется по уравнению: N2(г) + 3Н2(г) ↔2NН3(г) + Q
Объяснить, как изменится химическое равновесие в системе при понижении давления?
1) сместится в сторону прямой реакции; 2) сместится в сторону обратной реакции; 3) равновесие не сместится.
ИНСТРУКЦИЯ К ВЫПОЛНЕНИЮ ПРАКТИЧЕСКОЙ РАБОТЫ № 11
Тема: решение задач на приготовление растворов заданной концентрации.
Цель: углубить и обобщить знания о растворах, способах выражения их концентрации, освоить расчеты и методику приготовления растворов определенной концентрации.
Методическое и материально-техническое обеспечение:
1. Инструкция к практической работе.
2. Таблица растворимости.
3. Калькулятор.
Ход работы:
1. Входной контроль.
2. Получение задания.
3. Выполнение задания.
4. Оформление отчета.
5. Сдача отчета преподавателю.
1. Входной контроль:
1.1 Объяснить, что такое раствор, из каких компонентов он состоит.
1.2 Привести примеры газообразного, жидкого и твердого раствора.
1.3 Дать определение понятиям: растворитель, растворенное вещество.
1.4 Объяснить, как определить массу раствора, зная массу растворенного вещества и массу растворителя.
1.5 Объяснить, как определить массу раствора, зная его плотность и объем.
2. Получение задания и изучения его содержания:
2.1 Ознакомьтесь с краткими теоретическими сведениями.
2.2 Выполните задание в соответствии с вариантом.
2.3 Сделайте вывод к практической работе.
2.4 Ответьте на вопросы выходного контроля.
Теоретическая часть
Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и растений, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном, жидком и твердом агрегатных состояниях.
Масса раствора может быть вычислена по формуле:
mp-pa= mp.в. + mp-ля
Для выражения состава раствора используют количественные характеристики растворов или концентрации. Существуют разные способы выражения концентрации растворов:
1. Массовая доля растворенного вещества ()
= mр.в./ mр-ра ·100%,
где mр.в - масса растворенного вещества, mр-ра – масса раствора, г.
Массовая доля растворенного вещества, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора, (измеряется в %, поэтому ее называют процентная концентрация).
Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %).
2. Молярная концентрация (См)
См = nв-ва/Vр-ра = m в-ва / М·Vр-ра
где m – масса растворенного вещества, г; М – молярная масса, г/моль; V - объем раствора, мл.
Молярная концентрация вещества показывает количество моль вещества в 1л раствора, (измеряется в моль/л).
Например, См =1моль/л = 1М (одномолярный раствор)
Решение задач с изменением концентрации растворов
При решении задач с изменением концентрации растворов необходимо помнить, что характеристики (m, V, и пр.) даны для разных растворов: исходного и полученного.
Важно не перепутать эти характеристики между собой. Поэтому рекомендуется обозначать растворы цифрами 1,2,3 и ставить соответствующие индексы у величин.
Например, масса первого раствора будет записана так: m1р-ра, а массовая доля вещества во втором растворе: 2.
Если решение таких задач вызывает у вас трудности, то попытайтесь себе представить этот процесс (упаривание, разбавление, и пр.) с помощью схематичного рисунка.
Решение задач на упаривание растворов
При решении данного типа задач, следует помнить, что в большинстве случаев испаряется вода, и, следовательно, уменьшается масса полученного раствора. Масса вещества, как правило, остается неизменной.
Решение задач на концентрирование растворов (добавление вещества)
При решении таких задач важно понимать, что при добавлении вещества концентрация раствора увеличивается, то есть масса вещества в полученном растворе = масса вещества в исходном растворе + масса добавленного вещества.
Решение задач на разбавление растворов
При решении задач данного типа следует помнить, что масса растворенного вещества остается неизменной, изменяется лишь масса растворителя и, соответственно, масса всего раствора.
Практическая часть
Вариант 1
Задание 1. Сколько граммов хлорида натрия требуется для приготовления раствора массой 300г с массовой долей NaCl 10%?
Задание 2. Сколько граммов карбоната калия содержится в 0,2М растворе объемом 250мл?
Задание 3. Какой объем газа образуется при взаимодействии 250г 30% раствора серной кислоты с цинком?
Задание 4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 27г Na2CO3.
Задание 5. Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
Вариант 2
Задание 1. Сколько граммов хлорида бария требуется для приготовления раствора массой 500г с массовой долей ВаCl210%?
Задание 2. Сколько граммов карбоната натрия содержится в 0,5М растворе объемом 250мл?
Задание 3. Какой объем газа образуется при взаимодействии 500г 70% раствора серной кислоты с магнием?
Задание 4. Сколько граммов NaCl и воды нужно взять, чтобы приготовить 300г физиологического раствора, массовая доля соли в котором составляет 0,9%
Задание 5. К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе.
3. Оформление отчета:
Отчет должен содержать:
- тему работы; - цель работы; - задание;
- вывод.
4. Вопросы выходного контроля:
4. 1.Объяснить, какие существуют способы выражения концентрации раствора?
4.2. Объяснить, как определить массовую долю растворенного вещества, в каких единицах она выражается?
4.3. Объяснить, какой раствор называется молярным.
4. 4.Объяснить, каким образом можно перевести ненасыщенный раствор в насыщенный раствор.
4.5. Вычислить массовую долю вещества в 200 г раствора, образованного при растворении 40 г соли в воде.
Приложение А
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГБПОУ «ГОРЛОВСКИЙ КОЛЛЕДЖ ГОРОДСКОГО ХОЗЯЙСТВА»
Химия
гр. ___________________
ОТЧЕТЫ
ПО ПРАКТИЧЕСКИМ РАБОТАМ
Студент_____________________
(ФИО)
Преподаватель_______________
(ФИО)
Зачет_____________________
(зачтено)
Дата________________________
Горловка, 20__ г.
|
№ практической работы |
Название практической работы |
Оценка |
Дата |
Подпись преподавателя |
|
|
|
|
|
|
|
|
|
|
|
Приложение Б
|
|
||
|
|
|
|
|
|
76 |
Химия.1.2.ТГ-1А. ПР 01 |
Лист |
|
|
|
|
|
|
1 |
||
|
Изм. |
Лист |
№ докум. |
Подпись |
Дата |
|||
© ООО «Знанио»
С вами с 2009 года.
![]()

