
5- тақырып. Термодинамиканың негізгі функциялары.
1 Химиялық тепе – теңдік туралы түсінік
![]()
![]() (3.1)
(3.1)
мұндағы ![]() – реакция
реагенттерінің тепе – теңдік концентрациялары, a, b, c, d – стехиометриялық
коэффициенттер, Kc – химиялық тепе–теңдік
константасы.
– реакция
реагенттерінің тепе – теңдік концентрациялары, a, b, c, d – стехиометриялық
коэффициенттер, Kc – химиялық тепе–теңдік
константасы.
Газтәріздес заттар арасындағы реакция үшін тепе-теңдік константасын есептеуде, егер газдарды идеал десек, тепе-теңдік концентрация орнына газдардың парциальды қысымын пайдалануға болады. Бұл кезде химиялық тепе–теңдік константасы Kр арқылы белгіленеді.
Берілген қайтымды химиялық реакция үшін егер реагенттер газ десек, химиялық тепе – теңдік константасы келесідей тәуелділікті көрсетеді:
![]() (3.2)
(3.2)
мұндағы ![]() – реакция
реагенттерінің тепе-теңдіктегі парциаль қысымдары, a, b,
c, d – стехиометриялық коэффициенттер, Kр – химиялық
тепе–теңдік константасы.
– реакция
реагенттерінің тепе-теңдіктегі парциаль қысымдары, a, b,
c, d – стехиометриялық коэффициенттер, Kр – химиялық
тепе–теңдік константасы.
Егер әрекеттесуші заттардың концентарциялары мольдік үлеспен (%), ал газдар – көлемдік үлеспен (%) есептелінсе, онда:
![]() (3.3)
(3.3)
Тепе–теңдік константасы әрекеттесуші заттар табиғатынан, температурадан тәуелді, концентрациядан, активтіліктен, қысымнан тәуелсіз. Kc, Kр, KN –реагентердің моль сандары өзгере жүретін реакциялар үшін өлшемсіз шамалар. Басқа жағдайларда:
Kр – қысым өлшемімен,
Kc – Dn дәрежедегі концентрация өлшемімен өрнектеледі. Dn – стехиометриялық коэффициенттердің алгебралық қосындыларының айырымы:
![]() ( өнім) -
( өнім) -![]() (баст. зат) =
(баст. зат) = ![]()
Kc және Kр келесідей байланыста:
![]() (3.4)
(3.4)
2 Химиялық реакцияның изотерма теңдеуі
Химиялық тепе–теңдік константасы стандартты жағдайда химиялық реакцияның DG және DF шамаларымен байланысты:
![]() (3.5)
(3.5)
![]() (3.6)
(3.6)
Әрекеттесуші заттардың берілген концентрациялары немесе парциал қысымдарындағы химиялық реакцияларда DG және DF өзгерістерін химиялық реакцияның изотерма теңдеуі арқылы есептеуге болады.
![]() (3.7)
(3.7)
 (3.8)
(3.8)
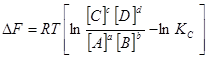 (3.9)
(3.9)
Бұл теңдеулер (3.8), (3.9) химиялық реакцияның изотерма теңдеулері. (3.8) – теңдеуі изобаралы – изотермиялық процесс үшін, (3.9) – изохоралы – изотермиялық үшін. Көрсетілген теңдеулер термодинамикалық потенциалдар DG, DF өзгеруі мен химиялық тепе – теңдік константалар Kр, Kc арасындағы тәуелділікті көрсетеді. Химиялық реакция изотерма теңдеулері бойынша берілген жағдайда Гиббс және Гельмгольц энергиялар өзгерісін есептеуге, процестің өздігінен өту бағытын анықтауға болады.
Егер ![]()
Химиялық
реакция изотерма теңдеуінен Гиббс энергиясының мәні
және таңбасы ![]() және
және ![]() салыстырмалы
мәндерінен тәуелді екенін көруге болады. (
салыстырмалы
мәндерінен тәуелді екенін көруге болады. (![]()
![]() ) Егер
) Егер
![]() <
< ![]() болса,
болса, ![]() < 0
< 0
(3.8) теңдеуге сәйкес реакция өздігінен солдан оңға қарай өтеді.
![]() >
> ![]()
![]() > 0
> 0
(3.8) теңдеуге сәйкес реакция өздігінен кері бағытта (оңнан солға) өтеді.
![]()
![]()
реакция тепе – теңдік күйде.
3 Тепе – теңдік константасының температурадан тәуелділігі. Изобара және изохора теңдеулері
Температураны жоғарлату тепе– теңдікті эндотермиялық реакция(жылу сіңіру) өту бағытына қарай ығыстырады.
Температураны төмендету тепе – теңдікті экзотермиялық реакция (жылу бөлу) бағытына қарай ығыстырады. Мысалы аммиактың синтезделу реакциясы үшін:
N2 + 3H2 Û2NH3+ 92,3 кДж
Температураны арттыру тепе – теңдікті солға (себебі DН > 0 ), ал төмендету – оңға (себебі DН < 0) ығыстырады.
Температура өзгерісінің тепе– теңдік константасына әсерін сандық жағынан изобара және изохора теңдеулері көрсетеді.
Химиялық реакцияның изобара теңдеуі р = соnst.
![]() (3.10)
(3.10)
Химиялық реакцияның изохора теңдеуі V =const.
![]() (3.11)
(3.11)
Изобара және изохора теңдеулері реакция бағытын анықтауға, тепе – теңдік константасының температурадан тәуелділігін бағалауға мүмкіндік береді.
![]() және
және ![]() шамаларын химиялық
тепе – теңдік константасы логарифмінің температуралық
коэффициенті дейді. Тепе–теңдік константасының температурадан
тәуелділігі химиялық реакцияның жылу эффектісі таңбасы
мен мәнімен анықталады.
шамаларын химиялық
тепе – теңдік константасы логарифмінің температуралық
коэффициенті дейді. Тепе–теңдік константасының температурадан
тәуелділігі химиялық реакцияның жылу эффектісі таңбасы
мен мәнімен анықталады.
Егер DН < 0, Т – ның өсуімен Kр кемиді;
DН
> 0, Т – ның өсуімен Kр ![]() артады;
артады;
DН = 0, Kр температурадан тәуелсіз
Теңдеуді Т1 - ден Т2 аралығында
интегралдасақ:![]()
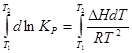
 (3.12)
(3.12)
![]() ,
,
![]() – Т1 және Т2 температурадағы тепе – теңдік
константалары.
– Т1 және Т2 температурадағы тепе – теңдік
константалары.
Егер химиялық реакцияның жылу эффектісі және қандай да бір температурадағы тепе – теңдік константасы белгілі болса, соңғы теңдеу арқылы басқа температурадағы тепе – теңдік константасын есептеуге болады.
4 Газ фазасында өтетін реакциялар тепе – теңдігіне қысымның әсері
Моль сандары өзгерісіз өтетін реакциялар.
А + В Û 2АВ
![]() (3.13)
(3.13)
Қысым тепе – теңдіктің ығысуына әсер етпейді
Моль сандары артатын реакциялар.
АВ Û А + В
![]() (3.14)
(3.14)
Моль сандары арта жүретін реакциялар үшін қысымды жоғарлату тепе – теңдікті солға ығыстырады.
Моль сандары кемитін реакциялар.
А + 2В Û 2АВ
 (3.15)
(3.15)
Моль сандары кеми жүретін реакциялар үшін қысымды жоғарлату тепе – теңдікті оңға ығыстырады.
5 Реакция реагенттер концентрацияларының тепе – теңдікке әсері
Егер тепе – теңдік күйдегі жүйеге реагент немесе соңғы өнім енгізсек, тепе – теңдік сол компоненттің концентрациясы кемитін бағытқа қарай ығысады. Мысалы:
CН3СOOH+C2H5OHÛ CН3СOOC2H5+H2O
Егер CН3СOOH, C2H5OH енгізсек, тепе – теңдік оңға, ал CН3СOOC2H5 – солға ығысады.
Тепе – теңдік күйдегі қоспадан реакция компоненттерінің біреуін алып кету, тепе – теңдікті сол өнімнің қосымша түзілу бағытына қарай ығыстырады.
CН3СOOH, C2H5OH алып отыру тепе – теңдікті солға, CН3СOOC2H5 – оңға ығыстырады.
Есептер
Келесі реакциялар үшін Kp өрнектеңіз.
|
№ |
Реакциялар |
|
1 |
2SO2 (г) + O2 (г ) Û SO3 (г) |
|
2 |
ZnO (қ) + H2 (г) Û Zn (қ) + H2O (г) |
|
3 |
H2 (г) + CO2 (г) Û CO (г) + H2O (г) |
|
4 |
4NH3 (г) + 3O2 (г) Û 2N2 (г) + 6H2O (г) |
|
5 |
NH4NO3 (қ) Û N2 (г) + 2 H2O (г) |
|
6 |
2H2S (г) + 3O2 (г) Û 2H2O (г) + 2SO2 (г) |
|
7 |
2NO2 (г ) Û 2NO (г) + O2 (г) |
|
8 |
2HI (г) Û H2 (г ) + I2 (г) |
|
9 |
S ( тв ) + O2 (г) Û SO2 ( г ) |
|
10 |
H2( г ) +Cl2 (г ) Û 2HCl ( г ) |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.