Урок химии на тему "Железо и его соединения". 9-й класс
Цель: систематизировать знания о важнейших соединениях железа +2 и +3, качественных реакциях на ионы железа +2 и +3, биологической роли железа, используя опорные знания о строении железа, лабораторную работу, мультимедийное приложение.
Задачи:
Образовательные:
· систематизировать знания о характере оксидов и гидроксидов со степенями окисления +2 и +3 на примере оксидов и гидроксидов железа +2 и +3.
· формировать умения сравнивать свойства важнейших соединений железа(II) и железа(III), научиться определять с помощью качественных реакций соединения, содержащие ионы Fe2+, Fe3+
· совершенствовать навыки работы с реактивами при выполнении опытов, соблюдать правила по ТБ.
· раскрыть значение железа в природе и жизни человека.
Развивающие:
Продолжить развитие:
· мыслительных способностей: умения пользоваться опорными знаниями, умения сравнивать, обобщать, делать выводы, объяснять ход эксперимента;
· навыков самостоятельности при работе с учебником, инструктивной картой и реактивами;
· исследовательских навыков при исследовании свойств соединений железа(II) и железа (III) и проведении качественных реакций;
· способности к рефлексии, коммуникативные умения.
· развивать умения работать в атмосфере поиска, творчества, дать каждому обучающемуся возможность достичь успеха; умение давать самооценку деятельности на уроке.
Воспитательная:
Продолжить воспитание:
· положительной мотивации обучения, используя привлечение учащихся к подготовке занимательных опытов, сообщений о роли железа, лабораторной работы, мультимедийного сопровождения;
· чувство ответственности при подготовке сообщений, выполнения домашнего задания;
· правильной самооценки.
Тип урока: Комбинированный. Сообщение новых знаний и их совершенствование.
Планируемые результаты:
· повышение уровня активности школьников и качества знаний;
· интеграция между предметами различных образовательных областей;
· развитие самостоятельной познавательной деятельности, критического мышления, навыков работы в группе;
· умения проводить исследование, приобретать и анализировать знания из различных источников информации;
· систематически и чётко излагать свои мысли, сформулировать проблему и наметить пути ее решения.
Формы работы учащихся:
изучение материала, формулирование вопросов по теме урока, выполнение практических опытов, фиксирование в тетради уравнений реакций и выводов по уроку, выполнение тренажерных заданий, осуществление самоконтроля по оцениванию уровня усвоения своих знаний.
Оборудование: Мультимедийный проектор, компьютер, классные тетради; карточки для рефлексии;
периодическая система химических элементов Д. И. Менделеева, таблица растворимости веществ, инструктивные карты к лабораторной работе, тесты, презентация “Соединения железа”, коллекция минералов: красный железняк, бурый железняк, магнитный железняк, железный колчедан.
по 2 пробирки, хлорид железа (II), хлорид железа (III), роданид калия, красная кровяная соль (гексацианоферрат (III) калия);
- карточки для составления плана урока: местоположение Fe в Периодической системе, строение атома, физические свойства, химические свойства, природные соединения железа, качественные реакции Fe+2, Fe+3, биологическое значение;
- магнитики для прикрепления к доске;
Методы обучения: словесно-наглядно-практический с использованием ЭОР, частично-поисковый, лабораторные опыты в том числе используя ЭОР, катехизисный диалог, создание проблемной ситуации, объяснение с элементами беседы.
ВОПРОС и ОТВЕТ - мыслительная и
языковая структура, которая опосредованно функционирует
в основаниях всякой осмысленной человеческой деятельности. Человек разумный -
это прежде всего человек вопрошающий и отвечающий…
Вопросно-ответная (катехизисная) форма изложения философских идей
присуща древнегреческой философии...
Ход урока
I. Организационный момент (1 мин). Приветствие: Добрый день. Мы сегодня принимаем гостей у себя на уроке. Добро пожаловать.
II. Актуализация знаний (10 мин).
Учитель. А вы знаете, что герою знаменитого романа Даниэля Дефо повезло? И повезло трижды! Во-первых, Робинзон остался жив во время кораблекрушения. Во-вторых, корабль, потерпевший крушение, сидел на мели совсем недалеко от острова. Робинзон сумел погрузить на плот все необходимое и благополучно переправился на остров. Но ему повезло еще раз. Он пишет: «После долгих поисков я нашел ящик нашего плотника, и это была для меня поистине драгоценная находка, которой я не отдал бы тогда за целый корабль с золотом…»
Что же было в плотницком ящике? Да, обыкновенный железный инструмент: топор, пила, молоток, гвозди.
1. Объявление темы, постановка цели. И так, мы продолжаем изучать железо. Из предложенных карточек составить на доске с помощью магнитиков «дерево познания» как кластер работы по теме урока: ЖЕЛЕЗО (ствол), местоположение Fe в Периодической системе, строение атома, физические свойства, химические свойства, природные соединения железа, качественные реакции Fe+2, Fe+3, биологическое значение, применение.
Учитель. Какой материал мы еще не познали, для полной характеристики элемента?
Планируемый ответ. Природные соединения железа, качественные реакции Fe+2, Fe+3, биологическое значение, применение.
Учитель: А для дальнейшего изучения нам необходимо повторить те сведения о железе, которые вы приобрели на прошлом уроке.
2. Индивидуальный опрос.
Цель: повторение изученного материала, необходимого для открытия “нового знания” и выявления затруднений в работе учащихся.
1-й
ученик. Написать
на доске схему строения атома железа, электронную и графическую формулы. Какие
степени окисления может проявлять железо? Окислитель или восстановитель?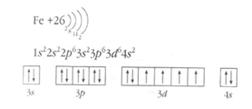
Планируемый ответ: (схема строения атома железа, электронная формула), +2, +3. Железо, как и все металлы в химических реакциях выступает в роли восстановителя.
Проверка. (Презентация. Слайд 2)
2-й ученик. Написать на доске уравнения реакций взаимодействия железа с простыми веществами: хлором, серой, кислородом. Расставить степени окисления, уравнять методом электронного баланса.
Планируемый ответ: 2Fe +3CL2 → 2FeCL3
Fe + S → FeS
3Fe + 2О2 → Fe3O4 (FeO · Fe2O3)
Проверка (Слайд 3)
3-й ученик. Написать уравнения реакций взаимодействия железа со сложными веществами: с растворами кислот, солей, водой при нагревании. Для одной из реакций ионного обмена написать полное и сокращенное ионное уравнение.
Планируемый ответ: Fe + 2HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
3Fe + 4H2O → Fe3O4 (FeO · Fe2O3) + 4H2 (Слайд 4)
4-й ученик. Рассказать о распространенности железа в земной коре. (сообщение ученика)
5-й ученик. “Значение железа” (сообщение ученика)
Биохимики раскрывают огромную роль железа в жизни растений, животных и человека. Входя в состав гемоглобина, железо обуславливает красный цвет этого вещества, от которого, в свою очередь, зависит цвет крови. В организме взрослого человека содержится 3 г железа, из них 75% входят в состав гемоглобина, благодаря которому осуществляется важнейший биологический процесс - дыхание. Железо необходимо и для растений. Оно участвует в окислительных процессах протоплазмы, при дыхании растений и в построении хлорофилла, хотя само и не входит в его состав. Железо издавна применяется в медицине для лечения малокровия, при истощении, упадке сил. Железо - основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений, например, башня Эйфеля или железнодорожные мосты. Все, все - начиная от швейной иглы, гвоздя, топора и кончая паутиной железных дорог, плавающими крепостями - авианосцами и линкорами - и огнедышащими домнами, где рождается само железо, - состоит из железа. Железо - это металл созидания!
6-й ученик. Биологическая роль железа
Санаторий «Марциальные воды»В 55 км от Петрозаводска в лесной зоне, где находится долина железистых минеральных источников и лечебных грязей, создан Первый в России курорт "Марциальные воды", открытый Петром I.Воды источников курорта уникальны, поскольку по содержанию железа превосходят все известные местности с железистыми минеральными водами у нас и за рубежом. На курорте «Марциальные воды» железистые воды с успехом применяются для лечения больных железодефицитными анемиями («малокровием»), с заболеваниями пищеварительной системы (хроническим гастритом, холециститом). Полезна вода при некоторых болезнях почек. Кроме того, марциальная вода содержит кальций, магний, натрий, марганец и успешно применяется у больных сердечно-сосудистыми заболеваниями, заболеваниями обмена веществ, у лиц, подвергшихся воздействию радиационных катастроф. Применяемые внутрь минеральные воды являются поистине богатырским источником здоровья.
Проверка задания у доски.
III. Изучение нового материала. (20 мин)
Цель: на основе имеющихся знаний о металлах подготовить учащихся к восприятию новых знаний о соединениях железа.
1. Учитель: Железо дает два ряда соединений, соответствующих степени окисления +2, +3. Степень окисления Fe зависит от окислительной способности реагирующего вещества. У сильных окислителей железо принимает степень окисления +3, у более слабых +2.
Ученики записывают схему в тетрадь. (Слайд 6)
![]()
![]()
![]() Fe
Fe
+2 +3
S, Cu2+, HCI (р), H2SO4 (р) CI2, HNO3
+2, +3
O2, H2O
2. Генетические ряды соединений железа(II) и железа(III).
Первичное закрепление знаний. Из приведенных формул составить схемы генетических рядов: (Конструирование схем из приведенных формул.) (Слайд 14)
|
FeCI2 |
Fe |
FeCI3 |
|
Fe(OH)2 |
Fe3O4 |
Fe(OH)3 |
|
FeO |
FeSO4 |
Fe2O3 |
3. Соединения железа.
Учитель: Железо – второй по распространенности металл в земной коре. В природе встречается в виде оксидов и сульфидов. Железо в природе находится в виде соединений: руд и минералов, а самородное железо встречается очень редко.
4. Коллекция минералов и образцы веществ. Среди предложенных образцов выбрать важнейшие руды железа и назвать их.
5. Получение железа. Вспомните способы получения металлов. Как можно получить железо из его соединений? (Сообщение учащихся)
Учитель: Оксид и гидроксид железа (II) проявляют основные свойства. А оксид и гидроксид железа ((III) проявляют слабовыраженный амфотерный характер. Для изучения свойств, проведем лабораторные опыты. Для этого вспомним правила ТБ. На столах у вас есть инструктивные карточки для проведения опытов. Обратите внимание иллюстрации правил ТБ.
Лабораторный опыт 1. Получение гидроксида железа(II) и гидроксида железа(III) (Приложение 1) (Выполняют по инструкции в группах.)
Получить гидроксиды железа в лаборатории можно взаимодействием солей железа со щелочью.
а) Налейте в пробирку 1 мл раствора хлорид железа(II). Добавьте к нему по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка. Записать уравнения реакций.
б) К хлориду железа(III) прилейте по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка.
Что наблюдаете? Записать уравнения реакции.
Слайд 6 – уравнение реакций (самопроверка)
|
FeCI2 + 2NaOH = Fe(OH)2↓
+ 2NaCI |
FeCI3 + 3NaOH
= Fe(OH)3↓ + 3NaCI |
Вывод: Получить гидроксиды железа в лаборатории можно взаимодействием солей железа со щелочью. Fe(OH)2↓ осадок светло-зеленого цвета. Fe(OH)3 бурый осадок. Это один из способов распознавания соединений железа с различной степенью окисления, качественные реакции на ионы Fe2+ Fe3+.
Учитель: Fe(OH)2 окисляется на воздухе: сначала зеленеет, потом приобретает бурую окраску.
(Демонстрация разрезанного яблока и пробирки с Fe(OH)2, на стенках которой видно как осадок становится бурого цвета.)
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (Слайд 8)
Качественные реакции на ионы железа.
Учитель: Качественные реакции – реакции, с помощью которых распознаются различные вещества.
Качественные реакции, как правило, протекают с каким - либо ярким внешним эффектом.
Существуют и другие качественные реакции, позволяющие распознать соли железа с различными степенями окисления. Посмотрите сценку.
Лабораторный опыт 2. (Приложение 1)
Качественная реакция на ион Fe3+
1. Реактив – роданид калия KSCN.
К раствору хлорида железа(III) добавить одну каплю раствора роданида калия (KSCN). Перемешайте содержимое пробирки и рассмотрите на свету. Отметьте цвет.
Результат воздействия – интенсивно красный цвет
FeCl3 + 3KSCN = Fe (SCN)3 + 3KCl.
2. Реактив – желтая кровяная соль K4 [Fe(CN)6]
г) К раствору хлорида железа(III) Во 2-ю пробирку добавьте 1–2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6] (желтой кровяной соли). Перемешайте содержимое пробирки, отметьте цвет.
Результат воздействия – синий осадок берлинской лазури.
K4 [Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6]
Вывод:
- Реактивами на ионы Fe3+ являются щелочи, роданид калия и желтая кровяная соль K4[Fe(CN)6].
Лабораторный опыт 3.
Качественная реакция на ион Fe2+.
Реактив – красная кровяная соль K3[Fe(CN)6].
Налейте в пробирку 1 мл раствора хлорида железа(II). Добавьте к нему по каплям раствор осадка. гексацианоферрата(III) калия K3[Fe(CN)6] (красной кровяной соли). Отметьте цвет осадка.
Результат воздействия – синий осадок (турнбулевой сини)
FeCI2 + K3[Fe(CN)6] = 2КCI + KFe[Fe(CN)6]↓
Вывод:
- Реактивами на ионы Fe2+ являются щелочи и красная кровяная соль K3[Fe(CN)6].
Учащиеся записывают уравнения качественных реакций в тетради и выводы. (Слайд 9)
7. Обобщение по опросу. (Фронтальный опрос )
1. Учитель. Я читаю утверждения, если вы считаете его правильным, то поднимаете правую руку, если неправильным, то левую.
1. В соединениях железо проявляет степень окисления только +2.
2. В соединениях железо проявляет степень окисления только +2 и +3.
3. Характер оксида и гидроксида железа со степенью окисления +2 oсновный.
4. Характер оксида и гидроксида железа со степенью окисления +3 кислотный.
IV. Закрепление (2 мин)
Цель: зафиксировать изученное содержание.
Ребята, давайте еще раз повторим и закрепим, что мы сегодня изучили.
Формы и способы организации учебной деятельности (по “цепочке” учащиеся повторяют все вопросы этого урока, используя слайды презентации учителя)
Беседа:
1. В каких случаях
образуются соединения железа(II)?
Планируемый ответ: При действии на железо слабых окислителей,
например, растворов кислот (кроме HNO3), солей и простых веществ,
например, серы.
2. А как можно
получить соединения железа(III)?
Планируемый ответ: При действии сильных окислителей на железо,
например, галогенов, раствора азотной кислоты.
3. Почему концентрированные азотную и серную кислоты можно перевозить в железной таре? Планируемый ответ: они пассивируют железо и реакции с ними не происходит.
4. Перечислите, какие соединения образует железо со степенью окисления +2. Планируемый ответ: Fe(OH)2 FeO FeCI2
5. Каков характер оксида и гидроксида железа(II)? Планируемый ответ: Оксид и гидроксид железа(II) проявляют oсновный характер.
6. Перечислите формулы соединений железа со степенью окисления +3. Планируемый ответ: Fe2O3 Fe(OH)3 FeCI3
7. Каков характер оксида и гидроксида железа(III)? Планируемый ответ: Оксид и гидроксид железа(III) проявляют амфотерный характер.
8. Как можно получить гидроксиды железа? Планируемый ответ: Получить гидроксиды железа в лаборатории можно взаимодействием солей железа со щелочью.
9. По каким признакам можно распознать осадки гидроксида железа(II) и гидроксида железа(III)? Планируемый ответ: Распознать осадки можно по цветам: Fe(OH)2↓ осадок светло-зеленого цвета. Fe(OH)3 бурый осадок.
10. При помощи каких качественных реакций можно распознать соли железа(II) и соли железа(III)? Планируемый ответ: Реактивами на ионы Fe3+ являются щелочи, роданид калия и желтая кровяная соль K4[Fe(CN)6]. Реактивами на ионы Fe2+ являются щелочи и красная кровяная соль K3[Fe(CN)6].
V. Самооценка. Выполнение проверочного теста с последующей проверкой (тест на отдельных карточках). (5 мин)
- При взаимодействии, с какими веществами железо образует соединения со степенью окисления +2?
А) СI2 Б) S В) HNO3
- С какими из веществ реагирует железо?
А) О2 Б) Na2O В) СО2
- Какова электронная формула атома железа?
А) 2е, 8е, 9е, 7е Б) 2е, 8е, 13е, 3е В) 2е, 8е, 14е, 2е
- С какими из веществ реагирует FeO?
А) Н2О Б) HCI В) Na2O
5. Реактиву – желтая кровяная соль, соответствует формула:
А) K3[Fe(CN)6] Б) K4[Fe(CN)6] В) КNCS
(cамоконтроль и взаимоконтроль) за каждый правильный ответ по одному баллу. Добавить по баллу, работающим у доски ученикам.
Контроль знаний. Тест. (Приложение 2)
VI. Рефлексия. (5 мин)
Учитель. В завершении поделитесь своими впечатлениями. Для этого допишите предложения, посвященные сегодняшнему уроку:
Сегодня я узнал (а)______________________________________
Я удивился (лась)_______________________________________
Теперь я умею _________________________________________
Я хотел (а) бы __________________________________________
Ответьте на вопросы в таблице «Вопросы к ученику» (Приложение 1).
Комментирование выставление оценок в оценочный лист (Приложение 2).
VII. Подведение итогов урока. Выставление оценок. (2 мин)
Д/З. § 14 , по составленным генетическим рядам написать уравнения реакций.
Приложение 1
Инструктивная карта к лабораторной работе
Качественные реакции на ионы железа
Лабораторный опыт 1.
Получение гидроксида железа(II) и гидроксида железа(III)
Получить гидроксиды железа в лаборатории можно взаимодействием солей железа со щелочью
а) Налейте в пробирку 1 мл раствора хлорид железа(II). Добавьте к нему по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка. Записать уравнения реакций
б) К хлориду железа(III) прилейте по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка.
Что наблюдаете? Записать уравнения реакции.
Слайд1 – уравнение реакций (самопроверка)
Вывод: Это один из способов распознавания соединений железа с различной степенью окисления, качественные реакции на ионы Fe2+ Fe3+
Fe(OH)2 окисляется на воздухе: сначала зеленеет, потом приобретает бурую окраску
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 Слайд 2
Лабораторный опыт 2
Качественная реакция на ион Fe3+
Реактив – роданид калия KSCN
К раствору хлорида железа(III) добавить одну каплю раствора роданида калия (KSCN). Перемешайте содержимое пробирки и рассмотрите на свету. Отметьте цвет.
Результат воздействия – интенсивно красный цвет
FeCl3 + 3KSCN = Fe (SCN)3 + 3KCl.
2.Реактив – желтая кровяная соль K4 [Fe(CN)6]
г) К раствору хлорида железа(III) Во 2-ю пробирку добавьте 1–2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6] (желтой кровяной соли). Перемешайте содержимое пробирки, отметьте цвет.
Результат воздействия – синий осадок берлинской лазури
K4 [Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6]
Лабораторный опыт 3
Качественная реакция на ион Fe2+
Реактив – красная кровяная соль K3[Fe(CN)6]
Налейте в пробирку 1 мл раствора хлорида железа(II). Добавьте к нему по каплям раствор осадка. гексацианоферрата(III) калия K3[Fe(CN)6] (красной кровяной соли). Отметьте цвет осадка.
Результат воздействия – синий осадок (турнбулевой сини)
FeCI2 + K3[Fe(CN)6] = 2КCI + KFe[Fe(CN)6]↓
Вывод:
Реактивами на ионы Fe2+ являются щелочи и красная кровяная соль K3[Fe(CN)6]
Реактивами на ионы Fe3+ являются щелочи, роданид калия и желтая кровяная соль K4[Fe(CN)6]
Приложение 2
|
Тестирование Железо. Соединения железа. Вариант 1
а) Ag; б) Сu; в) Fe; г) Hg. 2. При горении железа в кислороде образуется. а) FeO . б) Fe2 O3 . в) Fe3O4 . 3. Гидроксид железа (III) проявляет свойства : а) амфотерные; б) кислотные; в) основные.
4. Электронная формула внешнего энергетического уровня и предвнешнего d – подуровня: а)…3d6 4s2; б) …3d74s2; в) … 3d84s2 . 5.При взаимодействии солей Fe3+ со щелочами образуется осадок: а) белого цвета; б) зеленого цвета; в) бурого цвета. 6. Соли железа (III) получают при взаимодействии железа а) с растворами кислот; б) с концентрированными растворами. 7. Химическое соединение Fe3O4 называется: а) магнетит; б) лимонит; в) пирит. 8. Гидроксид железа (III) проявляет свойства : а) амфотерные; б) кислотные; в) основные. 9. При взаимодействии, с какими веществами железо образует соединения со степенью окисления +3? А) СI2 Б) S В) p-рHCI Г) HNO3
|
Тестирование Железо. Соединения железа. Вариант 2.
А) О2 Б) Na2O В) p-р H2SO4 Г) СО2 2. .При взаимодействии солей Fe2+ со щелочами образуется осадок: а) белого цвета; б) зеленого цвета; а) бурого цвета 3. Гидроксид железа (II) проявляет свойства: а) амфотерные; б) кислотные; в) основные. 4. Формула соли, с водным раствором которой реагирует железо: а) Zn (NO3)2; б) Mn (NO3); в) Pb (NO3)2 ; г) Ca(NO3)2. 5. Соли железа (II) получают при взаимодействии железа а) с растворами кислот; б) с концентрированными кислотами. 6. Химическое соединение FeS2 называется: а) магнетит; б) гематит; в) пирит. 7. Оксид железа (3) проявляет свойства а) кислотные; б) основные; в) амфотерные. 8. В состав гемоглобина крови человека входит: а) железо; б) медь; в) золото.
А) СI2 Б) S В) p-р HCI Г) HNO3
|
Приложение 1
Вопросы к ученику
Дата___________________Класс______________________
Постарайся точно вспомнить то, что слышал на уроке и ответь на поставленные вопросы:
|
№ п/п |
Вопросы |
Ответы |
|
1 |
Какова была тема урока? |
|
|
2 |
Какая цель стояла перед тобой на уроке? |
|
|
3 |
Как вы думаете, вы справились с поставленной целью? |
|
|
4 |
Как работали на уроке твои одноклассники? |
|
|
5 |
Как работал ты на уроке? |
|
|
6 |
Как ты думаешь, ты справишься с домашним заданием, полученном на уроке? |
|
Приложение 2
Оценочный лист
Фамилия, имя______________________
- Работа в группах:
За активное участие в работе группы (оценивается группой коллективно для каждого участника) – 4 балла.
- Закрепление:
За каждое, правильно написанное, уравнение – 1,5 балла.
Критерии оценивания:
14 – 16 баллов оценка «5»
10 – 13 баллов оценка «4»
7 – 9 баллов оценка «3»
Менее 7 баллов «незачёт»
Скачано с www.znanio.ru
© ООО «Знанио»
С вами с 2009 года.
![]()


