Предлагаемый методический материал является раздаточными дидактическими карточками с алгоритмами решения расчетных химических задач по определенной теме из школьного курса. Также материалы карточек могут быть использования для индивидуальных заданий на уроках химии, для повторения, обобщения или закрепления знаний, навыков решения задач разных типов, в качестве тренировочных тематических заданий при отработке заданий из ОГЭ или ЕГЭ.
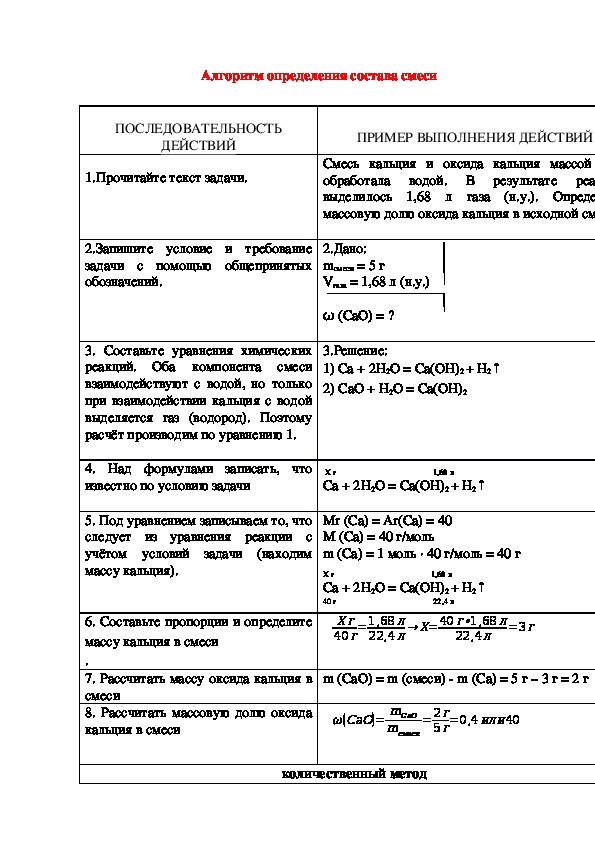
Алгоритм определения состава смеси
ПОСЛЕДОВАТЕЛЬНОСТЬ
ДЕЙСТВИЙ
1.Прочитайте текст задачи.
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
Смесь кальция и оксида кальция массой 5 г
обработала водой.
В результате реакции
выделилось 1,68 л газа (н.у.). Определите
массовую долю оксида кальция в исходной смеси.
2.Запишите условие и требование
задачи с помощью общепринятых
обозначений.
2.Дано:
mсмеси = 5 г
Vгаза = 1,68 л (н.у.)
ω (CaO) = ?
3. Составьте уравнения химических
реакций. Оба компонента смеси
взаимодействуют с водой, но только
при взаимодействии кальция с водой
выделяется газ (водород). Поэтому
расчёт производим по уравнению 1.
3.Решение:
1) Са + 2Н2О = Са(OН)2 + Н2↑
2) CаO + Н2О = Са(OН)2
4. Над формулами записать, что
известно по условию задачи
Х г 1,68 л
Са + 2Н2О = Са(OН)2 + Н2↑
5. Под уравнением записываем то, что
следует из уравнения реакции с
учётом условий задачи (находим
массу кальция).
6. Составьте пропорции и определите
массу кальция в смеси
.
7. Рассчитать массу оксида кальция в
смеси
8. Рассчитать массовую долю оксида
кальция в смеси
Mr (Са) = Ar(Са) = 40
M (Са) = 40 г/моль
m (Са) = 1 моль ∙ 40 г/моль = 40 г
Х г 1,68 л
40 г 22,4 л
Са + 2Н2О = Са(OН)2 + Н2↑
40г=1,68л
Хг
22,4л
→Х=40г∙1,68л
22,4л =3г
m (CaO) = m (смеси) m (Са) = 5 г – 3 г = 2 г
ω(СаО)=
mCaO
mсмеси
= 2г
5г=0,4или40
количественный методРассчитать
выполняем пункты 1 3
4.
количество
газообразного вещества – водорода,
зная, что Vm величина постоянная
для любого газа (н.у.) 22,4 л/моль
νводорода= V
=
Vm
1,68л
22,4л/моль=0,075моль
Х моль 0,075 моль
5. Над формулами записать известные
величины и расчётное количество
фосфора, под формулой количество
фосфора по уравнению реакции
(коэффициент перед формулой);
составить и решить пропорцию
6. Рассчитать массу кальция в смеси Mr (Са) = Ar(Са) = 40
Са + 2Н2О = Са(OН)2 + Н2↑
Хмоль
1моль= 0,075моль
1моль
1 моль 1 моль
→Х=0,075моль
M (Са) = 40 г/моль
m(Ca)=ν·M=0.075моль·40 г
моль=3г
7. Рассчитать массу оксида кальция в
смеси
8. Рассчитать массовую долю оксида
кальция в смеси
m (CaO) = m (смеси) m (Са) = 5 г – 3 г = 2 г
ω(СаО)=
mCaO
mсмеси
= 2г
5г=0,4или40
Запишите ответ.
Ответ:
ω(СаО)=40