
Урок химии
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Учитель химии
Спирина О.А.
Пояснительная записка
Данный урок химии изучается по УМК О.С.Габриеляна (2 часа в неделю) в главе «Растворение. Растворы. Свойства растворов электролитов» в 4 четверти 8 класса. Тип урока – изучение нового материала. Во время урока учащиеся закрепляют знания о видах химической связи; знакомятся с сущностью и механизмом электролитической диссоциации.
Повышению познавательной мотивации на уроке способствует демонстрация опытов на электрическую проводимость твердых веществ и электронная презентация.
Изучение нового материала происходит с помощью демонстрационных опытов, анализа схем и рисунков, а так же использования электронной презентации программы Microsoft Power Point. В ходе урока у учащихся развиваются умения: наблюдать, сравнивать, анализировать, делать выводы. При изучении нового материала используются межпредметные связи с физикой.
В учебном занятии сочетается фронтальная и индивидуальная работы.
Результатом работы является: интенсификация работы учителя и учащихся на уроке; учащиеся закрепляют представления о видах химической связи, усваивают понятия электролит и неэлектролит, изучают сущность и механизм электролитической диссоциации.
Рефлексия урока проводится в виде химического диктанта.
Образовательные задачи:
Развивающие задачи:
- Развитие познавательного опыта школьников.
Воспитательные задачи:
- Продолжить формирование мотивации учебной деятельности.
- Продолжить формирование представлений о положительной роли химии для объяснения происходящих процессов в природе .
Тип урока: урок изучения нового материала.
Применяемые технологии: урок построен с использованием современных информационных технологий - программы Microsoft Power Point.
Формы организации обучения: сочетание фронтальной и индивидуальной работы.
Межпредметные связи: физика ( два типа зарядов).
Оборудование урока:
мультимедийное оборудование; прибор для испытания электрической проводимости веществ.
Основные понятия: электролит, неэлектролит, электролитическая диссоциация.
Ожидаемые результаты: интенсификация работы учителя и учащихся на уроке; учащиеся закрепляют представления о видах химической связи, усваивают понятия электролит и неэлектролит, изучают сущность и механизм электролитической диссоциации.
ВЫВОД: заряд переносят свободные ионы, имеющие возможность двигаться. Значит, поведение веществ в водном растворе зависит от их строения.
O
H H
2.Вспомним строение молекулы
воды. В молекуле воды между атомами О и Н ковалентная полярная связь.
Электронные пары, связывающие атомы смещены к О, где образуется частично «-«
заряд, а у Н частично «+»заряд. Связи каждого атома Н с О в воде образуют между
собой угол 104,50, благодаря чему молекула воды имеет угловую форму.
Полярную молекулу воды изображают в виде диполя
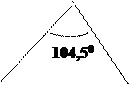 |
|||
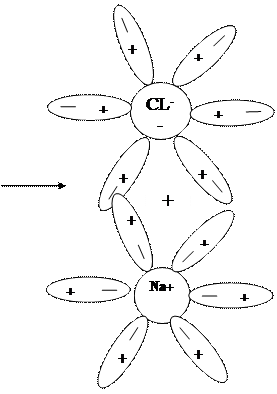
3. Рассмотрим механизм диссоциации на примере раствора соли NаCl. При растворении соли диполи воды ориентируются противоположно заряженными концами вокруг «+» и «-» ионов электролита. Между ионами электролита и диполя воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор (рис. 42 учебника). Последовательность процесса диссоциации веществ с ионной связью (солей и щелочей), будет такой:
а) ориентация молекул – диполей воды около ионов кристалла
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью уравнения: NаСl = Nа+ + Сl-
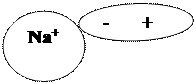




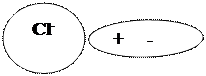



![]()
![]()
![]()
![]()
![]()
![]()
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, НСl) только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов будет такая.
а) ориентация молекул воды вокруг полюсов молекулы электролита
б) гидратация (взаимодействие) молекул воды с молекулами электролита
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную).
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты выглядит так:
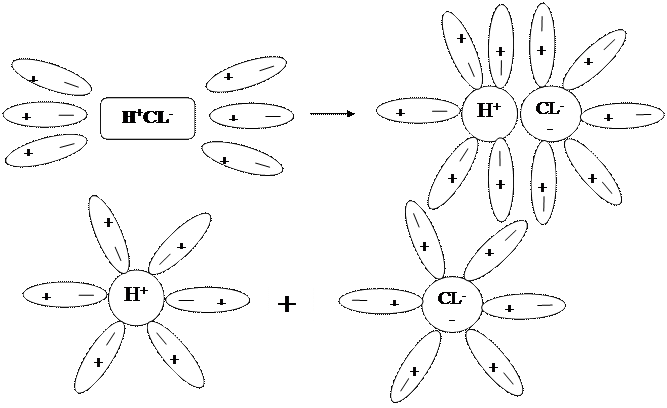 НСl = H ++ Cl-
НСl = H ++ Cl-
Ион, окруженный гидратной оболочкой (молекулами воды) называется гидратированным. Наличие гидратной оболочки препятствует переходу ионов в кристаллическую решетку. Образование гидратированных ионов сопровождается выделением энергии, которая расходуется на разрыв связей между ионами в кристалле.
Таким образом, при растворении солей, щелочей и кислот эти вещества распадаются на ионы.
«Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией».
Теория, объясняющая особое поведение электролитов в расплавленном или растворенном состоянии распадом на ионы называется теорией электролитической диссоциации.
Ее автор шведский ученый Сванте Аррениус 1887 год.
4. В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой α («альфа»).
Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (NP):
α=Nд/NP
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если α=0, то диссоциация отсутствует, а если α=1, или 100%, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, то есть степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты – такие электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты – это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты – H2S, H2CO3, HNO2;
2) водный раствор аммиака NH3*H2O;
3) вода.
III. ВЫВОДЫ и ЗАКРЕПЛЕНИЕ.
Какие вещества называются электролитами? Приведите примеры. Почему эти вещества проводят электрический ток.
Какие вещества называются неэлектролитами? Приведите примеры.
Что понимают под электролитической диссоциацией?
Что показывает степень диссоциации?
Как классифицируют электролиты по степени диссоциации?
Химический диктант
Запишите вещества. Электролиты подчеркните одной чертой, неэлектролиты – двумя чертами. Расставьте заряды.
Жидкий аммиак, раствор хлорида кальция, серная кислота, нитрат калия, гидроксид калия, ацетон, фосфат кальция, бензол, раствор сахара, азотная кислота, карбонат кальция, иодоводород.
Учащиеся выполнят задание с последующей проверкой.
Домашнее задание: П.36 упр. 1,4,5, творческое задание - приготовить доклад о Св. Аррениусе.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.