
Фонд оценочных средств для проведения текущего контроля успеваемости и промежуточной аттестации
Среднее общее образование
10 класс Химия
|
№ |
Тема работы |
Наименование оценочного средства |
Назначение КИМ |
Представление оценочного средства в фонде |
|
|
1 четверть Раздел: «Теоретические основы органической химии» |
|||||
|
1 |
Качественное определение углерода, водорода, хлора в органических веществах |
Практическая работа №1 |
Экспериментальным путем доказать наличие атомов углерода, водорода и хлора в органических соединениях.
|
Комплект практических заданий |
|
|
2 |
Теоретические основы органической химии. Предельные углеводороды |
Контрольная работа №1 |
Оценить уровень подготовки по разделу «Теоретические основы органической химии»
|
Комплект контрольных заданий по вариантам |
|
|
3 |
Получение этилена изучение его свойств |
Практическая работа №2 |
Экспериментальным путём получить этилен и изучить его свойства |
Комплект практических заданий |
|
|
2 четверть Раздел: «Углеводороды » |
|||||
|
1 |
Углеводороды |
Контрольная работа №2 |
Оценить уровень подготовки по разделу «Углеводы» |
Комплект контрольных заданий по вариантам |
|
|
3 четверть Раздел: «Кислородсодержащие органические соединения» |
|||||
|
1 |
Получение и свойства карбоновых кислот |
Практическая работа №3 |
Повторить, систематизировать, практически подтвердить физические и химические свойства карбоновых кислот, научиться их получать на примере уксусной кислоты.
|
Комплект практических заданий |
|
|
2 |
Решение экспериментальных задач по распознаванию органических веществ |
Практическая работа №4 |
Проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
|
Комплект практических заданий |
|
|
3 |
Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты |
Контрольная работа №3 |
Оценить уровень подготовки по разделу «Кислородсодержащие органические соединения» |
Комплект контрольных заданий по вариантам |
|
|
4 четверть Раздел: «Азотсодержащие органические соединения » |
|||||
|
1 |
Решение экспериментальных задач на получение и распознавание органических веществ |
Практическая работа №5 |
Проверить знания характерных свойств изученных классов органических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
|
Комплект практических заданий |
|
|
2 |
Распознавание пластмасс и волокон |
Практическая работа №6 |
На основе знания состава и строения полимеров уметь распознавать в лабораторных условиях наиболее употребляемые пластмассы и волокна.
|
Комплект практических заданий |
|
|
3 |
Кислородсодержащие органические соединения. Азотсодержащие органические соединения |
Контрольная работа №4 |
Оценить уровень подготовки по разделу «Азотсодержащие органические соединения» |
Комплект контрольных заданий по вариантам |
|
Контрольная работа №1 по теме:
«Теоретические основы органической химии. Предельные углеводороды»
ВАРИАНТ 1
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. Валентность углерода и кислорода в органических соединениях равна соответственно:
1) II и I
2) IV и II
3) II и IV
4) IV и I
2. Молекулярная формула 2,5-диметилгексана
1) С8Н16
2) С6Н8
3) С6Н12
4) С8Н18
3.К гомологическому ряду алканов относится вещество, молекулярная формула которого
1) С3Н6
2) С4Н8
3) С5Н12
4) С6Н10
4. Вещество, структурная формула которого
СН2-СН3
│
СН3 — СН2 — С — СН2 — СН3
│
СН3
называется
1) н-гептан
2) 3,3 - диметилпентан
3) 2-метил-2-этилпентан
4) 3-метил-3-этилпентан
5. Для этана характерно(а)
1) одинарная связь между атомами углерода
2) наличие трех атомов углерода
3) наличие связей между атомами водорода
4) sp2-гибридизация орбиталей атомов углерода
6. Верны ли следующие суждения о физических свойствах алканов и циклоалканов?
А. Метан хорошо растворим в воде.
Б. Циклопропан - газ, легче воздуха.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Пропан вступает в реакцию с
1) водородом
2) водой
3) азотной кислотой
4) хлороводородом
8. Циклобутан не реагирует с
1) С12
2) N2
3) О2
4) НВr
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов
9. Метан можно получить в результате реакций
1 ) СН3СОONа + NаОН →t
2) СО + Н2О→
3) С2Н6→t
4)CH3Cl + Na →
5) C+H2 →
10. Изомерами 2,3-диметилпентана являются вещества
1) гептан
2) 2,2-диметилгексан
3) 3-этилпентан
4) 2-метилгептан
5) 3,3-диметилгексан
При выполнении задания № 11-12 подробно запишите ход их решения и полученный результат.
11. Допишите уравнения реакций
1) С2Н6 + Вr2 → 2) СН4 + НNО3 →
СН2
3) / \ +НВr →
Н2С — СН2
12. Определите молекулярную формулу углеводорода, массовая доля углерода в котором равна 82,8 %, а масса 1 л (н.у.) этого газа составляет 2,59 г.
Контрольная работа №1 по теме:
«Теоретические основы органической химии. Предельные углеводороды»
ВАРИАНТ 2
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. Число ковалентных полярных связей в молекуле этана равно
1) 5
2) 6
3) 3
4) 4
2. Изомерами являются
1) пропан и бутан
2) 2-метилбутан и 2-метилпентан
3) гексан и 2,3-диметилбутан
4) 3-этилгексан и гептан
3.К гомологическому ряду циклоалканов относится вещество, молекулярная формула которого
1) С2Н4
2) С4Н8
3) С5Н12
4) С6Н6
4. Вещество, структурная формула которого
СН2 - СН2 - СН3
│
СН3 - СН2 - С - СН3
│
СН2-СН3,
называется
1) З-метил-3-этилгексан
2) 2-метил-2-пропилпентан
3) 2-пропил-2-этилбутан
4) З-метил-3-этилпентан
5. Для метана характерно(а)
1) sp-гибридизация орбиталей атомов углерода
2) наличие связей между атомами водорода
3) соответствие общей формуле СnН2n
4) тетраэдрическое строение молекулы
6. Верны ли следующие суждения об этане?
А. Этан - газ без запаха.
Б. Этан нерастворим в воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Практически осуществима реакция между
1) С3Н8 и НNО3
2) С4Н10 и НВr (р-р)
3) СН4 и КМnО4 (р-р)
4) С2Н6 и Сu
8. Циклогексан вступает в реакцию с
1) водородом
2) хлороводородом
3) бромом
4) углекислым газом
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов.
9. Алканы в лаборатории можно получить в результате реакций
1) СО2 + Н2О →
2) А14С3 + Н2О→
3) С2Н6→t
4) СН3Сl +NаОН→
5) С2Н4 + Н2→
10. Изомерами гексана являются вещества
1) пентан
2) 2,3-диметилгексан
3) 3-этилпентан
4) 2,4-диметилбутан
5) 2-метилпентан
При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат.
11. Допишите уравнения реакций
1) C4H10 →t
2) CH4 + Br2 →
3) Н2С — СН2
│ │ + НС1 →
Н2С — СН2
12. Массовая доля углерода в углеводороде составляет 83,3 %. Относительная плотность паров углеводорода по кислороду равна 2,25. Определите молекулярную формулу углеводорода.
Контрольная работа № 2 по теме:
«Углеводороды»
ВАРИАНТ 1
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. К алкадиенам может быть отнесено вещество, молекулярная формула которого
1) С5Н12
2) С4Н8
3) С3Н4
4) С2Н2
2. Вещество, формула которого
СН3
│
CH - СН = СН - СН3
│
СН3
1) 4-метилпентен-2
2) 2,3-диметилпентен-З
3) 1,1,2-триметилбутен-1
4) 2,3-диметилбутен-2
3. Изомерами являются
1) пентен-1 и циклопентан
2) бутин-2 и бутен-2
3 ) пентадиен-1,2 и 2-метилбутен-2
4 ) циклогексан и бензол
4. Для пропина характерно
1) наличие связей между атомами водорода
2) наличие двух σ- и двух π-связей между атомами углерода
3) sp3-гибридизация орбиталей всех атомов углерода в молекуле
4) жидкое агрегатное состояние
5. Бутадиен-1,3 взаимодействует с
1) НСl
2) N2
3) СН4
4) Вr2
6. Пропин реагирует с
1) серой
2) углекислым газом
3) хлоридом натрия
4) водой
7. Верны ли следующие суждения о химических свойствах бензола?
А. Бензол вступает в реакцию с водой.
Б. Бензол не обесцвечивает раствор перманганата калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8. В схеме превращений
этилен → X → этиленгликоль
веществом «X» является
1) хлорэтан
2) ацетилен
3) 1,1-дибромэтан
4) 1,2-дибромэтан
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов
9. Этилен можно получить в результате реакций
1) разложения метана
2) гидрирования этана
3) дегидратации этанола
4) гидрирования ацетилена
5) углерода с водородом
10. Установите соответствие между структурной формулой углеводорода и общей формулой его гомологического ряда.
ФОРМУЛА ОБЩАЯ УГЛЕВОДОРОДА ФОРМУЛА
А) СН2 = СН- СН2 - СН(СНз) 1) СnН2n + 2
Б) СНз-С ≡ С-СН2-СН3 2) СnН2n - 2
В) С6Н5 - СН(СН3)2 3) СnН2n - 6
Г) СН2 = СН - С(СНз) = СН2 4) СnН2n
При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат.
11 . Допишите уравнения реакций
1) С2H4 + HCl → 2) CH≡C-CH3 + H2O →
3) C6H6 + Br2 →
12. Какой объем метана (н.у.) выделится при взаимодействии карбида алюминия массой 28,8 г с водой?
Контрольная работа № 2 по теме :«Углеводороды»
ВАРИАНТ 2
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. Общая формула гомологического ряда алкинов
1) СnН2n 2) СnН2n.2 3) СnН2n+2 4) СnН2n-6
2. Вещество, формула которого
СН=СН2
│
СН2 - СН
│ │
СН3 СН3,
называется
1) З-метилпентен-1
2) 1,2-диметилбутен-4
3) 3,4-диметилбутен-1
4) 3 -метилбутен-1
3. Изомерами являются
1) циклогексан и 2-метилпентан
2) гексин-1 и гексадиен-2,4
3) пентен-2 и пентадиен-2,3
4) бутадиен-1,3 и циклобутан
4. Для строения молекулы бензола характерно(а)
1) sp3-гибридизация орбиталей атомов углерода
2) одинарная связь между атомами углерода
3) расположение всех σ-связей в одной плоскости
4) наличие между атомами водорода π-связей
5. Бутен-1 реагирует с
1) NаОН(р-р)
2) СuО
3) СO2
4) КМnО4(р-р)
6. Верны ли следующие суждения о химических свойствах этина?
А. Для этина нехарактерны реакции присоединения.
Б. Этин реагирует с натрием.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Бензол реагирует с
1) HNO3
2) НВr(р-р)
3) КМnO4(р-р)
4) Н2О
8.В схеме превращений
бутен-2 → X → 2-метилпропан веществом «X» является
1) бутан
2) пропан
3) 2-метилбутен-2
4) 2-метилбутан
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов.
9. Ацетилен можно получить в результате реакций
1) разложения бутана
2) гидрирования этена
3) разложения метана
4) гидролиза карбида кальция
5) дегидратацией этилового спирта
10. Установите соответствие между структурной формулой углеводорода и общей формулой его гомологического ряда.
ФОРМУЛА
УГЛЕВОДОРОДА
А) СН3 - С(СН3)2 - С ≡СН
Б) СН2 = С = СН-СН2-СН3
В) СН3 - СН2 - СН = СН2
Г) СН3-С6Н4-СНз
ОБЩАЯ
ФОРМУЛА
1) СnН2n + 2
2) СnН2n - 2
3) СnН2n - 6
4) СnН2n
11. Допишите уравнения реакций
1) СH≡C-CH3 + HCl → 2) СН2 = СН - СН = СН2 + Вr2 →
3) C6H5-CH3 + НNО3 →
12. Определите массу бензола, образовавшегося из ацетилена объемом 6,72 л (н.у.). (Выход продукта считать 100 %.)
Контрольная работа № 3 по теме:
«Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты»
ВАРИАНТ 1
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. К классу альдегидов относится
1) метаналь
2) этилацетат
3) фенол
4) этиленгликоль
2. Пропаналь имеет формулу
1) СН3 - СН2 - СН2ОН
2) СН3 - СН(ОН) - СН3
3) СН3 - СН2 - СНО
4) СН3-СН2-СООН
3. Функциональная группа -СООН присутствует в молекуле
1) муравьиной кислоты
2) этилацетата
3) фенола
4) этиленгликоля
4. Верны ли следующие суждения о свойствах спиртов?
А. Между молекулами спиртов образуются водородные связи.
Б. В реакции этанола с натрием выделяется водород.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. При бромировании фенола образуется
1) бромфенол и бромоводород
2) 2,4,6-трибромфенол и бромоводород
3) бензол и бромоводород
4) бромбензол и вода
6. При взаимодействии аммиачного раствора оксида серебра с пропионовым альдегидом образуются
1) серебро, углекислый газ и вода
2) серебро, пропановая кислота и вода
3) нитрат серебра и пропановая кислота
4) серебро и пропановая кислота
7. Муравьиная кислота вступает в реакцию с
1) Сu(ОН)2
2) С2Н4
3) Nа2SО4
4) КаС1
8. В процессе домашнего консервирования овощей применяют
1) метаналь
2) фенол
3) уксусную кислоту
4) ацетат натрия
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов.
9. Этанол в одну стадию можно получить из
1) этилена
2) уксусной кислоты
3) этана
4) этиленгликоля
5) хлорэтана
6) этилацетата
Ответ: ________
10. Метанол и метаналь можно распознать с помощью веществ
1) О2
2) Nа
3) [Аg(NН3)2]ОН
4) Сu(ОН)2
5) КОН
6) NaHCO3
Ответ: ____________
При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат.
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их проведения.
этилен → этанол→ этаналь →уксусная кислота
12. Какая масса пропанола потребовалась для получения 0,2 моль пропена в результате дегидратации?
Контрольная работа № 3
«Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты»
ВАРИАНТ 2
При выполнении заданий № 1-8 выберете номер правильного ответа.
1. К классу одноатомных спиртов относится
1) метаналь
2) этилацетат
3) пропанол
4) этиленгликоль
2. Вещество, структурная формула которого СНз - СН2 - СООН, называется
1) пропаналь
2) пропанол-1
3) пропановая кислота
4) глицерин
3. Функциональная группа -ОН присутствует в молекуле
1) бензола
2) фенола
3) этилацетата
4) этилена
4. Верны ли следующие суждения о свойствах спиртов?
А. Молекулы спиртов содержат гидроксильные группы.
Б. В реакции этанола с уксусной кислотой образуется жир.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Продуктами реакции фенола с натрием являются
1) фенолят натрия и вода
2) фенолят натрия и водород
3) бензол и гидроксид натрия
4) бензоат натрия и водород
6. Уксусный альдегид взаимодействует с каждым из двух веществ
1) Н2О и С2Н6
2) N2 и Аg2О
3) Сu(ОН)2 и Н2
4) С6Н6 и Н2O
7. С уксусной кислотой взаимодействует
1) хлорид калия
2) медь
3) нитрат цинка
4) оксид магния
8. В качестве дезинфицирующего средства можно использовать
1) фенол
2) глицерин
3) муравьиную кислоту
4) бензол
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов.
9. Альдегид в одну стадию можно получить из
1) хлорэтана
2) этана
3) этанола
4) этиленгликоля
5) ацетилена
6) пропанола-1
10. Для распознавания растворов этиленгликоля и муравьиной кислоты можно использовать реактивы
1) NаВr
2) Н2
3) [Аg(NН3)2]ОН
4) фенолфталеин
5) Сu(ОН)2
6) Na2CO3
При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат.
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их проведения.
ацетилен → этаналь→ этанол → хлорэтан
12. Какая масса этаналя была окислена аммиачным раствором оксида серебра, если в результате выделилось 0,3 моль серебра?
Контрольная работа №4 по теме:
«Кислородсодержащие органические соединения. Азотсодержащие органические соединения»
Вариант 1.
1. Межклассовыми изомерами являются:
1) альдегиды и карбоновые кислоты;
2) одноатомные спирты и фенолы;
3) простые эфиры и одноатомные спирты;
4) карбоновые кислоты и двухатомные спирты
2. Общая формула альдегидов:
1) Cn H2n O2 3) Cn H2n O
2) Cn H2n+1 O2 4) Cn H2n+1 OH
3.Продуктами восстановления альдегидов водородом (катализатор Pt) являются:
1) кетоны
2) сложные эфиры
3) простые эфиры
4) одноатомные спирты
4. Этанол не вступает в реакцию с веществом, формула которого:
1) Na 2) HBr 3) NaOH 4) CH3COOH
5. Формула CH3– CH2 – CH2 – CH2 - OH , а вещество называется:
1) 2-метилпропанол-2
2) бутанол-1
3) 2-метилпропанол-1
4) пропанол-1
6. Аминоуксусная кислота реагирует
1)натрием 2)медью 3) хлоридом натрия 4) серой
7. Гомологом для вещества CH3 - CH2 – OH является:
1) уксусная кислота
2) этаналь
3) пропанол-1
4) диметиловые эфиры
8. Белки распознаются при помощи
1) хлорида железа (III)
2) сульфата меди(II) и гидроксида натрия
3) аммиачного раствора оксида серебра
4) лакмуса
9. Установить соответствие между структурной формулой вещества и названием гомологического ряда к которому оно принадлежит:
Структурная формула вещества Названием гомологического ряда
![]() 1) CH3 - CH – CHO
А) Предельные амины
1) CH3 - CH – CHO
А) Предельные амины
CH3 Б) Сложные эфиры
2) CH3 – CH2 - O – CH2 – CH3 В) Простые эфиры
3) CH3 - COO – CH3 Г) Предельные одноатомные спирты
4) CH3 - CH(OH) – CH(OH) – CH3 Д) Многоатомные спирты
5) СН3 – NН2 Е) Альдегиды
10. Для предельных одноатомных спиртов характерны реакции:
1) Этерификации 4) Окисления
2) Дегидратации 5) Полимеризации
3) Гидратации 6) Нейтрализации
11. Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения:
CН3СООН → CH3COO C2Н5 → C2 Н5OH → СО2
12. При восстановлении 500 г нитробензола получили 300 г анилина. Вычислите выход продукта реакции от теоретически возможного.
Контрольная работа №4 по теме:
«Кислородсодержащие органические соединения. Азотсодержащие органические соединения»
Вариант 2.
1. Общая формула СnH2nO2 соответствует:
1) альдегидам
2) фенолам
3) предельным одноатомным спиртам
4) карбоновым кислотам
2. Фенол реагирует с
1) Br2 2) Na2CO3 3) NaCl 4) Cu(OH)2
3. Этанол можно получить из этилена в результате реакции
1) гидратации 3) галогенирования
2) гидрирования 4) гидрогалогенирования
4. При щёлочном гидролизе 2-хлорбутана преимущественно образуется
1) бутанол-2 3) бутаналь
2) бутанол-1
5. При кислотном гидролизе этилацетата образуются
1) этанол и муравьиная кислота 3) метанол и муравьиная кислота
2) этанол и уксусная кислота 4) метанол и уксусная кислота
6. Ацетальдегид не реагирует с
1) аммиачным раствором оксида серебра 3) водородом
2) гидроксидом меди(II) 4) гидроксидом натрия
7. Уксусная кислота реагирует с
1) хлором 3) медью
2) водородом 4) хлоридом натрия
8. Анилин можно получить
1)дегидратацией спиртов 3) восстановлением нитробензола
2)дегидрированием альдегидов 4) гидрированием алкенов
9. Аминоуксусная кислота может вступать в реакции с
1) водородом 4) хлоридом хрома (III)
2) бромоводородом 3) натрием
5) азотом 6) карбонатом натрия
10.Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит.
Название вещества Класс органических соединений
А) глицерин 1) альдегиды
Б) анилин 2) простые эфиры
В) бутанол -1 3) ароматический амин
Г) пропаналь 4) многоатомный спирт
5) одноатомный спирт
6) карбоновая кислота
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6Н6 → С6Н5 Cl → С6Н5ОН → C6 Н2 Br3OH
12. Сколько г анилина можно получить из 125 г нитробензола, если выход анилина составляет 65% по сравнению с теоретическим.
Инструкционные карты к практическим работам
Практическая работа №1 Качественное определение углерода, водорода, хлора в органических веществах
Цель работы: экспериментальным путем доказать наличие атомов углерода, водорода и хлора в органических соединениях.
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, нагревательный прибор, спички.
Вещества: парафин, оксид меди (II), сульфат меди (II), медная проволока, дихлорметан
Техника безопасности:
Опасайтесь растрескивания стеклянной посуды при нагревании.
Соблюдайте правила нагревания.
Будьте осторожны в обращении с растворами солей.
Собирайте остатки веществ в специально предназначенную посуду.
Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы
1. В сухую пробирку поместите около 1 г порошка оксида меди(II) и 0,2 г парафина. Пробирку нагрейте до плавления парафина и затем содержимое ее встряхните, чтобы вещества хорошо перемешались. Пробирку закрепите в штативе в горизонтальном положении (рис.) и поместите в нее недалеко от открытого конца немного безводного сульфата меди (II). Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку с известковой водой. Содержимое пробирки слегка нагрейте и наблюдайте за происходящими изменениями.
Задания для самостоятельных выводов. 1. Почему изменяется цвет сульфата меди(II)? О содержании какого элемента в исследуемом веществе это свидетельствует? 2. О содержании какого элемента свидетельствует помутнение известковой воды? 3. Что образовалось из оксида меди(II) и какие наблюдения это подтверждают? Напишите уравнения всех реакций, которые происходят при этом. Для парафина используйте его усредненную формулу С23Н48.
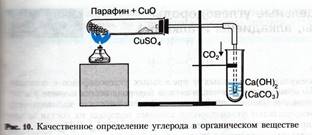
2. Возьмите спираль из медной проволочки и прокаливайте ее в пламени до тех пор, пока пламя перестанет окрашиваться в зеленый цвет. Прокаленную спираль опустите в пробирку с дихлорметаном, затем вновь поместите спираль в пламя горелки. Наблюдайте зеленое окрашивание пламени, свидетельствующее о наличии хлора в органическом растворителе. При взаимодействии меди с хлором образуется хлорид меди(II), который и дает пламени зеленое окрашивание.
Задание для самостоятельного вывода. От присутствия какого элемента пламя окрашивается в зеленый цвет?
Практическая работа № 2
«Получение этилена и изучение его свойств»
Цель работы: экспериментальным путём получить этилена и изучить его свойства
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички.
Реагенты: в пробирке №1 готовая смесь концентрированной серной кислоты и этилового спирта с несколькими крупинками песка; в пробирке №2 раствор перманганата калия.
Техника безопасности:
- Опасайтесь растрескивания стеклянной посуды при нагревании;
- Соблюдайте правила работы с горелками.
- Собирайте остатки веществ в специально предназначенную посуду.
- Будьте осторожны в обращении с растворами кислот.
- Запрещается оставлять неубранными рассыпанные реагенты.
Xoд работы
1. В одну пробирку налейте 2—3 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпьте немного предварительно прокаленного песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте.
2. В другую пробирку налейте 2—3 мл бромной воды. Опустите газоотводную трубку до дна пробирки с бромной водой и пропустите через нее выделяющийся газ.
|
|
3. В третью пробирку налейте 2—3 мл разбавленного раствора перманганата калия, и пропустите через него газ.
4. Подожгите выделяющийся газ.
Задания для самостоятельных выводов. 1. Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Что происходит при пропускании этого газа через бромную воду и раствор перманганата калия? Почему этилен горит более светящимся пламенем, чем метан? Напишите уравнения соответствующих реакций. 2. Чем отличаются свойства этилена от свойств предельных углеводородов?
5.Заполните таблицу:
|
Исходные вещества |
Наблюдения |
Условия течения реакций |
Выводы. Уравнения реакций |
|
1.Получение этилена
|
|
|
|
|
2. Взаимодействие с бромной водой |
|
|
|
|
3. Окисление этилена
|
|
|
|
|
4. Реакция горения
|
|
|
|
6.После окончания работы приведите в порядок своё рабочее место
Практическая работа № 3
«Получение и свойства карбоновых кислот»
Цель работы: повторить, систематизировать, практически подтвердить физические и химические свойства карбоновых кислот, научиться их получать на примере уксусной кислоты.
Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички, пробирки.
Вещества: ацетат натрия, концентрированная серная кислота, раствор уксусной кислоты, стружки магния, гранулы цинка, , раствор фенолфталеина, раствор гидроксида натрия, раствор изоамилового спирта, раствор нитрата серебра, раствор аммиака, раствор муравьиной кислоты
Техника безопасности:
Опасайтесь растрескивания стеклянной посуды при нагревании.
Соблюдайте правила нагревания.
Будьте осторожны в обращении с растворами кислот, щелочей.
Собирайте остатки веществ в специально предназначенную посуду.
Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы
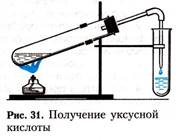
1. Получение уксусной кислоты. Поместите в пробирку 2—3 г ацетата натрия и прибавьте 1,5—2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис.). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0—1,5 мл жидкости.
Задания для самостоятельных выводов. 1, Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции.
2. Взаимодействие уксусной кислоты с некоторыми металлами. В две пробирки налейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а в другую — несколько гранул цинка.
В первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании).
Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 — 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает.
4. Взаимодействие уксусной кислоты со спиртами. В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане.
После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции.
Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
5. Окисление муравьиной кислоты оксидом серебра(I). В чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата серебра(I) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой.
Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции.
Практическая работа № 4
«Решение экспериментальных задач по распознаванию органических веществ»
Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование : горелка, спички, пробиркодержатель, пробирки
Вещества: пробирки с гексаном, бензолом, раствором уксусной кислоты, пробирки с глицерином, этанолом, формалином, пробирки с растворами муравьионой, уксусной, олеиновой кислот
Техника безопасности :
Соблюдайте осторожность в работе с растворами кислот, солей, щелочей.
Соблюдайте правила нагревания.
Опасайтесь растекания посуды.
Помните о правилах ознакомления с запахом.
Запрещается оставлять не убранными разлитые и рассыпанные реагенты.
Ход работы
Решение экспериментальных задач на распознавание органических веществ
1. В трех пробирках даны следующие вещества: а) гексан; б) бензол; в) раствор уксусной кислоты. Определите каждое из веществ.
2. Выданы четыре пробирки: а) с глицерином; б) с этанолом; в) с раствором фенолята натрия; г) с формалином. Определите, в какой пробирке находится каждое из веществ.
3. В трех пробирках даны следующие карбоновые кислоты: а) муравьиная; б) уксусная; в) олеиновая. Как различить эти вещества?
4. Налейте в пробирку 2 мл этанола, прилейте к нему 2 мл разбавленного раствора перманганата калия и добавьте несколько капель серной кислоты. Нагрейте смесь. Почему изменилась окраска раствора?
Практическая работа №5
«Решение экспериментальных задач на получение и распознавание
органических веществ»
Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование: горелка, спички, пробиркодержатель, пробирки
Вещества: пробирки с этанолом, глицерином, раствор сульфата меди (II), раствор гидроксида натрия, стружки магния, пробирки с раствором фенола и раствором метаналя, йодная вода, аммиачный раствор оксида серебра, этиловый спирт, медная проволока, раствор уксусной кислоты, концентрированная серная кислота, карофель, белый хлеб, яблоко, раствор йода.
Техника безопасности :
Соблюдайте осторожность в работе с растворами кислот, солей, щелочей.
Соблюдайте правила нагревания.
Опасайтесь растекания посуды.
Помните о правилах ознакомления с запахом.
Запрещается оставлять не убранными разлитые и рассыпанные реагенты.
Ход работы
1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проделайте опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций.
2. В одной пробирке дан раствор фенола, а в другой — раствор метаналя. Проделайте опыты, которые подтверждают их характерные химические свойства. Напишите уравнения соответствующих реакций.
3. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций.
4. Из этилового спирта получите: а) простой эфир; б) альдегид; в) кислоту; г) сложный эфир. Составьте уравнения соответствующих реакций.
5. Докажите на опыте, что обычный сахар содержит углерод.
6. Докажите опытным путем, что: а) картофель и белый хлеб содержат крахмал; б) спелое яблоко содержит глюкозу.
7. Определите с помощью характерных реакций каждое из трех предложенных веществ: а) крахмал, сахар, глюкозу; б) глицерин, мыло, крахмал (растворы).
Практическая работа № 6
Распознавание пластмасс и волокон
Цель работы: На основе знания состава и строения полимеров уметь распознавать в лабораторных условиях наиболее употребляемые пластмассы и волокна.
Оборудование: железная ложка для сжигания, горелка, спички, стеклянная палочка, три пронумерованные пробирки с образцами пластмасс, три пронумерованные пробирки с образцами волокон.
Реагенты: концентрированная серная кислота (на демонстрационном столе), универсальная индикаторная бумага, раствор гидроксида натрия, универсальная бумага, вода в пробирке для смачивания индикаторной бумаги.
Техника безопасности: Соблюдайте правила работы с горелками. Будьте осторожны в обращении с растворами кислот. Запрещается оставлять неубранными рассыпанные реагенты.
Ход работы:
1. Запишите тему и цель практической работы.
2.В трех пробирках находятся пластмассы: полистирол, полиэтилен, капрон. Определите, в какой из пробирок находится каждое вещество.
В трех пробирках находятся волокна: хлопок, натуральный шелк, вискоза. Определите, какое волокно находится в каждой пробирке.
3. Проведите распознавание ВМС и результаты наблюдений запишите в тетрадь.
4. Сделайте в тетради 2 таблицы для оформления результатов опытов.
5. Заполните таблицы, используйте таблицу в учебнике
Распознавание пластмасс
|
№ образца |
Внешний вид |
Отношение к нагреванию |
Характер горения |
Исследования продуктов горения |
Результат определения: название, элементарное звено |
|
1. |
|
|
|
|
|
|
2. |
|
|
|
|
|
|
3. |
|
|
|
|
|
Распознавание волокон
|
№ образца |
Характер горения |
Окрашивание индикатора продуктами горения |
Действие кислот и щелочей |
Результат определения: названия, основа волокна |
|
|
Н2SO4 (3:2) |
NaOH 10% |
||||
|
1. |
|
|
|
|
|
|
2. |
|
|
|
|
|
|
3. |
|
|
|
|
|
После окончания работы приведите в порядок своё рабочее место
Фонд оценочных средств для проведения текущего контроля успеваемости и промежуточной аттестации
Среднее общее образование
11 класс Химия
|
№ |
Тема работы |
Наименование оценочного средства |
Назначение КИМ |
Представление оценочного средства в фонде |
|
|
1 четверть Раздел: «Теоретические основы химии» |
|||||
|
1 |
Приготовление растворов с заданной молярной концентрацией |
Практическая работа №1 |
Проверить умения готовить растворы с определенной молярной концентрацией, производить теоретические расчеты, которые можно применить на практике.
|
Комплект практических заданий |
|
|
2 |
Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества |
Контрольная работа №1 |
Оценить уровень подготовки по разделу «Теоретические основы химии»
|
Комплект контрольных заданий по вариантам |
|
|
2 четверть Раздел: «Химические реакции» |
|||||
|
1 |
Влияние различных факторов на скорость химической реакции |
Практическая работа №2 |
Определить различные факторы на скорость химической реакции |
Комплект практических заданий |
|
|
2 |
Химические реакции |
Контрольная работа №2 |
Оценить уровень подготовки по разделу «Химические реакции» |
Комплект контрольных заданий по вариантам |
|
|
3 четверть Раздел: «Неорганическая химия» |
|||||
|
1 |
Металлы |
Контрольная работа №3 |
Оценить уровень подготовки по разделу «Металлы» |
Комплект контрольных заданий по вариантам |
|
|
2 |
Неметаллы |
Контрольная работа №4 |
Оценить уровень подготовки по разделу «Неметаллы» |
Комплект контрольных заданий по вариантам |
|
|
4 четверть Раздел: «Генетическая связь неорганических и органических веществ» |
|||||
|
1 |
Решение экспериментальных задач по неорганической химии |
Практическая работа №3 |
Проверить знания характерных свойств изученных классов неорганических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности. .
|
Комплект практических заданий |
|
|
2 |
Решение экспериментальных задач по органической химии |
Практическая работа №4 |
Проверить знания характерных свойств изученных классов органических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
|
Комплект практических заданий |
|
|
3 |
Решение экспериментальных задач по теме «Металлы и неметаллы» |
Практическая работа №5 |
Проверить знания характерных свойств металлов и неметаллов и их соединений и способов их получения.
|
Комплект практических заданий |
|
|
4 |
Получение, собирание и распознавание газов |
Практическая работа №6 |
Повторить технику получения водорода и углекислого газа, вспомнить свойства полученных веществ.
|
Комплект практических заданий |
|
Контрольная работа №1
по теме: « Важнейшие химические понятия и законы. Пери
одический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества».
Вариант 1.
А1. Сумма протонов, нейтронов и электронов в атоме 40Са равна
1) 40 2) 60 3) 30 4) 50
А2. Какую электронную конфигурацию имеет атом наиболее активного металла?
…..3s23p1 2) …..3s2 3) …..3s1 4)…..3s23p2
А3. Элементы расположены в порядке уменьшения их атомов радиуса:
1) F-Br-H-CI 2) H-F-CI-Br 3). Br-CI-F-H 4). H-CI-Br-F
А4. Соединениями с ковалентной полярной и ковалентной неполярной
связью являются соответственно
1) вода и сероводород 2) бромид калия и азот
2) метан и кислород 4) водород и хлороводород
А5. Изотопы одного и того же элемента отличаются друг от друга
1) числом нейтронов 3) числом протонов
2) числом электронов 4) зарядом ядра
В1. Установите соответствие между веществом и видом связи атомов в этом веществе.
НАЗВАНИЕ ВЕЩЕСТВА ВИД СВЯЗИ
A)цинк 1)ионная
B) азот 2) металлическая
В) аммиак 3) ковалентная полярная
Г) хлорид кальция 4) ковалентная неполярная
|
А |
Б |
В |
Г |
|
|
|
|
|
В2. Установите соответствие между химической формулой соединения и значением степени окисления серы в нем.
ФОРМУЛА СОЕДИНЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ
A)Mg(HS04)2
1)0
Б) А12S3 2)+2
B)S8 3)+4
Г)(NH4)2SO3 4)+6
5)-2
С1. Вычислите массу соли и объём газа, который выделится при взаимодействии цинка с 150 г 20% соляной кислотой.
Контрольная работа №1
по теме: « Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества»
Вариант 2.
А1. Иону S2- соответствует электронная формула
1)ls22s22p63s23p6 2) ls22s22p63s23p4 3) ls22s22p6 4) ls22s22p63s23p2
А2. Число нейтронов в ядре атома 39К равно
1)19 2)20 3)39 4)58
А3. Химический
элемент расположен в четвертом периоде,
в IA группе.
Распределению электронов в атоме этого элемен-
та соответствует ряд чисел
1)2,8,8,2 3)2,8,8,1
2)2,8,18,1 4)2,8,18,2
А4. В ряду химических элементов Na - Mg - Al – Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
А5. Вещества, имеющие молекулярную кристаллическую решётку, как правило:
1) тугоплавки и хорошо растворимы в воде
2)легкоплавки и летучи
3) твёрды и электропроводны
4)теплопроводны и пластичны
В1. Установите соответствие между формулой частицы и её электронной конфигурацией
Частица электронная конфигурация
А) S0 1) 1s22s22p63s2
Б) Cl+7 2) 1s22s22p63s23p4
В) Р+3 3) 1s22s22p5
Г) N-2 4) 1s22s22p6
В2. Установите соответствие между веществами и типом химической связи в них
1) Cl2; А) металлическая;
2) Fe; Б) ковалентная полярная;
3) NO; В) ковалентная неполярная;
4) MgO; Г) ионная
С1. Рассчитайте массовую долю соли в растворе, полученном при растворении 1,3 г цинка в 36,5 г 10 % раствора соляной кислоты.
Контрольная работа №2 по теме «Химические реакции»
Вариант1.
А1. Реакция, уравнение которой CaCO3 (к) = CaO (к) + CO2 (г) – Q, относится к реакциям
1) соединения, экзотермическая
2) разложения, эндотермическая
3) соединения, эндотермическая
4) разложения, экзотермическая
А2 . Сокращенное ионное уравнение реакции
Al3+ + 3OH– = Al(OH)3¯
соответствует взаимодействию
1) хлорида алюминия с водой 2) алюминия с водой
3) хлорида алюминия со щелочью 4) алюминия со щелочью
А3. Какой из факторов не оказывает влияния на скорость химической реакции в растворах?
1) концентрация веществ 2) использование катализатора
3) использования ингибитора 4) объём реакционного сосуда
А4. Химическое равновесие в системе
2NO(г) + O2 (г) ↔ 2NO2 (г) + Q
смещается в сторону образования продукта реакции при
|
1) |
повышении давления |
|
2) |
повышении температуры |
|
3) |
понижении давления |
|
4) |
применении катализатора |
А5. К реакциям гидролиза относится взаимодействие с водой
1) натрия
2) оксида натрия
3) хлорида натрия
4) карбоната натрия
В1. Установите соответствие между названием соли и реакцией среды ее
водного раствора.
|
НАЗВАНИЕ СОЛИ |
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
||
|
А) |
фосфат калия |
1) |
щелочная |
|
Б) |
сульфат меди |
2) |
кислая |
|
В) |
карбонат лития |
3) |
нейтральная |
|
Г) |
нитрат натрия |
|
|
В2. В соответствии с термохимическим уравнением реакции
С(тв) + О2(г) = СО2(г) + 393,3 кДж
при выделении 1180,9 кДж теплоты масса сгоревшего углерода равна ______г. (Запишите число с точностью до целых)
С1. Используя метод электронного баланса, составьте уравнение реакции:
КМnO4 → К2МnO4 + ...+ ... .
Определите окислитель и восстановитель.
С2. Вычислите объём углекислого газа, который образуется при разложении 300 г карбоната кальция, содержащего 10 % примесей.
Контрольная работа №2 по теме «Химические реакции»
Вариант2.
А1. Реакция горения аммиака
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) + Q
является реакцией
1) соединения, каталитической, эндотермической
2) замещения, каталитической, экзотермической
3) окислительно-восстановительной, некаталитической, экзотермической
4) обмена, некаталитической, эндотермической
А2. Увеличение давления повысит скорость химической реакции между
1) Fe и H2SO4 (р-р)
2) NH3 и O2
3) Zn и HCl (p-p)
4) BaCl2 (p-p) и H2SO4 (p-p)
А3. Сильными электролитами являются:
1) HCl и AgNO3 2) Fe(OH)3 и H2SO4 3) Zn(OH)2 и H2S 4) H3PO4 и Ag3PO4
А4. Химическое равновесие в системе
CO2 (г) + C (тв) ↔ 2CO (г) – Q
сместится вправо при
1) повышении давления 2) понижении температуры
3) повышении концентрации СО 4) повышении температуры
А5. В качестве анионов только гидроксид-ионы образуются при диссоциации
1) Ba(OH)2 2) CH3 – OH 3) (CuOH)2CO3 4) HCOOH
В1. Установите соответствие между реагентами и ионно-молекулярным уравнением реакции.
РЕАГЕНТЫ ИОННО-МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ
А) NaOH + HNO3 1) CaCO3 + 2H+ = Ca2+ + H2O + CO2
Б) Na2CO3 + HCl 2) CO32– + H2O = HCO3– + OH–
В) Na2CO3 + CO2 + H2O 3) OH– + H + = H2O
Г) CaCO3 + HCl 4) CO32– + 2H+ = CO2 + H2O
5) CO32– + CO2 + H2O = 2HCO3–
В2. При образовании аммиака согласно уравнению реакции:
N2 ( г) + 3H2 (г) = 2NH3 (г) + 92 кДж,
выделилось 23 кДж теплоты. При этом объём (н.у.) составил: ___.(Ответ округлите до целых)
С1. Используя метод электронного баланса, составьте уравнение реакции:
К2МnO4+НСl →МnС12 + С12 +...+ ... .
Определите окислитель и восстановитель.
С2. Вычислите объём углекислого газа, который образуется при разложении 600 г карбоната кальция, содержащего 20 % примесей.
Контрольная работа №3 по теме: « Металлы»
Вариант1.
А1. Электронной конфигурации иона Mg+2 соответствует формула
1) 1s22s22p63s23p63d104s2 2) 1s22s22p63s23p1 3) 1s22s22p63s2c 4) 1s22s22p6
А2. Одинаковую степень окисления хром проявляет в соединениях:
1) СrCl3 и CrO3 2) K2CrO4 и K2Cr2O7 3) K2Cr2O7 и Cr2S3 4) KCrO2 и K2CrO4
А3. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А4. Oснόвные свойства ослабевают в ряду веществ:
1) Li2O ®K2O ®Rb2O 2) Al2O3 ®MgO ®Na2O 3) CaO ®MgO ®BeO 4) B2O3 ®BeO ®Li2O
А5. Медь реагирует с каждым из двух веществ:
1) AgNO3 и O2 2) NaOH и HCl 3) Cl2 и H2O 4) HNO3 и MgCl2
А6. Гидроксид магния можно получить реакцией ионного обмена при взаимодействии
1) хлорида магния с гидроксидом калия 3) оксида магния с гидроксидом калия
2) оксида магния с водой 4) карбоната магния с гидроксидом калия
В1.Установите соответствие между веществами, вступившими в реакцию и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
1) Fe + Cl2 → а) FeCl2
2) Cr(OH)3 + NaOH → б) Na2[Cr(ОН)6]
д) CuSO4 + SO2 +H2O
В2. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) Al(NO3)3 1)H2
Б) LiBr 2) O2
В) Cа(NO3)2 3)NO2
Г) KCl 4) NO
5) Cl2
6) Br2
С1 Напишите уравнения реакций, с помощью которых можно осуществить превращения:
![]()
Укажите условия протекания реакций
С2. Вычислите массу соли, образующейся при взаимодействии 22, 4 оксида кальция с раствором, содержащим 51,2 г азотной кислоты, если известно, что выход составил 80% от теоретически возможного.
Контрольная работа №3
по теме: « Металлы»
Вариант 2.
А1. Какая электронная конфигурация внешнего энергетического уровня соответствует атому элемента II А группы?
1) 3s23p6 2) 3s2 3) 4s23d6 4) 2s22p6
А2. Одинаковую степень окисления хром проявляет в соединениях:
1) СrCl3 и CrO3 2) K2CrO4 и K2Cr2O7 3) K2Cr2O7 и Cr2S3 4) KCrO2 и K2CrO4
А3.Верны ли следующие суждения о щелочных металлах?
А. Щелочные металлы – это серебристо-белые мягкие вещества.
Б. Щелочные металлы – это легкие и легкоплавкие металлы.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А4. Наиболее легко окисляется на воздухе
1) алюминий 2) магний 3) натрий 4) медь
А5. В схеме превращений
Х1 Х2
Na2O ®NaOH ® NaNO3 веществами «Х1» и «Х2» могут быть соответственно
1) Na и HNO3 2) H2O и NaOH 3) HNO3 и Na2O 4) H2O и HNO3
А6. Гидроксид алюминия реагирует с каждым из двух веществ:
1) NaOH и BaCl2 2) KOH и HCl 3) CaSO4 и KNO3 4) K2SO4 и NaCl
В1. С оксидом хрома (VI) реагируют
а) NaOН
б) НCl
в) H2O
г) SO3
В2. Установите соответствие между металлом и способом его электролитического получения
НАЗВАНИЕ МЕТАЛЛА ЭЛЕКТРОЛИЗ
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) расплавленного нитрата
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Al → AlCl3 → Al(ОН)3 → Al(ОН)2NO3 → Al(NO3)3 → AlРO4
С2. При взаимодействии 5 л азота с водородом образовалось 8 л аммиака (н.у.). Вычислите выход продукта реакции от теоретически возможного.
Контрольная работа №4
по теме: « Неметаллы»
Вариант 1.
А1 Электроны атома фосфора, находящегося в основном состоянии, расположены на орбиталях так:
1) …5s25p5 2) …3s23p5 3) …3s23p3 4)… 5s25p3
А2 Максимальная валентность азота равна
1) II 2) III 3) IV 4) V
А3 Число простых веществ в ряду: озон, азот, глюкоза, хлороводород, карбид кальция, сера, графит - равно
|
1) |
1 |
|
2) |
2 |
|
3) |
3 |
|
4) |
4 |
А4. Аллотропные модификации кислорода не отличаются
|
1) |
физическими свойствами |
|
2) |
типом химической связи между атомами |
|
3) |
химическими свойствами |
|
4) |
числом атомов, входящих в состав молекул |
А5. В реакции, уравнение которой
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO,
фосфор
|
1) |
окисляется |
|
2) |
восстанавливается |
|
3) |
принимает электроны |
|
4) |
не изменяет степень окисления |
А6.Объем кислорода (при н. у.), необходимый для окисления 6,4 г серы:
1) 11,2 л 2) 5,6 л 3) 2,24 л 4) 4,48 л
В1. Продуктами разложения нитрита аммония являются:
|
А) |
N2 |
|
Б) |
NO2 |
|
В) |
N2O |
|
Г) |
NO |
|
Д) |
H2O |
(Запишите соответствующие буквы в алфавитном порядке.)
В 2. Установите соответствие между химической формулой соединения и степенью окисления фосфора в нём
Формула соединения Степень окисления фосфора
А) Р2О5 1) +3
Б) H3РО4 2) +5
В) H3РО3 3) -3
Г) Са3Р2 4) +1
5) - 1
6) -2
С1 Напишите уравнения реакций, с помощью которых можно осуществить превращения:
![]()
Укажите условия протекания реакций.
Контрольная работа №4 по теме: « Неметаллы»
Вариант 2.
А1. Среди элементов VIA группы максимальный радиус атома имеет
1) кислород 3) теллур 3) сера 4)полоний
А2. 8. Формула высшего оксида хлора
1) С12О 2) С1О2 3) С12О5 4) С12О7
А3. Водородное соединение с ярко выраженными основными свойствами образует
1) углерод 2)азот 3)фтор 4)кислород
А4. При нагревании кристаллического хлорида натрия с концентрированной фосфорной кислотой выделяется газ
1) SO2 2) SO3 3) HCl 4) Cl2
А5. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и йод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А6. Объем кислорода (при н. у.), необходимый для окисления 6,2 г фосфора
1) 11,2 л 2) 5,6 л 3) 2,24 л 4) 4,48 л
В1. Установите соответствие между реагентами и схемами превращений элемента серы.
|
|
РЕАГЕНТЫ |
|
СХЕМЫ ПРЕВРАЩЕНИЙ |
|
1) |
сера и кислород |
А) |
S+4
|
|
2) |
оксид серы (IV) и кислород |
Б) |
S+4
|
|
3) |
сероводород и кислород |
В) |
S0
|
|
4) |
серная кислота (конц.) и медь |
Г) |
S–2
|
|
|
|
Д) |
S0
|
|
|
|
Е) |
S+6
|
В2. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
|
А) Р203 + Н2O |
1) Н3РO3 |
|
Б) P2Os + Н2O |
2) НРО2 |
|
В) P2Os + MgO |
3) Н3РO4 |
|
Г) Р2O5 + Mg(OH)2 |
4) Mg3(PO4)2 |
|
|
5) Mg3(PO4)2 + Н2 |
|
|
6) Mg3(PO4)2 + Н2O |
С1.Над катализатором пропущена смесь из 44,8 л азота и 100,8 л водорода (н. у.). Вычислите объём аммиака при 75 %-ном выходе аммиака.
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа №1
Приготовление растворов с заданной молярной концентрацией
Цель работы: научиться готовить растворы с определенной молярной концентрацией, производить теоретические расчеты, которые можно применить на практике.
Оборудование: весы, мерная колба , ложечка, химический стакан, стеклянная палочка, вода, хлорид натрия, хлорид калия.
Примечание:
1. Вспомните правила поведения и техники безопасности, процессы растворения, формулы для расчета.
2. Внимательно слушай указания учителя.
Алгоритм проведения работы:
1. этап работы:
Рассчитайте массу соли, которую необходимо взять для приготовления
1 вариант 100 мл 0,1 М раствора хлорида натрия
2 вариант – 100 мл 0,2 М раствора хлорида калия
2. этап работы
На весах взвесьте требуемую навеску соли и помести в мерную колбу и высыпьте ее в мерную колбу вместимостью 100 мл.
3. этап работы: Растворите соль в небольшом количестве дистиллированной воды, долейте воду до метки.
4. . этап работы:
Закройте мерную колбу пробкой и несколько раз переверните вверх дном, придерживая пробку пальцем.
Заключение:
1.Обратите внимание на оформление в тетради, расчеты, рисунки делай аккуратно.
2. Сделайте правильные выводы по работе.
3. Уберите свое рабочее место.
2. Уберите свое рабочее место.
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа № 2
«Влияние различных факторов на скорость химической реакции».
Цель работы: определите сами
Оборудование: известняк в виде кристалла и порошка, соляная кислота, серная кислота (разб. И конц.), оксид меди (II), цинк, спиртовка, держатель, спички, пробирки, сырой и вареный картофель, пероксид водорода.
Примечание:
1. Соблюдай правила по т / б,
2. Не забудьте убрать за собой рабочее место.
Алгоритм проведения работы:
1. этап работы: Влияние поверхности вещества на скорость химической реакции:
В пробирку №1 поместите известняк в виде порошка, в пробирку №2 известняк в виде кристалла, в обе пробирки добавьте 1мл. соляной кислоты. Что происходит? В какой пробирке реакция протекает быстрее, почему?
этап работы: Влияние температуры на скорость химической реакции:
В пробирку №1 поместите оксид меди (2) и добавьте 1 мл. серной кислоты в пробирку №2 поместите оксид меди (2) добавьте 1мл. серной кислоты и нагрейте. Что происходит? В какой пробирке реакция протекает быстрее, почему?
2. этап работы: Влияние концентрации исходного вещества на скорость химической реакции:
В две пробирки поместите по 2 гранулы цинка, в одну пробирку добавьте 1 мл. разбавленной серной кислоты, в другую – концентрированной серной кислоты. Что происходит? В какой пробирке реакция протекает быстрее, почему?
3. этап работы: Влияние катализатора на скорость химической реакции:
Капните капельку пероксида водорода на сырой и вареный картофель и наблюдайте разницу в скорости протекания процесса. Что происходит? В какой пробирке реакция протекает быстрее, почему?
Практическая работа № 5. Решение экспериментальных задач по теме «Металлы и неметаллы».
Цель работы: определите сами
Оборудование: хлорид натрия, нитрат серебра, спиртовка, держатель, ложечка, спички, сульфат меди (2), гидроксид натрия, хлорид бария, номерные пробирки 1,2,3,4, соляная кислота, штатив с пробирками. палочка.
Примечание:
1. Соблюдай правила по технике безопасности.
2. Не забудьте: сначала выполняется теоретическая часть задачи, затем практическая часть.
Алгоритм проведения работы:
1. Определите качественный состав хлорида натрия:
1. Вспомните. что является реактивом на хлорид анион и катион натрия.
2. Проведите качественные реакции на катион и анион, объясните происходящее.
2. Получите из предложенных веществ гидроксид меди (2):
1. Подумайте, какие реактивы вы возьмете для получения гидроксида меди (2) .
2. Проведите реакцию, объясните происходящее, какая реакция лежит в основе получения?
3. В предложенном образце обнаружить сульфат – анион:
1. Вспомните, что является реактивом на сульфат? Подумайте, какой реактив взять?
2. Проведите реакцию. Что происходит? Объясните происходящее.
4. Определите карбонат в пробирках 1, 2:
1. Вспомните, что является реактивом на карбонат? Подумайте, какой реактив взять?
2. Возьмите пробу из пробирок 1,2 и добавьте в пробирки реактив на карбонат. Что происходит? Объясните происходящее.
5. Распознать с помощью качественных реакций карбонат натрия и фосфат натрия в пробирках 3,4:
1. Вспомните, что является реактивом на карбонат и фосфат? Подумайте, какие реактивы взять?
2. Возьмите пробу из пробирок 3 и 4, добавьте в пробирки реактивы. Что происходит? Объясните происходящее.
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа №3
«Решение экспериментальных задач по неорганической химии»
Цель работы: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов неорганических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование: 12 пробирок, стеклянная палочка, горелка (спиртовка), спички, пробиркодержатель.
Реактивы: четыре пронумерованные пробирки с кристаллическими веществами: сульфат натрия, карбонат калия, хлорид аммония, хлорид железа (III); вода, растворы для определения : хлорид бария, гидроксид натрия, нитрат серебра ( на препараторском столе).
Техника безопасности:
- Будьте осторожны с растворами щелочей, солей
- Опасайтесь растрескивания пробирки при её нагревании
- Соблюдайте правила работы со спиртовкой (горелкой)
- Помните о правилах ознакомления с запахом
- Работу проводить только над лотком
-Запрещается оставлять неубранными разлитые и рассыпанные реагенты.
Ход работы
1. Запишите в тетради тему и цель практического занятия
2. Решите экспериментальную задачу: в четырёх пронумерованных пробирках даны кристаллические вещества
1. Сульфат натрия
2. Карбонат калия
3. Хлорид аммония
4. Хлорид железа
Опытным путём установите, какие вещества находятся в каждой из пробирок. Составьте уравнения соответствующих реакций в молекулярном, полном и сокращённом ионном виде.
3. В каждую из пробирок прилейте воду. Размешайте, чтобы получился раствор.
4. Отлейте полученный раствор в 3 чистые пробирки так, чтобы получилось четыре пробирки с одним раствором
5. Определите каждое из веществ
6. Результаты проведённой работы занесите в таблицу:
|
Выполняемые операции |
Наблюдения |
Уравнения реакций |
Вывод |
|
|
|
|
|
7. После окончания работы приведите в порядок своё рабочее место.
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа №4
«Решение экспериментальных задач по органической химии»
Цель работы: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений, умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности.
Оборудование: пробирки, горелка (спиртовка), держатель для пробирок, спички.
Реактивы: растворы белка, этанола, уксусной кислоты, глюкозы, глицерина; сульфат натрия, гидроксид натрия, универсальный индикатор.
Техника безопасности:
- Будьте осторожны с растворами щелочей, кислот, солей
- Опасайтесь растрескивания пробирки при её нагревании
- Соблюдайте правила работы со спиртовкой (горелкой)
- Помните о правилах ознакомления с запахом
- Работу проводить только над лотком
-Запрещается оставлять неубранными разлитые и рассыпанные реагенты.
Ход работы
1.Запишите в тетради тему и цель практического занятия.
2. Решите задачу: С помощью характерных реакций распознайте, в какой из пробирок находятся водные растворы:
1. Этанола
2. Уксусной кислоты
3. Глюкозы
4. Глицерина
5. Белка
3. Обратите на внешний вид реактивов, агрегатное состояние, цвет, запах, консистенцию, вязкость
4. Результаты проведённой работы оформите в виде таблицы:
|
Выполняемые операции |
Наблюдения |
Уравнения реакций |
Вывод |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. После окончания работы приведите в порядок своё рабочее место
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа №5
Решение экспериментальных задач по теме «Металлы и неметаллы»
Цель работы: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств металлов и неметаллов и их соединений и способов их получения.
Оборудование: пробирки, горелка (спиртовка), держатель для пробирок, спички.
Реактивы:
Техника безопасности:
- Будьте осторожны с растворами щелочей, кислот, солей
- Опасайтесь растрескивания пробирки при её нагревании
- Соблюдайте правила работы со спиртовкой (горелкой)
- Помните о правилах ознакомления с запахом
- Работу проводить только над лотком
-Запрещается оставлять неубранными разлитые и рассыпанные реагенты.
Ход работы
3. Описание и результаты опытов занесите в таблицу:
|
Исходные вещества |
Наблюдения |
Уравнения реакций |
Выводы |
|
|
|
|
|
4. Приведите своё рабочее место в порядок
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа № 6
«Получение, собирание, распознавание газов и изучение их свойств»
Вариант 1
Цель: основываясь на знаниях, полученных в 8-9 классе повторить технику получения кислорода и аммиака, вспомнить свойства полученных веществ.
Оборудование: штатив большой лабораторный, муфта, лапка, пробирки, пробка с газоотводной трубкой, лучинка, горелка (спиртовка), спички.
Реагенты: перманганат калия, концентрированная соляная кислота, хлорид аммония, гидроксида натрия, лакмусовая бумажка.
Техника безопасности:
- Будьте осторожны с растворами щелочей, кислот, солей
- Опасайтесь растрескивания пробирки при её нагревании
- Соблюдайте правила работы со спиртовкой (горелкой)
- Помните о правилах ознакомления с запахом
- Работу проводить только над лотком
-Запрещается оставлять неубранными разлитые и рассыпанные реагенты.
Ход работы
1.Запишите в тетради тему практического занятия и вариант.
2. Опыт №1 Получение кислорода:
- Соберите прибор для получения кислорода
-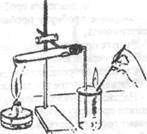 Вставьте в отверстие пробирки с перманга-
Вставьте в отверстие пробирки с перманга-
натом калия, рыхлый комочек ваты и закройте
пробирку пробкой с газоотводной резиновой
трубкой.
-Закрепите собранный прибор в штативе, опустив конец
газоотводной трубки в стакан.
|
|
-Прогрейте пробирку пламенем горелки. Соберите кислород вытеснением воздуха из стакана. Проверьте, наполнен ли стакан кислородом: поднесите тлеющую лучинку к отверстию стакана. Что наблюдаете?
3. Опыт №2.Получение аммиака
|
|
-Соберите прибор как показано на рис.
- В сухую пробирку поместите смесь хлорида аммония и гидроксида кальция. Закройте пробкой с газоотводной трубкой, укрепите в лапке штатива.
-Прогрейте сначала всю (2-3 движения пламени), а затем нагрейте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную лакмусовую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную концентрированной соляной кислотой. Что вы наблюдаете? Напишите уравнения реакции.
-Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа ее вверх дном (конец газоотводной трубки сразу же после снятия с нее пробирки с аммиаком закройте кусочком мокрой ваты).
-Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте ее из сосуда.
4.Описание и результаты опытов занесите в таблицу:
|
Выполняемые операции |
Наблюдения |
Уравнения реакций |
Выводы |
|
|
|
|
|
5. Приведите своё рабочее место в порядок
ИНСТРУКЦИОННАЯ КАРТА
Практическая работа № 6
«Получение, собирание, распознавание газов»
Вариант 2.
Цель: основываясь на знаниях, полученных в 8-9 классе повторить технику получения водорода и углекислого газа, вспомнить свойства полученных веществ.
Оборудование: штатив большой лабораторный, муфта, лапка, пробирки, пробка с газоотводной трубкой, лучинка, горелка (спиртовка), спички.
Реагенты: цинк, соляная кислота, карбонат кальция, раствор гидроксида кальция
Техника безопасности:
- Будьте осторожны с растворами щелочей, кислот, солей
-Обязательно проверьте водород на чистоту
- Опасайтесь растрескивания пробирки при её нагревании
- Соблюдайте правила работы со спиртовкой (горелкой)
- Работу проводить только над лотком
-Запрещается оставлять неубранными разлитые и рассыпанные реагенты.
Ход работы
1.Запишите в тетради тему практического занятия и вариант.
2.Опыт № 1. Получение углекислого газа
- Соберите прибор как показано на рисунке:
|
|
-В пробирку внесите несколько кусочков мела и прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой
- Соберите газ в химический стакан вытеснением воздуха и докажите, что газ собран.
- Пропустите газ в раствор лакмуса. Какую среду (кислую, щелочную или нейтральную ) образует водный раствор оксида углерода (IV)?
- Пропустите углекислый газ в известковую воду до появления признаков реакции. Отлейте пробу этого раствора и пропустите в него избыток углекислого газа. От вновь полученного раствора отлейте пробу и прокипятите. Что наблюдаете? Уравнения реакций составьте в молекулярном и ионном виде.
3.Опыт № 2. Получение водорода
- Соберите прибор для получения газа, проверьте его на герметичность
-Пробирку положите 3-4 гранулы цинка и прилейте 3-4 мл раствора соляной кислоты
-Закройте пробкой с газоотводной трубкой .
-Соберите водород, держа пробирку отверстием вниз ( почему?)
-Проверьте водород на чистоту: не переворачивая пробирку, внесите её горячую лучинку. Лёгкий хлопок указывает на чистоту собранного водорода, свистящий лающий звук – на наличие примесей
- Перелейте водород из одной пробирки в другую и подтвердите, что газ находиться во второй пробирке
4.Описание и результаты опытов занесите в таблицу:
|
Выполняемые операции |
Наблюдения |
Уравнения реакций |
Выводы |
|
|
|
|
|
|
|
|
|
|
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.