
ПЛАН ЗАНЯТИЯ
Специальность 34.02.01 Сестринское дело, курс 1
1. Дата занятия; дисциплина (МДК): Химия
2. Тема занятия: Карбоновые кислоты и их производные.
3. Цель занятия:
- Познакомить со строением карбоновых кислот, их нахождением в природе;
- Изучить химические свойства, рассмотреть области применения карбоновых кислот.
4. План занятия:
4.1. Изучение нового материала:
При изучении теоретического материала по данной теме используй: Приложение 1, видео материал https://learningapps.org/3269829 (пройдите по ссылке: зажмите Ctrl на клавиатуре и щелкните по ссылке из документа, не копируя в браузер. Изучите внимательно материал, подумайте и по возможности решите «Кейс-задание», сделайте записи конспекта в рабочей тетради по химии. Результат конспектирования – это хорошо структурированная запись, позволяющая вам с течением времени без особого труда восстановить в памяти нужную информацию по теме.
Карбоновые кислоты и их производные
Карбоновые кислоты – кислородсодержащие органические вещества, содержащие в молекуле одну или несколько карбоксильных групп СООН
Общая формула: R – COOH
Почему данные кислоты имеют первое слово «карбоновые»?
«Карбо» - углерод Þ кислоты углерода.
Классификация карбоновых кислот
1) В зависимости от числа карбоксильных групп:
• одноосновные, например уксусная
• двухосновные, например щавелевая
• многоосновные, например лимонная
2) В зависимости от природы радикала:
• предельные, например пропионовая
• непредельные, например акриловая
• ароматические, например бензойная
Для определения названия в соответствии с международной номенклатурой придерживаются порядка:
1) Нумеруют цепь, начиная с карбоксильной группы;
2) Называют номер атома углерода, при котором находится радикал;
3) Называют радикал;
4) Называют углеродную цепь;
5) Добавляют суффикс - овая кислота
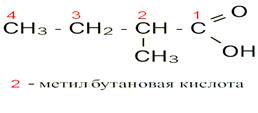
Многие кислоты имеют и исторически сложившиеся, или тривиальные названия, связанные, главным образом, с источником получения:
В щавеле содержится…… (щавелевая кислота).
В корнях растения валерианы…… (валериановая кислота).
В яблоках……. (яблочная кислота).
В лимоне…… (лимонная кислота).
В молоке (прокисшем)……(молочная кислота).
В сливочном масле (прогорклом)…….(масляная кислота).
Таким образом, карбоновые кислоты не обязательно получать синтетически, их можно выделить из окружающих нас растений, они содержатся в продуктах.
Для карбоновых кислот характерна изомерия углеродной цепи.
Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
Бутановая кислота и 2-метилпропионовая кислота
Физические свойства.
НСООН … С9Н19СООН - жидкости
С10Н21СООН - твердые вещества, высшие к/к - без запаха.
Зависимость физических свойств карбоновых кислот от строения молекулы:
С увеличением относительной молекулярной массы в гомологическом ряду предельных одноосновных карбоновых кислот - увеличивается их плотность, температура кипения и плавления, уменьшается растворимость в воде.
Строение молекулы карбоновой кислоты. Из каких двух самостоятельных групп состоит карбоксильная группа?
Карбонил: - С = О Гидроксил: - ОН
Какова особенность электронного строения карбонильной группы?
Связь С=О полярная, плотность смещена к атому кислорода. Электронная плотность в карбонильной группе (особенно σ-связи) смещена в сторону кислорода, как более электроотрицательного элемента. Вследствие этого карбонильный атом углерода приобретает частичный положительный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома кислорода гидроксильной группы. Электронная плотность на атоме кислорода понижается и он смещает в свою сторону электронную плотность связи О – Н. Полярность связи в гидроксогруппе возрастает, водород становится подвижнее и легче отщепляется в виде протона, что обуславливает общие свойства карбоновых кислот.
Какие свойства придает спиртам наличие гидроксила?
За счет подвижности атома водорода спирты проявляют слабые кислотные свойства.
И вот две эти функциональные группы соединены между собой полярность связи – О — Н гидроксильного фрагмента, ион водорода легче отщепляется, кислотные свойства карбоновых кислот значительно сильнее по сравнению со спиртами.
Химические свойства карбоновых кислот
1. Реагируют с оксидами
2HCOOH + MgO = (HCOO)2Mg + H2O
2. Реагируют со щелочами
HCOOH + NaOH = HCOONa + H2O
3. Реагируют с солями
2CH3COOH + CaCO3 = (CH3COO)2Ca + H2O + CO2
4. Реагируют со спиртами
CH3COOH+ C5H11OH = CH3COOC5H11+ H2O
5. Горение
СН3СООН+2О2=2СО2+2Н2О
6. Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором:
Cl – Cl + CH3COOH → Cl CH2COOH + HCl
монохлоруксусная
кислота
Муравьиная кислота по химическим свойствам несколько отличается от других карбоновых кислот.
1. Из одноосновных карбоновых кислот муравьиная кислота является самой сильной кислотой.
2. Муравьиная кислота подобно альдегидам легко окисляется (реакция «серебряного зеркала»)
НСООН + Ag2О → НОСООН + 2Ag↓
угольная кислота
Решите «Кейс-задание»
В истории известен следующий интересный факт:
Римский историк Кай Плиний Старший (23 – 79 гг.н.э.) пересказал легенду о жемчужинах Клеопатры. Египетская царица устроила пир в честь римского полководца Марка Антония. А надо сказать, что среди сокровищ сказочно богатой Клеопатры больше всего славились серьги с огромными грушевидными жемчужинами, массу которых историки оценивали в 40,2г. Желая поразить римского гостя, Клеопатра растворила одну из жемчужин с уксусной кислотой и выпила. Какую реакцию осуществила Клеопатра. Какое соединение она принимала? Напишите уравнение соответствующей реакции.
Обнаружение карбоновых кислот.
Для того чтобы обнаружить кислоту используют индикатор.
Что такое индикатор? (Это вещество, изменяющее свою окраску в кислой или щелочной среде).
Какой индикатор используют для обнаружения кислот? (Синий лакмус).
Если, на апельсиновый сок капнуть синий лакмус. Лакмус изменит окраску. Значит, в апельсине содержится лимонная кислота, поэтому лакмус изменил окраску.
Применение карбоновых кислот
Самая простая по строению из карбоновых кислот муравьиная кислота. Она содержится в крапиве и в хвое. Её формула. H-COOH.
Муравьиная кислота – жидкость с резким запахом. В природе содержится в ядовитых железах муравьёв. Именно поэтому укус муравьёв такой болезненный. Кислота необходима насекомым для защиты и нападения. Эта кислота содержится и в пчелином яде. Находится она и в тончайших волосках крапивы.
Муравьиная кислота обладает сильными бактерицидными свойствами. Её используют так же в медицине.
Щавелевая кислота – это двухосновная кислота HCOOH – HCOOH.
Щавелевая кислота была сначала получена из зелёных листьев щавеля. Её можно выделить из клевера, помидор. Это двухосновная кислота, средней силы. Щавелевая кислота образует белые кристаллы, похожие на сахар. Но внешний вид обманчив, есть эти кристаллы нельзя, они ядовиты. Кислота встречается в составе многих препаратов бытовой химии, которыми удаляют ржавчину. Так же кислота хорошо сводит пятна с белья от красок и чернил.
Лимонная кислота. Это трёхосновная карбоновая кислота. Лимонная кислота была “тайными” чернилами в 17 веке во Франции. Такими чернилами писали письма со скрытой информацией. Брали перо, лимонную кислоту и бумагу. Выводили текст на бумаге и сушили письмо. Высыхая, текст исчезал, и прочитать его можно было лишь над пламенем свечи.
Уксусная кислота - есть у любой хозяйки на кухне. Формула CH3COOH
Уксусная кислота – это самая первая кислота, которая стала известна человеку. Она сопровождает человека с древности, а именно с тех пор как человек научился делать вино из винограда. Уксус стали применять как приправу, лекарство, растворитель. Сейчас кислоту используют при консервировании продуктов.
Ответ на кейс – задание:
Жемчуг - это перламутр, который состоит из шестиугольных пластинок арагонита. Химическая формула его CaCO3 (карбонат кальция). А карбонат кальция легко взаимодействует даже с очень слабыми кислотами (к которым относится и уксусная кислота).
Происходит реакция нейтрализации. Чем в свое время и воспользовалась знаменитая Клеопатра. СаСО3 + 2СН3СООН =(СН3СОО)2Са + Н2О + СО2↑
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.