
Быкова Ольга Александровна
учитель химии
МБОУ «Школа №89 г. Донецка»
Тема: ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Класс-8
Предмет «Химия»
Цели урока:
Ø Образовательные:
Экспериментально изучить химические свойства кислот,
организовать деятельность по формированию умений и навыков экспериментировать, наблюдать, анализировать, делать выводы, практически определять кислоты с помощью индикатора.
Ø Развивающие:
развивать практические навыки в проведении химического эксперимента
учить анализировать полученную информацию;
развивать логическое мышление путем сравнения, обобщения, систематизации;
учить выделять причинно-следственные связи.
Ø Воспитательные
воспитывать положительное отношение к знаниям, повышение мотивации к учению;
формировать умения высказывать свои взгляды, суждения,
развивать химическую речь;
воспитывать толерантность:
формировать уважительное, терпимое отношение друг к другу, умение выслушивать ответы товарищей, бесконфликтно работать в группе;
учить аккуратности при выполнении химических опытов.
Оборудование:
· штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов
Реактивы:
· Индикаторы: лакмус, метилоранж, фенолфталеин, универсальный
· Кислоты :азотная, соляная серная
· Металлы: цинк, магний,, медь.
· Оксиды: Оксид меди (II),оксид железа
· Соли:, карбонат натрия, нитрат серебра
Тип урока: урок изучения нового материала
Форма проведения: урок-путешествие.
Методы: интерактивного обучения: мозговой штурм, работа в группах, взаимопроверка, микрофон.
Структура урока:
1. Организационный момент
2. Актуализация опорных знаний (мозговой штурм)
3. Изучение нового материала (работа в группах)
4. Обобщение и систематизация изученного материала (взаимопроверка)
5. Рефлексия (микрофон)
6. Домашнее задание
Ход урока.
Организационный момент
Создание эмоционального настроя
Учитель: Здравствуйте ребята! Прежде чем мы с вами начнем работать, я бы хотела обратить ваше внимание на картинки на доске.
|
|
|
|
Давайте определимся, с каким изображением вы ассоциируете ваше настроение. У каждого на парте лежат карточки по цвету картинок.
Поднимите, пожалуйста, карточку, которая соответствует вашему настроению. Я надеюсь, что в процессе нашего общения у всех будет хорошее настроение.
Демонстрационный опыт.
(на дне прозрачных стаканчиков находится порошок карбоната натрия, метиловый оранжевый, порошок магния, нитрат серебра, в колбе раствор соляной кислоты)
Маг я, братцы, чародей!
Удивлять могу людей!
Водичку бесцветную,
С виду неприметную
Наливаю, разболтаю
И явления наблюдаю,
Забурлило, зашипело
Побелело, покраснело.
Посмотрите на пробирку
А прольешь – на платье дырки!
Личные компьютеры включайте и соединение величайте?
- Как думаете ребята, какое вещество было в колбе?
- Кислота.
- А что же происходило в пробирках?
- Мы с вами ответим на этот вопрос.
Девиз нашего урока:
«Мы знакомы с чудесами
Делать их умеем сами!»
Итак, сегодня мы с вами отправимся в путешествие в страну кислот.
Записали дату и тему: «Химические свойства кислоты».
Во время путешествия мы узнаем, что же за чудесные превращения происходили в пробирках, то есть изучим химические свойства кислот, познакомимся с понятием индикатор, повторим реакцию замещения и познакомимся с новым типом реакции – реакцией обмена. Вы научитесь анализировать, сравнивать , использовать знания на практике.
И так, вы готовы? Тогда в путь.
Скажите, а что нужно путешественнику в пути?
- Знания и надёжное плечо друга.
Давайте проверим ваши знания:
Актуализация опорных знаний
Мозговой штурм
1. Какие вещества называются кислотами?
2. Атом какого элемента входит в состав всех кислот?
3. Как классифицируют кислоты по числу атомов водорода?
4. Как классифицируют кислоты по наличию кислорода?
5. Как определить валентность кислотного остатка?
- Хорошо! Багаж знаний у вас есть, мы отправляемся в путь.
Изучение нового материала
- Ребята! Посмотрите какой чудесный цветик - семицветик нам встретился на границе в страну кислот. Что же за лепестки у него необычные.
Это формулы неорганических веществ.
Выберите формулы кислот.

Рис.1
А сейчас нам с вами придётся пройти «пограничный контроль».
Я задаю вам вопрос, а вы должны, если согласны, поднять сигнальную карточку, если нет, не поднимайте.
H2SO4 – это сульфатная кислота
оксиген содержащая кислота
валентность кислотного остатка I
HNO3 – это одноосновная кислота
это хлоридная кислота
H3PO4 – валентность кислотного остатка III
это фосфатная кислота
HCl – кислотный остаток этой кислоты II
-хлоридная кислота
Молодцы!
Мы все прошли пограничный контроль. Кислоты вы знаете.
- Скажите, а можно ли кислоты пробовать на вкус? – Нельзя!
- А как же узнать, что это кислота?
Ответ найдём на первой станции.
1.Станция - Индикаторная.
Учитель: Что же за название такое?
В природе существуют такие вещества, что ведут себя как хамелеон, они изменяют свой цвет в зависимости от среды в которую они попадают. В удивительной стране химия такие хамелеоны называются «индикаторами».
Индикаторы – это вещества меняющие цвет в зависимости от среды
Давайте проверим как ведут себя химические «хамелеоны».
Вспомним наш девиз: «Мы знакомы с чудесами, делать их умеем сами!».
Но прежде чем вы приступите к работе –
повторим и закрепим правила техники безопасности при работе с кислотами:
1Обращаться очень аккуратно!
2 При попадании на кожу- смыть водой и промыть раствором питьевой соды.
Кроме кислоты, вы работаете со стеклянной посудой.
Какое главное правило – осторожность, не разбить и не пораниться!
Приступаем к работе!
Лабораторный опыт. Взаимодействие кислот с индикаторами.
У вас на столах в лотке имеется 2 кислоты.
И есть индикаторная бумага – это бумага пропитанная раствором индикатора.
Желтая – это универсальная.
Оранжевая – метил оранж.
Фиолетовая – лакмус
Открыли бутылочку с соляной кислотой и стеклянной палочкой нанесли капельку кислоты на каждую бумажку.
Как изменился цвет?
Давайте проверим для серной кислоты; прополощите стеклянную палочку в стакане с водой.
А я вам продемонстрирую с изменение цвета индикатора в HNO3
Сформулируйте вывод как изменяется цвет индикаторов в кислой среде.
Учащиеся : заполняют схему в тетради.
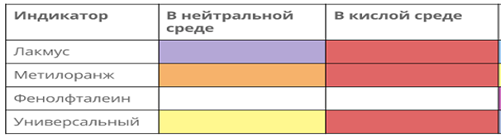
Схема1.
Отправляемся дальше:
2.Станция – Металлическая.
Учитель: Свойства есть у кислоты
С ними познакомься ты
Кислота чтоб ты знал
Обожает металл
Но не все, а только те,
Что доступны кислоте
Сам Бекетов говорят
Разместил металлы в ряд
Водород стоит меж ними
Чуть подальше середины
С металлами до водорода
И реагируют кислоты
Итог известен наперед
Соль да чистый водород
А реакция сия по типу замещения!
Открыли учебник стр. 154, ознакомились с вытеснительным рядом металлов.
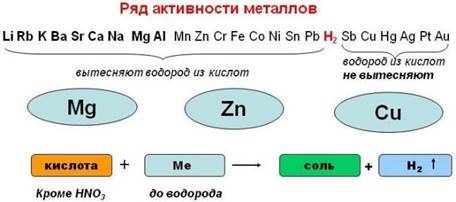
Схема 2.
Впервые этот ряд составил на основе экспериментальных данных профессор харьковского университета Николай Николаевич Бекетов.
Ну мои юные волшебники давайте предоставим себя на месте Н.Н.Бекетова и сделаем сами это открытие.
Лабораторный опыт. Взаимодействие кислот с металлами.
У вас в стаканчиках металлы Zn в гранулах, Mg в порошке и Cu – кусочки.
I вариант добавляет- HCl
II вариант добавляет- H2SO4 (раствор) .
Учащиеся обмениваются результатами и делают выводы.
Металлы стоящие в ряду напряжений до водорода, вытесняют водород из кислот
Учащиеся записывают уравнения реакций у доски с комментариями .
Mg + 2HCL => MgCL2 + H2↑
хлорид
магния
Mg + H2SO4 =>MgSO4 + H2↑
сульфат
магния
Zn + 2HCl => ZnCl2 + H2 ↑
Zn + H2 SO4 =>ZnSO4 + H2↑
Cu + HCl =>
Cu + H2SO4 =>
1) Все ли металлы реагируют с кислотами?
2) Что образуется в результате реакции?
3) Как называется тип реакции?
Станция металлическая – осталась позади,
Ребята! Обратите внимание какие волшебные лепестки остались у цветика –семицветика.(оксиды)
3.станция «Оксидная».
Учитель:
И с оксидами металлов
У кислот проблемы мало
Образуется всегда
Соль да чистая вода.
А реакция меж тем называется обмен!
Демонстрационный опыт . Взаимодействие кислот с оксидами металлов.
CuO + H2SO4 => CuSO4 +H2O
Как можно дать определение типа реакции?
Записать определение:
Два сложных вещества обмениваются своими составными частями и образуются новые сложные вещества:
Fe2O3 + 6HBr => 2FeBr3 + 3H2O
бромид
феррума
Учитель подводит детей к самостоятельному выводу направляющими вопросами:
1) Все ли оксиды реагируют с кислотами?
2) Какие вещества образуются в результате реакции?
3) Как написать формулу соли?
4) Как называется тип реакции?
Обобщение и систематизация знаний.
Учащиеся выполняют задание с последующей взаимопроверкой и оцениванием
Самостоятельная работа
У вас на столе лежат задания, работаете группами по 4 человека под девизом «Один за всех и все за одного.»
Допишите уравнение возможных реакций
CaO + H3PO4 => Na2O + H2SO4=>
Ag + HCl => BaO + HNO3=>
Fe + HBr=>
Взаимопроверка (обмен группами) выполнения задания .
Долгим было наше путешествие и мы порядком устали – А не пора ли нам подкрепиться! ( учитель достает блюдо с фруктами: лимон, яблоко, апельсин)
4.Станция «Дегустационная»
Как вы думаете, почему у меня на столе все эти фрукты- потому что все они содержат кислоты, только кислоты эти органические, и в отличии от неорганических их можно пробовать на вкус и даже нужно. Я думаю вы все заботитесь о своем здоровье. Для профилактики гриппа нам всем нужна аскорбиновая кислота – она содержится в апельсинах. Если у вас запершило в горле – поможет лимон, как думаете какая кислота содержится в нем – лимонная. А какая кислота содержится в яблоках – яблочная и аскорбиновая.
Ну а уж если вы все-таки заболели на помощь придет аспирин – ацетилсалициловая кислота.
Более подробно вы с этими кислотами познакомитесь в 11 классе.
Вот и подошло наше путешествие к концу.
Но я с вами не прощаюсь
Я говорю вам до свиданья
Час прощанья не для нас
Домашнее задание:.
§ 45 упр. 3 стр. 155
для любознательных исследовать продукты на наличие кислоты, качестве индикатора используйте сок свеклы.
Творческое задание: найдите информацию о применении кислот в быту.
А теперь подведем итоги нашего урока.
Подведение итогов урока. Рефлексия.
Учитель: Поделитесь своими впечатлениями об уроке.
Что нового и интересного вы сегодня узнали? Надеюсь, что ваше настроение от сегодняшнего урока соответствуют этой картинке.

Если вы узнали что-то новое на уроке – встаньте.
Если вы не скучали – топните 2 раза.
Если вам было интересно – хлопните в ладоши 2 раза.
Если вам понравился урок – прижмите руки к сердцу.
А теперь отдадим тепло наших сердец друг-другу.
И скажем спасибо!
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.