
Модель атома водорода по Бору
Опыты подтвердили правильность ядерной модели атома Резерфорда, поэтому ученым пришлось признать ограниченность применения законов классической физики.
Изучая противоречия модели атома Резерфорда законам классической физики, Нильс Бор в 1913 г. выдвигает "постулаты", определяющие строение атома и условия испускания и поглощения им электромагнитного излучения. Постулаты Бора показали, что атомы "живут" по законам микромира.
I постулат - постулат стационарных состояний:
ü В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешнего воздействия на атом.
ü В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением.
ü Каждому стационарному состоянию атома соответствует определенная энергия атома.
ü Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны.
II постулат - правило частот:
ü При переходе атома из одного стационарного состояния в другое излучается или поглощается 1 фотон.
ü а) Атом излучает 1 фотон(который несет 1 квант энергии), когда электрон переходит из состояния с большей энергией (Еk) в состояние с меньшей энергией (Еn).
Энергия излученного фотона: Ефотона = Еk - Еk (Здесь (Ek - En) - разность энергий стационарных состояний).
При Ек > Eп происходит излучение фотона.
Частота излучения: ![]() , где k
и n
- номера стационарных состоянии, или главные квантовые числа.
, где k
и n
- номера стационарных состоянии, или главные квантовые числа.
ü б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в стационарное состояние с большей энергией (E k).
При Ек < Еn происходит поглощение фотона.
После экспериментальных проверок правильности модели атома Резерфорда и принятия постулатов Бора ученым пришлось признать ограниченность применения законов классической физики для микроскопических тел.
Трудности теории Бора
Правило квантования Бора применимо не всегда, представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным. Теория Бора неприменима для многоэлектронных атомов и не объясняет ряд спектральных закономерностей. В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшее под влиянием внешнего воздействия. Такое излучение называется вынужденным излучением и лежит в основе работы лазеров.
Модель атома водорода по Бору
Свои постулаты Н. Бор применил для построения теории строения простейшего атома (атома водорода).
Согласно этой теории Бор смог вычислить для атома водорода:
- возможные радиусы орбит электрона и размеры атома
- энергии стационарных состояний атома
- частоты излучаемых и поглощаемых электромагнитных волн.
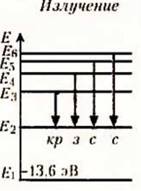
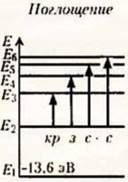
Распределение энергетических уровней при излучении (испускании) и поглощении атомом водорода электромагнитных волн:
 При
n = 1 - основное энергетическое состояние, ему соответствует радиус орбиты
электрона r = 0,5 • 10 -11 м.
При
n = 1 - основное энергетическое состояние, ему соответствует радиус орбиты
электрона r = 0,5 • 10 -11 м.
При n > 1 - возбужденные состояния.
 При
поглощении атомом кванта энергии (фотона) атом переходит в возбужденное
состояние, при этом электрон переходит на более отдаленную орбиту и его связь с
ядром слабеет. Переходы в первое возбужденное состояние (Е2) с
верхних уровней соответствует частотам видимой части (кр з с с) спектра
водорода.
При
поглощении атомом кванта энергии (фотона) атом переходит в возбужденное
состояние, при этом электрон переходит на более отдаленную орбиту и его связь с
ядром слабеет. Переходы в первое возбужденное состояние (Е2) с
верхних уровней соответствует частотам видимой части (кр з с с) спектра
водорода.
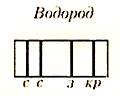
Линейчатый спектр атома водорода состоит из линий, сгруппированных в серии:
Частоты каждой серии спектра можно
подсчитать по формуле Бальмера-Ридберга: ![]() , где k=n+1,
n+2, n+3
и т.д.
, где k=n+1,
n+2, n+3
и т.д.
В спектре водорода обнаружены следующие серии:
n = 1 - серия Лаймана - ультрафиолетовое излучение
n = 2 - серия Бальмера - видимое излучение
n = 3 - серия Пашена - инфракрасное излучение и т.д.
Однако, надо помнить, что для атомов с большим числом электронов (больше 1) расчеты по теории Бора неприменимы.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.