"Окислительно-восстановительные реакции в органической химии" материал интересный и нужный...в виде презентации..можно использовать на уроке и во внеклассной работе при подготовке к ЕГЭ...а так же использовать тем кто занимается репетиторством....интересно нужно и с пользой для учеников...незаменимый материал.....хорошо усваивается учениками...ученики довольны что
Окислительно-
восстановительн
ые
реакции
в органической
химии
Окислительно-восстановительные реакции в органической химии
Какие реакции относят к
окислительно-
восстановительным?
реакции, протекающие с
изменением степени окисления
атомов всех или некоторых
элементов, входящих в состав
реагирующих веществ
2
реакции, протекающие с изменением степени окисления атомов всех или некоторых элементов, входящих в состав реагирующих веществ
В соответствии с этим определением
очень многие органические реакции
могут быть отнесены к реакциям
окисления:
• дегидрирование алифатических
соединений, приводящее к образованию
двойных углерод-углеродных связей:
H
CC
H
H
C
H
C
Al2O3
to
H
CC
H
C
C
+ H2
3
В соответствии с этим определением очень многие органические реакции могут быть отнесены к реакциям окисления:•дегидрирование алифатических соединений, приводящее к образованию двойных углерод-углеродных связей:
реакции замещения атомов
водорода у алканов:
H
H
C
H
H
Cl2
h
H
H
C
H
Cl + HCl
4
реакции замещения атомов водорода у алканов:
реакции присоединения галогенов к
алкенам, протекающие с разрывом
кратной связи:
H
CC
H
C
C
Cl2
H
CC
Cl
H
C
Cl
C
5
реакции присоединения галогенов к алкенам, протекающие с разрывом кратной связи:

Существует два подхода к определению степени
Существует два подхода к определению степени
окисления атома углерода в органических веществах
окисления атома углерода в органических веществах
среднюю степень окисления атома углерода в
1.Вычисляют среднюю степень окисления атома углерода
молекуле органического соединения. Такой подход оправдан, если в
ходе реакции разрушаются все химические связи. CC8/38/3
2.Определяют степень окисления каждого атома углерода
степень окисления каждого атома углерода. В этом
случае степень окисления любого атома углерода в органическом
соединении равна алгебраической сумме чисел всех его связей с
атомами более электроотрицательных элементов (О, N, Cl, S),
учитываемых со знаком «+», и числа связей с атомами водорода (или
другого более электроположительного элемента), учитываемых со
знаком «». При этом связи с соседними атомами углерода не
учитываются.
33HH8.8.
CC22HH33 – O H
– O H метанол
метанол
Атом углерода связан с тремя атомами водорода (эти связи
учитываются со знаком «»), одной связью – с атомом кислорода (ее
учитывают со знаком «+»). Получаем: 3 + 1 = 2
Н.В.Горбенко
Однако, в органической химии
традиционно окисление
определяют как процесс, при
котором в результате
превращения функциональной
группы вещество переходит из
одного класса в другой:
алкен спирт альдегид
(кетон) карбоновая кислота.
• Большинство реакций окисления включает
введение в молекулу атома кислорода
или образование двойной связи с уже
имеющимся атомом кислорода за счет
потери атомов водорода.
8
Однако, в органической химии традиционно окисление определяют как процесс, при котором в результате превращения функциональной группы вещество переходит из одного класса в другой:алкен спирт альдегид (кетон) карбоновая кислота.•Большинство реакций окисления включает введение в молекулу атома кислорода или образование двойной связи с уже имеющимся атомом кислорода за счет потери атомов водорода.
Окислители
• соединения хрома (VI): раствор
бихромата калия K2Cr2O7 в серной
кислоте, раствор триоксида хрома
CrO3 в разбавленной серной кислоте
(реактив Джонсона):
• При окислении органических веществ,
хром (VI) в любой среде
восстанавливается до хрома (III).
9
Окислители•соединения хрома (VI): раствор бихромата калия K2Cr2O7 в серной кислоте, раствор триоксида хрома CrO3 в разбавленной серной кислоте (реактив Джонсона):•При окислении органических веществ, хром (VI) в любой среде восстанавливается до хрома (III).
уравнения полуреакций
восстановления в которых участвуют
перечисленные выше окислители
• В кислой среде:
2
2
7
OC
_
e6H14
• В нейтральной среде:
_
e6H6
CrO2
3
• В кислой среде:
CrO2
3
_
e6H12
3
Cr2
OH7
2
OH3OCr
2
3
2
3
Cr2
OH6
2
10
уравнения полуреакций восстановления в которых участвуют перечисленные выше окислители•В кислой среде:•В нейтральной среде: •В кислой среде:
Перманганат калия KMnO4 в разных
средах проявляет различные
окислительные свойства:
Н.В.Горбенко
Перманганат калия KMnO4 в разных средах проявляет различные окислительные свойства:
при этом сила окислителя
увеличивается в кислой среде:
• В кислой среде
4
_
e5H8
MnO
Mn
2
OH4
2
• В нейтральной среде
MnO
4
_
e3OH2
2
MnO
2
OH4
• В щелочной среде
_
e1
MnO
4
MnO
2
4
12
при этом сила окислителя увеличивается в кислой среде:•В кислой среде•В нейтральной среде• В щелочной среде
уравнения полуреакций
восстановления
MnO
2
4
MnO
2
_
e4H8
_
e2H4
2
Mn
OH4
2
2
Mn
OH2
2
2 Cu(OH)2 + 2ē Cu2O + 2OH¯ + H2O
[Ag(NH3)2]+ + 1ē Ag + 2NH3
13
уравнения полуреакций восстановления 2 Cu(OH)2 + 2ē Cu2O + 2OH¯ + H2O [Ag(NH3)2]+ + 1ē Ag + 2NH3
Как окисляются
органические вещества?
• Алкильные цепи, соединенные с ароматическими
кольцами, окисляются до -COOH-групп
Cl
CH3
KMnO4
H+
Cl
CH(CH3)2
KMnO4
ù åëî ÷í àÿ ñðåäà
COOH
COOK
• при проведении реакции окисления
перманганатом калия в щелочной среде,
продуктом реакции является не свободная
кислота, а ее калиевая соль.
14
Как окисляются органические вещества?•Алкильные цепи, соединенные с ароматическими кольцами, окисляются до -COOH-групп•при проведении реакции окисления перманганатом калия в щелочной среде, продуктом реакции является не свободная кислота, а ее калиевая соль.
Окисление алкенов
• реакция Вагнера используется как
качественная проба на двойную связь:
H2C CH2
KMnO4
H2O
H2C
CH2
OH OH
3С2H4 + 2KMnO4 +4 H2O → 3HO – CH2 – CH2 –OH +
2MnO2 + 2KOH
15
Окисление алкенов•реакция Вагнера используется как качественная проба на двойную связь:3С2H4 + 2KMnO4 +4 H2O → 3HO – CH2 – CH2 –OH + 2MnO2 + 2KOH
Продуктами окисления алкенов
горячим щелочным или кислым
раствором перманганата калия или
кислым раствором бихромата калия
являются карбоновые кислоты и (или)
• 1) разорвите двойную связь;
• 2) присоедините атомы кислорода к
кетоны
каждому атому углерода по месту разрыва
двойной связи,
• 3) внедрите атомы кислорода по всем
имеющимся СН связям атомов углерода
имеющим прежде двойную связь:
C C
[O]
[O]
C
C
C
H
C
C
C
C C
H
C C
O
H
O
+
O
C
C
C
16
Продуктами окисления алкенов горячим щелочным или кислым раствором перманганата калия или кислым раствором бихромата калия являются карбоновые кислоты и (или) кетоны•1) разорвите двойную связь; •2) присоедините атомы кислорода к каждому атому углерода по месту разрыва двойной связи,• 3) внедрите атомы кислорода по всем имеющимся СН связям атомов углерода имеющим прежде двойную связь:
рассмотрим уравнения некоторых
реакций окисления алкенов, и
составим формулы продуктов,
используя приведенный алгоритм
R C CH2
H
KMnO4
H+
R CH CH R'
KMnO4
H+
O
R C
OH
O
+ CO2 + H2O
R C
+
OH
R' C
O
OH
5СН3—СН=СН—СН2—СН2—СН3+8KMnO4+12H2SO4 →
5CH3COOH+5CH3CH2CH2COOH+8MnSO4+4K2SO4+12H2O
17
рассмотрим уравнения некоторых реакций окисления алкенов, и составим формулы продуктов, используя приведенный алгоритм5СН3—СН=СН—СН2—СН2—СН3+8KMnO4+12H2SO4 →5CH3COOH+5CH3CH2CH2COOH+8MnSO4+4K2SO4+12H2O
Окисление одноатомных спиртов
Окисление спиртов происходит по атому
углерода при функциональной группе. При
этом первичные спирты легко
превращаются в альдегиды, а вторичные –
в кетоны
[O]
RCH2OH
RCHO
R
R
CHOH
[O]
R
R
C
O
CC33HH77OH + K
OH + K22CrCr22OO77 + H + H22SOSO44 → C → C33HH66O + Cr
O + Cr22(SO(SO44))33 +
+
KK22SOSO44 + H + H22OO
18
Окисление одноатомных спиртовОкисление спиртов происходит по атому углерода при функциональной группе. При этом первичные спирты легко превращаются в альдегиды, а вторичные – в кетоныCC33HH77OH + KOH + K22CrCr22OO77 + H + H22SOSO44 → C → C33HH66O + CrO + Cr22(SO(SO44))33 + + KK22SOSO44 + H + H22OO
такой окислитель как MnO2 не
затрагивает кратные связи в молекуле,
поэтому может быть использован для
получения и непредельных альдегидов
и кетонов при окислении
соответствующих спиртов:
CH CHCH2OH
MnO2
CH CHCHO
19
такой окислитель как MnO2 не затрагивает кратные связи в молекуле, поэтому может быть использован для получения и непредельных альдегидов и кетонов при окислении соответствующих спиртов:
СН3—СН = СН—СН2—СН2—СН3 + KMnO4 +
H2SO4 → СН3СООН + CH3CH2CH2COOH +
MnSO4 + K2SО4 + Н2О
ВидыВиды
связей
связей
С—СС—С
С—НС—Н
Число
Число
связей в
связей в
исходном
исходном
веществе
веществе
6 связей
6 связей
12 связей
12 связей
Число
Число
связей в
связей в
продуктах
продуктах
реакции
реакции
22
22
Потеряно
Потеряно
связей
связей
Всего
Всего
4 или 8ē
4 или 8ē
44
1010
Мn→
Мn+7 + 5ē
4 связи 2 ē
+2
8→ e
8 в.п.
5 о.п.
5СН3—СН=СН—СН2—СН2—СН3+8KMnO4+12H2SO4 →
5CH3COOH+5CH3CH2CH2COOH+8MnSO4+4K2SO4+12H2O
Н.В.Горбенко

Алгоритм составления уравнения овр
уравнения овр
Алгоритм составления
методом протоннокислородного баланса (protoxygen
protoxygen))
методом протоннокислородного баланса (
C→ 6H5COOH + MnSO4 + CO2 + K2SO4 + H2O
KMnO4 + C6H5CHCH2 + H2SO4
1. Исходное вещество и продукт реакции,
в которое оно трансформируется, в
электронных уравнениях записываются в
молекулярной форме, если степени
окисления атомных частиц в них сложно
определить.
2. Устанавливают материальный баланс
атомных частиц в каждом электронном
уравнении. При этом недостаток
кислорода в правой или левой части
электронных уравнений восполняют за
счет атомных частиц кислорода (О-2), а
недостаток водорода – за счет атомных
частиц водорода (Н+1).
3. Уравнивают заряды в каждом
электронном уравнении за счет
электронов.
4. Составляют электронный баланс,
выравнивая число отданных и
присоединенных электронов.
Н.В.Горбенко
5.5.Найденные коэффициенты ставят перед
формулами соответствующих
C6H5CHCH2
0 → C6H5COOH0 + CO2
0
0 + 4О-2 – 10е- →
0 -
- + 5e- → Mn2+ + 4O-2 -
C6H5CHCH2
C6H5COOH0 + 2Н+ + CO2
окисление
MnO4
восстановление
C6H5CHCH2
C6H5COOH0 + 2Н+ + CO2
MnO4
0 + 4О-2 – 10е- →
0
1
- + 5e- → Mn2+ + 4O-2 - 2
2KMnO4 + C6H5CHCH2 + 3H2SO4 →
C6H5COOH + 2MnSO4 + CO2 +H2SO4
Составление уравнений
Составление уравнений
окислительновосстановительных реакций
окислительновосстановительных реакций
в органической химии
в органической химии
реакция горения нбутана CC44HH1010 + O + O22
22 + H + H22OO
метод электронного баланса
метод электронного баланса
CO→
CO→
0 + 4e
4C→ +4 2 окисление
Среднее значение степени окисления атома углерода в нбутане 2,5
4C2,5 – 26e
O2
или расставим степени окисления у каждого атома CH3
2C3 – 14e
2C2 – 12e
→ 2C+4 2 окисление
→ 2C+4
2O→ 2 13 восстановление
3 – CH2
2 – CH2
2 – CH3
3
O2
0 + 4e
2O→ 2 13 восстановление
метод протоннокислородного баланса
метод протоннокислородного баланса
→ 4CO2
0 + 10H+ 2 окисление
0 + 8O2 – 26e
C4H10
O2
0
+ 4e
2O→ 2 13 восстановление
4C4C44HH1010 + 13O
+ 13O2 2
8CO→ 8CO→
+ 10H22OO
22 + 10H
Н.В.Горбенко
CC66HH1212OO66 + KMnO
+ KMnO44 + H + H22SOSO44
+ MnSO44 + K + K22SOSO4 4 + H+ H22OO
22 + MnSO
CO→
CO→
метод электронного баланса
метод электронного баланса
Рассчитаем среднюю степень окисления углерода в глюкозе: C6
6C0 – 24e
Mn+7 +5e
6C→ +4 5 окисление
Mn→ +2 24 восстановление
0 H12
+1 O6
2
C6H12O6 + 6H2O 24e
MnO4 + 8H+ + 5e
метод полуреакций
метод полуреакций
6CO→
2 + 24H+ 5 окисление
Mn→ 2+ + 4H2O 24 восстановление
C6H12O6 + 30H2O + 24MnO4
+ 192H+
→
30CO
2 + 120H+ + 24Mn2+ + 96H2O
метод протоннокислородного баланса
метод протоннокислородного баланса
6→ СO2 + 12H+ 5 окисление
C6H12O6 + 6O2 24e
MnO4 + 5e
→
Mn2+ + 4O
55CC66HH1212OO66 +
+ 2424KMnOKMnO44 +
+ 3636HH22SOSO44
2 24 восстановление
→ 3030COCO22 +
→
+ 2424MnSOMnSO44 +
+ 1212KK22SOSO44 +
+ 6666HH22OO
Н.В.Горбенко
СС22HH4 4 + KMnO
→
→O
+ KMnO44 + H + H22O
метод электронного баланса
метод электронного баланса
– CH22 –OH + MnO
22 – CH
HO – CH
HO – CH
–OH + MnO22 + KOH
+ KOH
С2H2 = C2H2 + KMn+7O4 + H2O
2C2 – 2e
Mn+7 +3e
2C→ 1 3 окисление
Mn→ +4 2 восстановление
HO – C
→
1H2 – C1H2 –OH + Mn+4O2 + KOH
метод полуреакций
метод полуреакций
C2H4 + 2H2O 2e
MnO4
+ 2H2O +3e
C→ 2H4(OH)2 + 2H+ 3
MnO→
2 + 4OH 2
метод протоннокислородного баланса
метод протоннокислородного баланса
C2H4 + 2O2 + 2H+ 2e
MnO4
MnO→
+3e
C→ 2H4(OH)2 3
2 + 2O2 2
33СС22HH4 4 + 2KMnO
+ 2KMnO44 +4 H
→
→O
+4 H22O
3HO – CH
3HO – CH
– CH22 –OH + 2MnO
22 – CH
–OH + 2MnO22 + 2KOH
+ 2KOH
Н.В.Горбенко

Из приведенного ниже списка веществ выберите
реагент, с помощью которого можно осуществить
превращения:
а) этанола в этаналь;
б) этаналя в этанол;
в) этаналя в уксусную кислоту;
г) ацетилена в этаналь.
Реагенты:
водород,
перманганат калия.
Составьте схемы реакций, укажите условия их
осуществления. Составьте
электронного
CH→
CH→
CHO + Cu + H22OO
а)а)CC22HH55OH + CuO
OH + CuO
33CHO + Cu + H
баланса для данных реакций, и докажите, что они
б) б) CHCH33CHOCHO + Н + Н22 →→ CC22HH55OHOH
относятся к ОВР.
в)в)55 CHCH33CHOCHO +
г) г) CC22HH22 + H + H22O
+ 22ККMnOMnO4 4 + 3H+ 3H22SOSO44 → → 5CH5CH33COOH + K
CH→
CH→O
оксид меди
схемы
COOH + K22SOSO44 + 2MnSO
+ 2MnSO44 + 3H
+ 3H22OO
вода,
(II),
33CHOCHO
25
Из приведенного ниже списка веществ выберите реагент, с помощью которого можно осуществить превращения:а) этанола в этаналь;б) этаналя в этанол; в) этаналя в уксусную кислоту;г) ацетилена в этаналь.Реагенты: водород, вода, оксид меди (II), перманганат калия.Составьте схемы реакций, укажите условия их осуществления. Составьте схемы электронного баланса для данных реакций, и докажите, что они относятся к ОВР.
в
молекулах
В концентрированном растворе щелочи
альдегиды,
которых
отсутствуют атомы водорода, соединенные
с α-углеродными, вступают в окислительно-
восстановительную
реакцию
(реакция
диспропорционирования
Канниццаро).
реакции
образуются соответствующий альдегиду
кислоты.
спирт
и
реакции
Составьте
диспропорционирования в водном растворе
щелочи следующих альдегидов:
2,2-диметилпропаналя;
а)
бензальдегида.
карбоновой
результате
уравнения
В
соль
б)
26
В концентрированном растворе щелочи альдегиды, в молекулах которых отсутствуют атомы водорода, соединенные с α-углеродными, вступают в окислительно-восстановительную реакцию диспропорционирования (реакция Канниццаро). В результате реакции образуются соответствующий альдегиду спирт и соль карбоновой кислоты. Составьте уравнения реакции диспропорционирования в водном растворе щелочи следующих альдегидов:а) 2,2-диметилпропаналя; б) бензальдегида.
Напишите схему реакции окисления
уксусного альдегида:
а) водным раствором перманганата
калия
б) раствором дихромата калия в
присутствии серной кислоты.
Составьте
баланса
коэффициенты
реакции.
электронного
определите
уравнении
в
схему
и
27
Напишите схему реакции окисления уксусного альдегида:а) водным раствором перманганата калияб) раствором дихромата калия в присутствии серной кислоты.Составьте схему электронного баланса и определите коэффициенты в уравнении реакции.
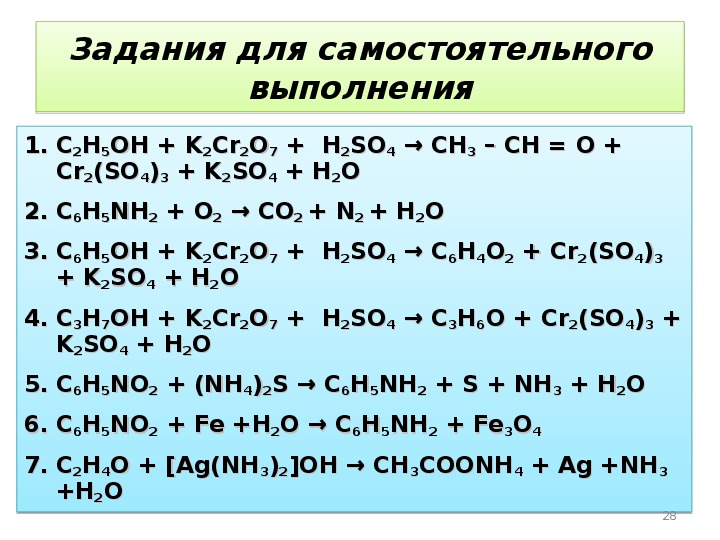
Задания для самостоятельного
выполнения
OH + K22CrCr22OO77 + H + H22SOSO44 → CH
1.1. CC22HH55OH + K
CrCr22(SO(SO44))33 + K + K22SOSO44 + H + H22OO
→ CH33 – CH = O +
– CH = O +
→ CO2 2 + N+ N2 2 + H+ H22OO
2.2. CC66HH55NHNH22 + O + O22 → CO
3.3. CC66HH55OH + K
+ K+ K22SOSO44 + H + H22OO
OH + K22CrCr22OO77 + H + H22SOSO44 → C → C66HH44OO22 + Cr
+ Cr22(SO(SO44))33
4.4. CC33HH77OH + K
KK22SOSO44 + H + H22OO
OH + K22CrCr22OO77 + H + H22SOSO44 → C → C33HH66O + Cr
O + Cr22(SO(SO44))33 +
+
5.5. CC66HH55NONO22 + (NH
6.6. CC66HH55NONO22 + Fe +H
7.7. CC22HH44O + O + [Ag(NH
+ (NH44))22S → C
+ Fe +H22O → CO → C66HH55NHNH22 + Fe
]OH → CH→ CH33COONH
[Ag(NH33))22]OH
S → C66HH55NHNH22 + S + NH
+ S + NH33 + H + H22OO
+ Fe33OO44
COONH44 + Ag +NH
+ Ag +NH33
+H+H22OO
28
Задания для самостоятельного выполнения1.1.CC22HH55OH + KOH + K22CrCr22OO77 + H + H22SOSO44 → CH → CH33 – CH = O + – CH = O + CrCr22(SO(SO44))33 + K + K22SOSO44 + H + H22OO2.2.CC66HH55NHNH22 + O + O22 → CO → CO2 2 + N+ N2 2 + H+ H22OO3.3.CC66HH55OH + KOH + K22CrCr22OO77 + H + H22SOSO44 → C → C66HH44OO22 + Cr + Cr22(SO(SO44))33 + K+ K22SOSO44 + H + H22OO4.4.CC33HH77OH + KOH + K22CrCr22OO77 + H + H22SOSO44 → C → C33HH66O + CrO + Cr22(SO(SO44))33 + + KK22SOSO44 + H + H22OO5.5.CC66HH55NONO22 + (NH + (NH44))22S → CS → C66HH55NHNH22 + S + NH + S + NH33 + H + H22OO6.6.CC66HH55NONO22 + Fe +H + Fe +H22O → CO → C66HH55NHNH22 + Fe + Fe33OO447.7.CC22HH44O + O + [Ag(NH[Ag(NH33))22]OH ]OH → CH→ CH33COONHCOONH44 + Ag +NH + Ag +NH33 +H+H22OO
Расстановка коэффициентов в
уравнениях реакций окисления
органических веществ
• Написать уравнение реакции
окисления пентадиена-1,4
перманганатом калия в кислой
среде.
1) Отмечаем какой задан
окислитель и какая среда
протекания реакции:
– среда кислая, окислитель KMnO4
29
Расстановка коэффициентов в уравнениях реакций окисления органических веществ•Написать уравнение реакции окисления пентадиена-1,4 перманганатом калия в кислой среде.1) Отмечаем какой задан окислитель и какая среда протекания реакции: – среда кислая, окислитель KMnO4

2) Записываем схему реакции (с
учетом структуры окисляемого
соединения),
определяем продукты реакции (с
учетом заданной среды и окислителя)
• – в окисляемой молекуле две концевых
:
двойных связи, следовательно, произойдет
разрыв этих двойных связей, и в результате
образуются две молекулы углекислого газа
(из концевых атомов углерода). Углеродный
скелет неразветвленный, поэтому при
окислении 2-го и 4-го атомов углерода
образуются карбоксильные группы. Схема
реакции следующая:
O
KMnO4
H2SO4
CH2 CHCH2CH CH2
CCH2C
O
+
HO
2 CO2
OH
30
2) Записываем схему реакции (с учетом структуры окисляемого соединения), определяем продукты реакции (с учетом заданной среды и окислителя) :•– в окисляемой молекуле две концевых двойных связи, следовательно, произойдет разрыв этих двойных связей, и в результате образуются две молекулы углекислого газа (из концевых атомов углерода). Углеродный скелет неразветвленный, поэтому при окислении 2-го и 4-го атомов углерода образуются карбоксильные группы. Схема реакции следующая:
3) Запишем схему полуреакции
окисления:
C5H8
2 CO2 + C3H4O4
• Учитывая, что реакция проводится в кислой
среде, уравниваем число атомов кислорода:
C5H8
2 CO2 + C3H4O4
+ 8 H2O
• Уравниваем число атомов водорода:
2 CO2 + C3H4O4
+ 8 H2O
C5H8
+ 20 H+
• Уравниваем заряды
C5H8
+ 8 H2O
20 e
2 CO2 + C3H4O4
+ 20 H+
31
3) Запишем схему полуреакции окисления: •Учитывая, что реакция проводится в кислой среде, уравниваем число атомов кислорода:•Уравниваем число атомов водорода:•Уравниваем заряды
4) Записываем уравнение
полуреакции восстановления:
• Составляем схему:
MnO4- → Mn+2
• Учитывая кислую среду
(с
реакции, уравниваем
помощью ионов Н+) количество
кислорода.
• Затем уравниваем заряды:
MnO4- + 8Н+ + 5е → Mn+2 +
4Н2О
32
4) Записываем уравнение полуреакции восстановления:•Составляем схему: MnO4- → Mn+2•Учитывая кислую среду реакции, уравниваем (с помощью ионов Н+) количество кислорода. •Затем уравниваем заряды: MnO4- + 8Н+ + 5е → Mn+2 + 4Н2О
5) Уравниваем число принятых и
отданных электронов, суммируем
две полуреакции с учетом
найденных коэффициентов:
20 e
C5H8
MnO4
+ 8 H2O
+ 8H+ + 5e
2 CO2 + C3H4O4
+ 20 H+
Mn2+ + 4H2O
1
4
C5H8
+
8 H2O
+ 4 MnO4
+ 32 H+
2 CO2
+
C3H4O4
+20 H+ + 4 Mn2+ + 16 H2O
33
5) Уравниваем число принятых и отданных электронов, суммируем две полуреакции с учетом найденных коэффициентов:
6) Записываем полное уравнение
реакции и проверяем равенство
количества атомов кислорода в
обеих частях уравнения:
C5H8 + 4KMnO4 + 6H2SO4 =
= 2CO2 + C3H4O4 + 2K2SO4 +
4MnSO4 + 8H2O
34
6) Записываем полное уравнение реакции и проверяем равенство количества атомов кислорода в обеих частях уравнения: C5H8 + 4KMnO4 + 6H2SO4 = = 2CO2 + C3H4O4 + 2K2SO4 + 4MnSO4 + 8H2O
Задания для самостоятельного
решения:
Составьте уравнения реакций по
следующим схемам, расставьте
коэффициенты:
1) C6H5CH=CH2 + KMnO4 + H2O
2) C6H5CH=CH2 + KMnO4 + H2SO4
3) C6H5CH=CHCH2CH3 + KMnO4 + H2SO4
4) CH3CH=C(CH3)CH2CH3 + KMnO4 + H2SO4
5) CH3CH(OH) CH2CH3 + KMnO4
6) C6H4(CH3)2 + K2Cr2O7 + H2SO4
7) HCOOH + Cu(OH)2
35
Задания для самостоятельного решения:Составьте уравнения реакций по следующим схемам, расставьте коэффициенты:1) C6H5CH=CH2 + KMnO4 + H2O 2) C6H5CH=CH2 + KMnO4 + H2SO4 3) C6H5CH=CHCH2CH3 + KMnO4 + H2SO4 4) CH3CH=C(CH3)CH2CH3 + KMnO4 + H2SO4 5) CH3CH(OH) CH2CH3 + KMnO46) C6H4(CH3)2 + K2Cr2O7 + H2SO4 7) HCOOH + Cu(OH)2

Ответы
1) 3C6H5CH=CH2 + 2 KMnO4 + 4H2O
3C6H5CH(OH)CH2OH + 2MnO2↓ + 2KOH
2) C6H5CH=CH2 + 2KMnO4 + 3H2SO4 C6H5COOH +
CO2↑ + 2MnSO4 + 4H2O + K2SO4
3) 5C6H5CH=CHCH2CH3 + 8KMnO4 + 12H2SO4
5C6H5COOH + 5C2H5COOH + 8MnSO4 +12H2O +
4K2SO4
4) 5CH3CH=C(CH3)CH2CH3 + 6KMnO4 + 9H2SO4
5CH3COOH + 5 CH3C(O)C2H5 + 6MnSO4 +9H2O +
3K2SO4
5) 3CH3CH(OH) CH2CH3 + 3KMnO4 3CH3C(O)C2H5 +
2MnO2↓ + 2KOH + 2H2O
6) C6H4(CH3)2 + 2K2Cr2O7 + 8H2SO4 C6H4(COOH)2 +
2K2SO4+ 2Cr2(SO4)3 + 10H2O
7) HCOOH + 2Cu(OH)2 CO2↑ + Cu2O↓+ 3H2O
36
Ответы 1) 3C6H5CH=CH2 + 2 KMnO4 + 4H2O 3C6H5CH(OH)CH2OH + 2MnO2↓ + 2KOH2) C6H5CH=CH2 + 2KMnO4 + 3H2SO4 C6H5COOH + CO2↑ + 2MnSO4 + 4H2O + K2SO43) 5C6H5CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 5C6H5COOH + 5C2H5COOH + 8MnSO4 +12H2O + 4K2SO44) 5CH3CH=C(CH3)CH2CH3 + 6KMnO4 + 9H2SO4 5CH3COOH + 5 CH3C(O)C2H5 + 6MnSO4 +9H2O + 3K2SO45) 3CH3CH(OH) CH2CH3 + 3KMnO4 3CH3C(O)C2H5 + 2MnO2↓ + 2KOH + 2H2O6) C6H4(CH3)2 + 2K2Cr2O7 + 8H2SO4 C6H4(COOH)2 + 2K2SO4+ 2Cr2(SO4)3 + 10H2O7) HCOOH + 2Cu(OH)2 CO2↑ + Cu2O↓+ 3H2O
