
Тема урока: Приготовление раствора соли с
определенной массовой долей растворенного вещества
Цель:
приготовить раствор с заданной массовой долей растворенного вещества путем
растворения рассчитанной массы твердого вещества в определенном объеме воды.
Задачи:
1. образовательные: закрепить и проверить умения решать задачи прикладного
характера на вычисление массы растворенного вещества и объема воды;-
научить учащихся приготавливать растворы веществ, имеющих практическое
значение в повседневной жизни.-
2.воспитательные: воспитывать ответственное отношение к выполнению своей
работы, наблюдательность, настойчивость-
воспитывать культуру поведения в мире веществ.-
3. развивающие: развивать умения переносить знания о растворах в новые условия;-
развивать коммуникативные качества учащихся: способность к сотрудничеству,
взаимопомощи, делового общения.
Тип
урока: практическая работа
Оборудование: химический стакан, мерный цилиндр,
ложечка для сыпучих веществ, стеклянная палочка, склянка под приготовленный
раствор.
Реактивы. NaCl, Н3ВO3, СuSO4, NaHCO3
– все кристаллические, 30%-й раствор NaOH, дистиллированная (кипяченая) вода.
Подготовить для приготовляемых растворов склянки с этикетками, на которых формула изображена в цвете: для кислот – красным, для солей – черным, для щелочей – синим.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
|
|
|
Запрещается пробовать вещества на вкус (а), |
ХОД УРОКА
В письменном отчете записываются название темы, цели,
оборудование, реактивы (4–5 мин).
Предлагается несколько вариантов расчетных задач для приготовления растворов и
пример решения задачи.
Вариант № 1 Определите массы воды и борной кислоты, необходимые для приготовления 50 г раствора с массовой долей кислоты 0,02. Где применяют данный раствор?
Вариант № 2 Какие массы гидрокарбоната натрия и воды надо взять, чтобы приготовить раствор массой 50 г с массовой долей соли 10%? Где используют данный раствор?
Вариант № 3 В 45 г воды растворено 5 г NaCl. Вычислите массовую долю растворенного вещества в растворе. Для чего необходим этот раствор в быту и лаборатории?
Вариант № 4*
Рассчитайте массы воды и безводного сульфата меди, необходимые для приготовления 100 мл раствора, содержащего 8% соли. плотность раствора – 1,084 г/мл. Где применяют полученный раствор?
Вариант № 5*
Какую массу воды нужно добавить к 100 мл 30%-го раствора
гидроксида натрия (![]() =
1,33 г/мл) для получения 10%-го раствора щелочи, используемого в лаборатории?
=
1,33 г/мл) для получения 10%-го раствора щелочи, используемого в лаборатории?
Пример решения задачи
Вычислите массы соли и воды, которые потребуются для приготовления 50 г раствора хлорида натрия, содержащего 0,1 массовой доли соли.

Этапы выполнения работы
1. После произведенных расчетов по одному из вариантов оформите их
в тетради (6–7 мин).
2. Отвесьте рассчитанное количество вещества и поместите его в стакан
объемом 100 мл или колбу на 200 мл.
Помните! К соли приливают воду! Кислоту добавляют в воду при постоянном
перемешивании!
Пример. 0,9%-й раствор NaCl называется физиологическим. Применяется для инъекций.
Домашнее задание
Задача. Определите массу воды, которую нужно добавить к 50 г раствора с массовой долей соли 5%, чтобы получить раствор с массовой долей соли 2%.
Образцы
отчета о проделанной
практической работе
Вариант № 1
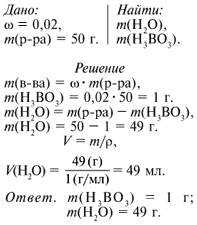
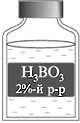
Взвешиваю 1 г борной кислоты, помещаю его в стакан и добавляю к
веществу воды до метки 50 мл. Вещество растворяется в воде. Для его лучшего
растворения перемешиваю раствор стеклянной палочкой. Переливаю раствор в
приготовленную склянку с этикеткой.
Раствор борной кислоты используют в медицине как дезинфицирующее средство.
В лаборатории он хранится в аптечке для промывания глаз в случае попадания в
них щелочи.
Вариант № 2

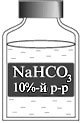
Взвешиваю 5 г гидрокарбоната натрия и помещаю в химический стакан
вместимостью 50 мл (или 100 мл). Добавляю воды до метки 50 мл. Вещество
растворяется. для его полного растворения перемешиваю раствор стеклянной
палочкой. Получила 10%-й раствор NaHCO3. Переливаю раствор в склянку
с этикеткой.
Полученный раствор используют для обработки кожного покрова в случае попадания
на него кислоты.
Вариант № 3
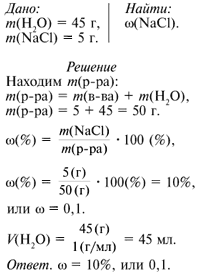

Взвешиваю на весах 5 г хлорида натрия и помещаю соль в химический
стакан. Мерным цилиндром отмериваю 45 мл воды и добавляю к соли. Для лучшего
растворения соли перемешиваю раствор стеклянной палочкой. Переливаю раствор в
приготовленную склянку.
Раствор используют в быту для засолки огурцов и квашения капусты. В лаборатории
раствор NaCl используют как реактив для проведения химическиx реакций.
Вариант № 4*
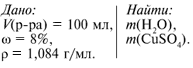

Взвешиваю на весах 8,7 г соли CuSO4. Отмериваю мерным
цилиндром 100 мл воды и переливаю в стакан с солью. Перемешиваю раствор
стеклянной палочкой. Приготовленный раствор переношу в склянку с этикеткой.
Раствор используют для борьбы с вредителями сельскохозяйственных культур.
Вариант № 5*

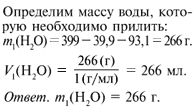
 Добавим
к выданному 30%-му раствору щелочи 266 мл воды. Получили 10%-й раствор NаОН.
Добавим
к выданному 30%-му раствору щелочи 266 мл воды. Получили 10%-й раствор NаОН.
Внимание! Если для приготовления растворов берут щелочь в
кристаллическом виде, тогда щелочь добавляют в воду.
Раствор используют в химической лаборатории для проведения химических реакций.
Вывод. Рассчитав массу вещества и объем воды, приготовили раствор с
заданной концентрацией растворенного вещества, используя операции: взвешивание,
отмеривание объема жидкости, растворение. Растворы широко применяются в быту и
народном хозяйстве.
Домашнее задание
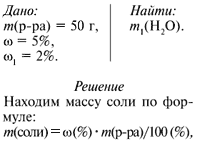

Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.