ПРЕЗЕНТАЦИЯ ПО ХИМИИ НА ТЕМУ "АЛКАНЛАР"
Презентации учебные
pptx
химия
9 кл
19.04.2019
Topshiriq. Nima uchun konsentrlangan nitrat va sulfat kislotalar temir idishlarda saqlanadi?
A.Odatdagi haroratda konsentrlangan nitrat va sulfat kislotalar temirni passivlashtiradi.
B. Odatdagi haroratda konsentrlangan nitrat va sulfat kislotalar temirni faollashtiradi.
C. Odatdagi haroratda konsentrlangan nitrat va sulfat kislotalar temirni yuzasida birikma hosil qilmaydi.
D. Yuqori haroratda konsentrlangan nitrat va sulfat kislotalar temirni passivlashtiradi.
Kimyoviy element
(DOK -2)
Meni yomon ko’rishar,
Lek baribir xush ko’rar
Sarg’aysamda tez ora,
Meni har kun qo’llashar.
Topshiriq.She'riy topishmoqni javobini toping! Javob: (Temir)
Temir va uning birikmalari
Алкины.pptx
1.
История
открыти
я
АЛКИН
Ы
2.Номенклатура
алкинов
3.Структура
тройной связи
4.Физи
ческие
свойств
а
5. Нахождение
в природе и
физиологическ
ая роль
алкинов
6.
Способы
получения
8. Идентификация
алкинов
9.Применение
7.
Химические
свойства
10.
Литерату
ра
3.Структура тройной связи6. Способы получения1. История открытия
Алкии́ны (иначе ацетиле
новые
углеводороды) — углеводо
роды,
содержащие тройную
связь между атомами угле
рода, образующие
гомологический ряд с
общей формулой CnH2n-2.
Атомы углерода при
тройной связи находятся в
состоянии sp-
гибридизации.
Впервые ацетилен был получен
в 1836 году Эдмундом Дэви,
двоюродным братом
знаменитого английского
химика Гемфри Дэви,
нагреванием уксуснокислого
калия с древесным углем и
последующей реакцией с водой
образовавшегося карбида
калия Дэви назвал свой газ
«двууглеродистым водородом».
В 1862 году немецкий химик и
врач Ф. Вёлер вновь
открыл ацетилен, действуя
водой на карбид кальция.
1. История открытия
Для алкинов характерны
реакцииприсоединения.
В отличие от алкенов,
которым свойственны
реакции
электрофильного
присоединения, алкины
могут вступать также и
вреакции
нуклеофильногоприсоеди
нения.
В 1863 году французский
химик М.
Бертло получил ацетилен,
пропуская водород над
раскаленными электрической
дугой графитовыми
электродами. Именно он дал
газу имя ацетилен (от
латинских слов acetum —
уксус и греческого иле —
дерево). Русское название
«ацетилен» впервые было
применено
Д. И. Менделеевым
1. История открытияАлкии́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
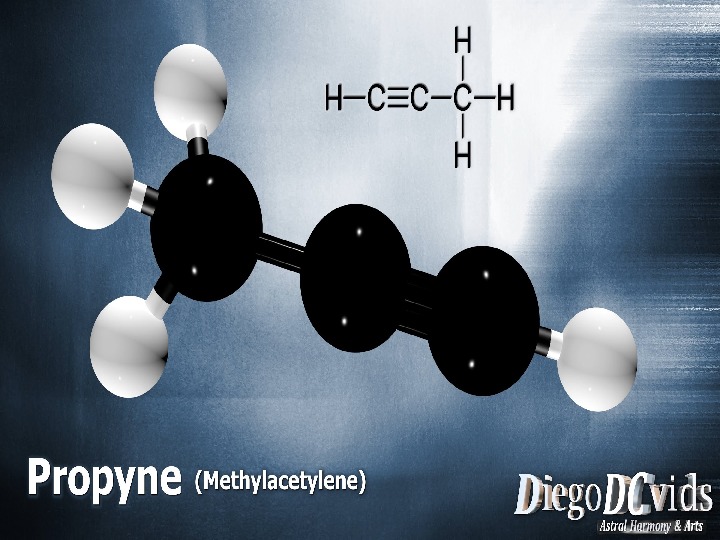
Простейшим
алкином
является этин
(ацетилен
C2H2).
2.Номенклатура
алкинов
По
номенклатуре IUPAC
названия алкинов
образуются от
названий
соответствующих
алканов заменой
суффикса «-ан» на «-
ин»
положение
тройной связи
указывается
арабскими
цифрами.
Углеводородные
радикалы, образованные
от алкинов имеют
суффикс «инил»,
так CH C называется
≡
«этинил».
Ниже
представлены
некоторые
представители
алкинов и их
названия:
Простейшим алкином является этин (ацетилен C2H2). положение тройной связи указывается арабскими цифрами.Ниже представлены некоторые представители алкинов и их названия:
У алкинов связь −С≡С−
линейна (угол 180°) и
находится в одной
плоскости.
Атомы углерода связаны
одной σ- и двумя π-
связями, максимальная
электронная плотность
которых расположена в
двух взаимно
перпендикулярных
плоскостях
Длина тройной
связи примерно
0,121 нм,
энергия связи
836 кДж/моль.
4.Физические свойства
Бут-2-ин
Формул
а
С2H2
C3H4
Т
кипения,
°С
−75
−23
8,1
Т
плавлен
ия,°С
−81,8
−101,5
−125,9
Физические свойства некоторых алкинов
Названи
е
Этин
Пропин
Бут-1-ин HC≡C−C
H2CH3
CH3−C≡C
−CH3
HC≡C−C3
Пент-1-и
H7
н
CH3−C≡C
Пент-2-и
−C2H5
н
3-
HC≡C−C
Метилбут
H(CH3)CH3
-1-ин
Гекс-1-ин HC≡C−C4
27,0
39,3
55,0
−132,4
71,4
−32,3
−90,0
н/д
28,0
−101,0
H9
4
Плотнос
ть, d20
0,565*
0,670*
0,678*
0,694
0,695
0,714
0,665
0,719
№
1
2
3
4
5
6
7
8
Алкины по своим
физическим
свойствам
напоминают
соответствующие
алкены. Низшие (до
С4) — газы без цвета и
запаха, имеющие
более высокие
температуры
кипения, чем аналоги
в алкенах. Алкины
плохо растворимы в
воде, лучше — в
органических
растворителях.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
5. Нахождение в природе и
физиологическая роль алкинов
В природе алкины
практически не
встречаются. В
некоторых видах грибов
Basidiomycetesбыли
обнаружены в крайне
малом количестве
соединения,
содержащие
структуры.
полиацетиленовые
Ацетилен
обнаружен в
атмосфере Уран
а Юпитера
и Сатурна.
Алкины обладают
слабым наркозным
действием. Жидкие
вызывают судороги
алкины
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetesбыли обнаружены в крайне малом количестве соединения, содержащие полиацетиленовые структуры.Ацетилен обнаружен в атмосфере Урана Юпитера и Сатурна.Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги
6. Способы получения
6.1
Карбидны
й метод
(промышл
енный
способ)
6.6
и
Дегидрогалоген
ирование
галогеналканов
галогеналкенов
(лабораторный
способ)
6.2 Пиролиз
углеводород
ов
(промышлен
ный способ)
6.5 Электролиз
солей
непредельных
карбоновых
кислот
6.7
Алкилировани
е алкинов
(лабораторны
й способ)
6.3 Крекинг
природного
газа
(промышленн
ый способ)
6.3.2Терм
о-
окислител
ьный
крекинг
6.4 Метод
прямого
синтеза
6.3.1
Электрок
рекинг
6.8 Прочие
лаборатор
ные
способы
получения
алкинов
6. Способы получения6.5 Электролиз солей непредельных карбоновых кислот
При действии
на
полученный
карбид воды
образуется ги
дроксид
кальция и аце
тилен:
6.1
Карбидны
й метод
(промышл
енный
способ)
Прокаливанием в
электрических печах
смеси оксида
кальция с коксом при
1800—2000°С
получают карбид
кальция:
CaO+ 3C → CaC2 + CO
CaC2 + 2H2O → C2H2 +Ca(OH)2
Суть способа заключается в пропускании над
специальной огнеупорной насадкой
смеси природного газа с воздухом, который
сгорая поднимает температуру до 1500 °C.
Затем на насадке происходит пиролиз
метана.
C→ 2H2 + 3H2
2CH4
6.3 Крекинг
природного
газа
(промышлен
ный способ)
6.3.2
Термо-
окислительны
й крекинг
6.2 Пиролиз
углеводород
ов
(промышлен
ный способ)
6.3.1
Электрокрек
инг
Метод заключается в
пропускании метана между
двумя металлическими
электродами с огромной
скоростью. Температура
1500—1600°С. С химической
точки зрения метод
аналогичен методу
пиролиза, отличаясь лишь
технологическим и
аппаратным исполнением
В этом методе используется частичное
окисление метана благодаря использованию
теплоты, образующейся при его сгорании
6CH4 +4O2 → C2H2 + 8CO + CO2 + 3H2O
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана.2CH4 C→2H2 + 3H26.3.1 Электрокрекинг6.3.2Термо-окислительный крекинг
6.4 Метод
6.4 Метод
прямого
прямого
синтеза
синтеза
Углерод напрямую
взаимодействует с водородом при
очень высоких температурах:
2C + H2 → C2H2
Этот метод имеет чисто историческое
значение (получение ацетилена в 1863
году М. Бертлo)
олучил
ацетилен
электролизом
фумарата и
В 1864
году Кекуле п
малеата
натрия
6.5 Электролиз солей
непредельных карбоновых
кислот
Аналогично
получается
ацетилен и
из акрилата н
атрия.
Этот метод
носит чисто
историческое
значение.
NaOOCCH =CHCOONA + 2H2O → C2H2 + 2CO2 + 2NaOH + H2
Углерод напрямую взаимодействует с водородом при очень высоких температурах:2C + H2 → C2H2Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертлo)6.5 Электролиз солей непредельных карбоновых кислотВ 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрияАналогично получается ацетилен и из акрилата натрия.Этот метод носит чисто историческое значение.
6.6
Дегидрогалоге
нирование
галогеналканов
Реакция дегидрогалогенирования проводят
действием сильного основания на
дигалогеналканы:
и
галогеналкенов
(лабораторный
способ)
В качестве дегидрогалогенирующего агента
удобно использовать амид натрия в жидком аммиаке
6.7
Алкилировани
е алкинов
(лабораторны
й способ)
Алкилирование алкинов с концевой тройной
связью производится по следующей схеме:
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:
6.8 Прочие
лабораторные
способы
получения
алкинов
Реакция Кори-Фукса— синтез алкинов
из альдегидов
На первой стадии идет образование
дибромалкена:
На второй стадии
происходит
отщепление брома:
Разложение
дигидразонов[
Реакция Кори-Фукса— синтез алкинов из альдегидовНа первой стадии идет образование дибромалкена:На второй стадии происходит отщепление брома:Разложение дигидразонов[
7. Химические свойства
Образование алкинидов
Алкины с концевой тройной
чем аммиак и алкены но
которые с очень сильными
связью являются С-H
кислотами (сильнее
слабее, чем спирты)
основаниями могут
образовывать соли —
алкиниды
Реакция алкинов с
аммиакатами серебра или
одновалентной меди является
качественной на наличие концевой
тройной связи
собой осадок белого
Пропинид серебра представляет
цвета, пропинид меди — осадок
наконец, диацетиленид меди—
жёлтого цвета,
алкина
осадок красного цвета.
Алкинид серебра легко
растворяется при
добавлении цианида натрия с
выделением соответствующего
Образование алкинидовАлкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли — алкинидыРеакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связиПропинид серебра представляет собой осадок белого цвета, пропинид меди — осадок жёлтого цвета, наконец, диацетиленид меди— осадок красного цвета.Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина
Реакции нуклеофильного замещения алкинидов
Алкиниды являются сильными нуклеофилами и легко вступают
в реакции нуклеофильного замещения:
Получение алкингалогенидов
Действием галогена на монозамещенные ацетилены в щелочной
среде можно получить галогеналкины
Хлорированием
ацетилена хлоридом меди
(II) в водных растворах CuCl
можно получить
Электрофильное
дихлорацетилен
присоединение к
алкинам инициируется
под воздействием
положительно
заряженной
частицы — электрофил
а.катализатором таких
реакций являются
кислоты.
Получение
ацетиленаминов
Получение алкингалогенидовДействием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкиныХлорированием ацетилена хлоридом меди (II) в водных растворах CuCl можно получить дихлорацетиленПолучение ацетиленаминов
Реакции галогенирования
Галогенирование
алкинов идет
как транс-
кенов.
присоединение (как
правило) и протекает
по аналогии с
галогенированием ал
Алкины способны
присоединять одну или
две молекулы галогена
с образованием
соответствующих
галогенпроизводных:
Реакции гидрогалогенирования
Реакции галогенированияАлкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
В присутствии солей ртути алкины присоединяют воду с
образованием ацетальдегида (для ацетилена) или кетона (для
прочих алкинов). Эта реакция известна как реакция Кучерова
Гидратация.
Реакции карбонилирования были
открыты в лаборатории Реппе в 1939
году
Катализатором реакции
являются карбонилы никеля
или палладия
Отдельно стоит упомянуть
реакцию оксилительного
карбохлорирования:
Гидратация.В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна как реакция КучероваКатализатором реакции являются карбонилы никеля или палладияОтдельно стоит упомянуть реакцию оксилительного карбохлорирования:
Типовые реакции нуклеофильного
присоединения
Характерным примером
реакции нуклеофильного
присоединения является
Реакция Фаворского –
присоединение спиртов в
присутствии щелочей с
образованием
алкенильных эфиров:
Первичные амины под
действием оснований
присоединяются к
алкинам с образованием
иминов
По аналогии
ацетилен реагирует с
аммиаком, образуя
этилденимин.
CH3C ≡ CH + C2H5 OH → CH3 – (OC2H5) =
CH2
RC ≡ CH + R’ NH2 → RCH2 –
CH = NR’
HC ≡ CH + NH3 → CH3 –
CH = NH
Типовые реакции нуклеофильного присоединенияCH3C ≡ CH + C2H5 OH → CH3 – (OC2H5) = CH2RC ≡ CH + R’ NH2 → RCH2 – CH = NR’
CH3 – CH = NH → CH3 – C ≡
N + H2
В среде очень сильных
оснований (например: КОН
+ ДМСО) ацетилен
реагирует с
сероводородом, образуя
дивинилсульфид
CH3-C ≡ CH+HCL →CH3-
CH=CHCL
При высокой температуре
в присутствии
катализатора имин
дегидрируется и
превращается в
ацетонитрил:
2HC ≡ CH + H2S → (CH2
= CH)2S
Реакции радикального
присоединения
В присутствии перекисей
или других условиях,
способствующих
образованию свободных
радикалов, присоединение
к алкинам идет по
радикальному механизму –
против правила
Марковникова (эффект
Караша)
При высокой температуре в присутствии катализатора имин дегидрируется и превращается в ацетонитрил:CH3 – CH = NH → CH3 – C ≡ N + H2
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
19.04.2019
© ООО «Знанио»
С вами с 2009 года.
![]()
О портале

