
Комитет по делам образования города Челябинска
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «ГИМНАЗИЯ № 10 г. ЧЕЛЯБИНСКА»
Проектная работа
«Алгоритмы решения расчётных задач по химии с нахождением молекулярной формулы вещества»
Тип проекта: информационно-познавательный
Выполнила:
Лабзова Дарья Васильевна,
ученица 9 -б класса
Руководитель проекта: Шумовская Людмила Петровна
Челябинск, 2020г.
Содержание
Введение 3
Основная часть 5
I.1. Теоретическая часть 5
I.1.1. Основные понятия, которые нужно знать для решения
подобных химических задач 5
I.1.2. Молекулярная и простейшая формулы вещества.
Определение простейшей формулы вещества. 7
I.1.3. Определение молекулярной формулы вещества
по массовым долям образующих его элементов. 9
I.1.4. Определение молекулярной формулы вещества с
использованием плотности или относительной плотности газов. 12
I.1.5. Определение молекулярной формулы вещества по
продуктам его сгорания 14
I.1.6. Определение молекулярной формулы вещества по
отношению атомных и молекулярных масс элементов,
входящих в состав вещества 16
I.1.7. Определение молекулярной формулы вещества по его
плотности и массовым долям элементов 17
II.1.Практическая часть 19
II.1.1.Подборка задач 19
Заключение 27
Список источников 28
Приложения 29
ПриложениеА. Физические величины 29
ПриложениеБ. Формулы 30
Введение
Одним из показателей того, насколько хорошо учащийся владеет полученным материалом по химии, является умение решать задачи. Решение задач позволяет расширять кругозор учащихся, развивать умение логически мыслить, анализировать, делать правильные выводы и устанавливать связь химии с другими науками, такими как математика, физика, биология.
Независимо от типа задачи и подхода к её решению выделяют четыре основные этапа: анализ условия задачи, составление плана решения, выполнение решения по заданному плану и проверка решения.
В моём проекте будут рассматриваться алгоритмы решения задач на:
· Определение простейшей и молекулярной формулы вещества
· Определение молекулярной формулы вещества по массовым долям образующих его элементов
· Определение молекулярной формулы вещества с использованием плотности или относительной плотности газов
· Определение молекулярной формулы вещества по продуктам его сгорания
· Определение молекулярной формулы вещества по отношению атомных и молекулярных масс элементов, входящих в состав вещества
· Определение молекулярной формулы вещества по его плотности и массовым долям элементов
Актуальность выбранной темы
Химические задачи требуют не только хорошую базу отработанных математических навыков решения уравнений и систем уравнений, но и практические, и теоретические знания по химии довольно высокого уровня.
Очень часто задачи, решаемые математическими способами, включаются в олимпиадные задания и обязательно – в ЕГЭ по химии.
В данном проекте рассматриваются алгоритмы решения различных типов подобных задач по химии и предоставляется справочный материал в виде таблиц. Предлагаются решённые задачи и задачи для самостоятельного решения.
Цель: Изучить различные способы решения задач на вывод молекулярной формулы соединений и найти рациональное решение таких задач.
Задачи:
1. Собрать информацию о методах решения расчётных задач по химии.
2. Выбрать алгоритмы решения задач.
3. Решить несколько типов расчётных задач на нахождение молекулярной формулы вещества.
4. Составить подборку задач по теме проекта.
Продукт проекта:
Презентация «Расчётные задачи по химии на нахождение молекулярной формулы вещества».
Основная часть
I.1. Теоретическая часть
I.1.1. Основные понятия, которые нужно знать для решения подобных химических задач
Чтобы научится решать химические задачи любого типа нужно научится видеть за условными обозначениями и символами конкретную информацию о веществах и их характеристиках.
Прежде чем приступать к решению задач, нужно быть уверенным в собственном знании основных терминов. Нужно знать, что такое масса, молярная масса, постоянная Авогадро, количество вещества, массовая доля, объёмная доля, и так далее.
Масса вещества (m) - произведение количества вещества на молярную массу.
Относительная молекулярная масса (Mr) - величина, равная сумме относительных атомных масс, входящих в неё атомов. Масса молекулы, модуль которой равен модулю молярной массы.
Относительная атомная масса (Ar) - масса одного атома, выраженная в атомных единицах массы.
Объём газа (V) - это произведение количества вещества на молярный объём газа.
Количество вещества (n или v) - это отношение массы вещества к молярной массе (m/M).
Молярная масса (M) - характеристика вещества, отношение массы вещества к его количеству.
Молярный объём (Vm) - это отношение объёма вещества к количеству этого вещества, численно равен объёму одного моля вещества. Постоянная величина, равная 22,4 л/моль.
Плотность газа (𝜌) - это отношение массы газа к его объёму.
Относительная плотность газа (D) - величина, показывающая во сколько плотность одного газа больше или меньше плотности другого газа.
Массовая доля (ω) - это отношение массы вещества в растворе к массе раствора (то, сколько вещества содержится в растворе).
Объёмная доля (φ) - величина, равная отношению объёма вещества в смеси к сумме объёмов компонентов смеси.
Валентность- свойство атомов данного элемента присоединять или замещать в молекуле определённое число атомов других элементов. За единицу валентности принята валентность водорода. Валентность обозначается римскими цифрами.
I.1.2. Молекулярная и простейшая формулы вещества.
Определение простейшей формулы вещества
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе (она может иногда совпадать с истинной или быть кратной ей, но это уже зависит от условия задачи).
Например, для бензола соотношение С : Н = 1 : 1, т.е. простейшая формула бензола — СН.
Чтобы найти простейшую формулу химического соединения, нужно найти соотношения n (количество вещества), входящих в него элементов.
Найдём простейшую формулу соединения, содержащего водород, фосфор и кислород, если известно, что n(H)- 3,06 моль, n(P)- 1,02 моль, n(O)- 4,08 моль.
n(H) : n(P) : n(O) = 3,06 : 1,02 : 4,08 = 3 : 1 : 4
Отсюда: простейшая формула вещества –H3PO4
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Задачи для самостоятельного решения:
Найдите простейшую формулу соединение, если оно содержит:
1. 46,67% железа и 53,33% серы
2. 75% алюминия и 25% углерода.
Ответ: 1. FeS2; 2. Al4C3
I.1.3. Определение молекулярной формулы вещества по массовым долям образующих его элементов
Массовая доля элемента — это отношение его массы к общей массе вещества, в состав которого он входит:
W=
![]()
Массовая
доля элемента (ω) выражается в долях единицы или в процентах.
Задача 1
Соединение содержит 80 % (0,8) углерода и 20 % (0,2) водорода (по массе). Определите истинную формулу этого соединения, если его относительная молекулярная масса равна 30.
1. Запишем формулу неизвестного соединения в виде CxHy.
Пусть m(CxHy) = 100 г, тогда
m(C) = 100г × 0,8 = 80 г
m(H) = 100 × 0,2 = 20 г
2. Найдём n(C) и n(H).
n(C) = ![]() =
= ![]() = 6,66 моль
= 6,66 моль
n(H)
=![]() =20 моль
=20 моль
3. Определим простейшую формулу соединения
n(C) : n(H) = 6,66 : 20
Так как в формуле должно быть целое число атомов, то это отношение приводим к целым числам:
n(C) : n(H) = 6,66 : 20 = 1 : 3, 003 = 1 : 3
4. Подставляем найденные числа и получаем формулу оксида:
CH3
Поскольку Mr(CH3) = 12 + 3·1 = 15, а в условии сказано, что Mr(CxHy) = 30, что ровно в два раза больше, то истинная формула — C2H6.
Ответ: C2H6.
Задача 2
Массовая доля металла (валентность III) в его хлориде равна 0,3446. Определите формулу хлорида.
1. Запишем формулу хлорида неизвестного металла в виде ЭCl3 (Э- неизвестный элемент)
W = ![]()
Пусть m(Э) будет x, тогда M(ЭCl3) = x+ 35,5×3 = x+ 106,5
2. Составим алгебраическое уравнение и решим его
0,3446
![]()
…
x = 56.
Относительная атомная масса элемента – 56.
3. По Периодической системе химических элементов определим, какой это элемент.
Ответ: железо.
Задачи для самостоятельного решения:
1. Массовая доля углерода 0,428. Найдите формулу оксида углерода.
2. Массовая доля в бромиде металла (II) равна 0,285. Определите формулу вещества.
Ответ: 1. CO; 2. Cu (медь)
I.1.4. Определение молекулярной формулы вещества с использованием плотности или относительной плотности
Для решения подобных задач надо знать понятия «плотность» и «относительная плотность газов». Плотность газа — это отношение массы газа к его объёму (масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.):
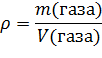
Если взять 1 моль газа, то тогда молярную массу газа можно найти, умножая плотность на молярный объём. Плотность газа зависит от условий, при которых она определена.
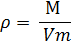
Относительная плотность газа D – величина, показывающая во сколько плотность одного газа больше или меньше плотности другого газа:
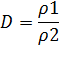
Относительную плотность газа можно рассматривать как отношение молярной массы одного газа к молярной массе другого газа:
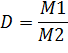
D - безразмерная величина, она не зависит от условий задачи.
Например:
D(O2) = M(газа)/M(O2)=M(газа)/32;
D(H2) = M(газа)/M(H2)=M(газа)/2;
D(воздуха)=M(газа)/M(воздуха)=M(газа)/29
Этиловый спирт содержит 52,18% углерода, 13,04% водорода, 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2. По формуле: n= ![]() =
= ![]() вычислим число атомов C, H, O (округляем до целых):
вычислим число атомов C, H, O (округляем до целых):
n(C)=![]() = 2
= 2
n(H)=![]() =6
=6
n (O)= ![]() =1
=1
Получаем x:y:z =2:6:1, следовательно, вещество - C2H6O
Ответ: C2H6O(этанол).
Задачи для самостоятельного решения:
1. Вещество содержит 85,71% углерода и 14,29% водорода по массе. Относительная плотность паров этого вещества по водороду равна 14. Определите молекулярную формулу вещества.
Ответ: C2H4.
I.1.5. Определение молекулярной формулы вещества по продуктам его сгорания
В задачах такого типа чаще всего нужно будет находить истинную формулу вещества путём сравнения молярной массы (M) простой формулы вещества с молярной массой (M) формулы исходного вещества. Например, в ходе решения задачи получилось так, что Mпрост меньше Mист в 2 раза. Чтобы найти нужную нам формулу надо умножить все коэффициенты простейшей формулы в 2 раза.
Иногда будет встречаться понятие «относительной плотности газов», оно понадобится для нахождения молярной массы (M) исходного вещества.
При полном сгорании 2,66 г некоторого вещества образовалось 1,54 г оксида углерода (IV) и 4,48 г оксида серы (IV). Плотность паров этого вещества по воздуху равна 2,62. Выведите истинную формулу вещества.
Решение:
1. Рассчитаем количество веществ CO2и SO2(n= ![]() )
)
n(CO2)=![]() 0,035 моль
0,035 моль
n(SO2)=![]() 0,07 моль
0,07 моль
2. Определим количество вещества атомарных углерода и серы:
n(C)= n(CO2)=0,035 моль
n(S)= n(SO2)=0,07 моль
3. Найдём массы углерода и серы(m=![]() ):
):
m(C)=0,035 ∙ 12 = 0,42 г
m(S)= 0,07 ∙ 32 = 2,24 г
4. Найдём простую формулу вещества:
n(C):n(S)=0,035 : 0,07= 1 : 2
5. Определим молярную массу CS2:
│M│(CS2)=12+ 32 ∙ 2= 76 г/моль
6. Рассчитаем молекулярную формулу искомого вещества:
Mист= 29 ∙Dвозд=29 ∙ 2,26= 76 г/моль
7. Найдём истинную формулу вещества:
Mист= M(CS2) = 76 г/моль.
Таким образом, истинной формулой вещества является – CS2.
Ответ: CS2.
Задачи для самостоятельного решения:
1. При сжигании неорганического соединения массой 3,4 г было получено 2,8 г азота и 5,4 г воды. Плотность этого вещества по водороду равна 8,56. Определите молекулярную формулу вещества.
Ответ: NH3
I.1.6. Определение молекулярной формулы вещества по отношению атомных и молекулярных масс элементов, входящих в состав вещества
Соотношение молекулярных масс высших хлорида и оксида элемента, расположенного в IV группе Периодической системы, составляет 17 :6. Определите элемент.
Решение:
Примем молярную массу элемента за «x» г/моль.
Формула хлорида: ЭCl4. Формула оксида: ЭO2.
1. Обозначим Ar элемента буквой «x», тогда:
М(ЭCl4) = (x+142) г/моль
М(ЭO2) = (x+32) г/моль
2. Если М(ЭCl4) : М(ЭO2)=17 : 6, то
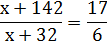
3. Решаем уравнение и получаем
x= 28.
Значит, Ar элемента = 28. Смотрим в Периодическую систему. Элемент- кремний (Si).
Ответ: кремний.
Задачи для самостоятельного решения:
1. Молекулярная масса бромида некоторого металла (II) в два раза больше молекулярной массы его карбоната. Какой это металл?
Ответ: Ca (кальций).
I.1.7. Определение молекулярной формулы вещества по его плотности и массовым долям элементов
В составе газообразного вещества массовая доля углерода (C) 0,8571 и массовая доля водорода (H2) 0,1419. 1 л этого газа имеет массу 1,25г (ρ= 1,25 г/л). Найдите химическую формулу данного газа.
Решение:
Пусть формула вещества будет иметь вид CxHy.
1. Выведем простейшую формулу газа (найдём отношение чисел атомов)
Ar(C) =12, Ar(H) = 1
Получаем: 12x : 1y= 0,8571 : 0,1419
Примем массу вещества за 100 г, тогда получим, что m(H) = 0,1419 г, а m(C) = 0,8571г.
Найдём отношение n(C) к n(H).
![]() = 1 : 2 =x : y
= 1 : 2 =x : y
Запишем простейшую формулу вещества: CH2,
Молярная масса: М(CH2) = (12+1×2) =14 г/моль
2. Найдём истинную молярную массу CxHy
по формуле М=ρ×![]()
(![]() =
=![]() )
)
М(CxHy)= 1,25 × 22,4 = 28 г/моль
3. Вычислим, во сколько раз М(CxHy) больше М(CH2):
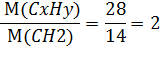
4. Выведем истинную формулу газа, умножив число атомов каждого элемента на 2, и получим: C2H4(этилен)
Ответ: C2H4
Задачи для самостоятельного решения:
1. Найдите молекулярную формулу углеводорода, зная, что 1 л этого газа имеет массу 1,875 г (ρ= 1,875 г/л), а содержание углерода составляет 85,7% по массе.
Ответ: C3H6
II.1. Практическая часть
II.1.1. Подборка задач
1. Простейшая формула соединения
Определите формулу вещества, если оно содержит
52,9% алюминия и 47,1%кислорода
Решение:
Пусть масса вещества будет 100 г, тогда:
n(Al) = ![]() = 1,96
= 1,96
n(O) = ![]() = 2,94
= 2,94
n(Al) : n(O) = 1,96: 2,94= 2 : 3
Формула вещества – Al2O3
Ответ: Al2O3.
1. 74,2% натрия и 25,8%
2. 83,5% хлора и 16,5% лития
3. 94,1% серы и 5,9% водорода
4. Ответы: Na2O; LiCl; H2S
2. Нахождение молекулярной формулы по известным массовым долям
Определите формулу бескислородной кислоты если известно, что содержание хлора в ней 97,3%.
Решение:
Запишем формулу неизвестного соединения в виде CxHy.
Пусть m(HxCly) = 100 г, тогда
m(H) = 100 × 0,027 = 2,7 г
m(Cl) = 100 × 0,973 = 97,3 г
Найдём n(H) и n(Cl).
n(H) = ![]() =
= ![]() = 2,7 моль
= 2,7 моль
n(Cl) =![]() =2,74 моль
=2,74 моль
Определим простейшую формулу соединения
n(H) : n(Cl) = 2,7 : 2,74
Так как в формуле должно быть целое число атомов, то это отношение приводим к целым числам:
n(H) : n(Cl) = 2,7: 2,74 = 1 : 1
Подставляем найденные числа и получаем формулу кислоты: HCl
Ответ: HCl.
1. Массовая доля азота в оксиде азота равна 25,9%. Найдите формулу данного оксида.
2. Установите формулу некоторого неорганического соединения, содержащего 1,69% водорода, 54,24% кислорода и 44,07% некоторого металла в степени окисления (VI). Назовите этот металл.
3. Массовая доля фосфора в оксиде равна 56,36%. Какова формула оксида.
4. Некоторое неорганическое вещество содержит 57,5% натрия, 40% кислорода и водород. Определите формулу соединения и назовите его класс.
5. Массовая доля кислорода в оксиде металла (III) 30%. Определите формулу оксида.
Ответы: N2O5; H2CrO4, (хром); P2O3; NaOH; Fe2O3.
3. Нахождение молекулярной формулы вещества с использованием плотности или относительной плотности газов
Вещество содержит 80% углерода и 20% водорода. Плотность этого газа по воздуху равна 1,0345. Определите формулу углеводорода
Решение:
Определим молекулярную массу искомого вещества:
Mr(CxHy) = D(H2) · Mr(воздуха)= 1,0345· 29 = 30
По
формуле: n = ![]() =
= ![]() вычислим число атомов C, H (округляем до целых):
вычислим число атомов C, H (округляем до целых):
n(C)=![]() = 2 моль
= 2 моль
n(H)=![]() =6 моль
=6 моль
Получаем x:y =2:6, следовательно, вещество - C2H6
Ответ: C2H6.
1. Определите формулу вещества, содержащего углерод и 17,24% водорода. Плотность газа по водороду равна 29.
2. Углеводород содержит 85,71% углерода и 14,29% водорода. Плотность его паров по кислороду 1,3125. Определите формулу вещества.
3. Плотность газа по кислороду, содержащего 85,71% углерода и водород, равна 0,875. Найдите формулу вещества.
Ответы: C4H10; C3H6; C2H4(этилен или этен).
4. Нахождение молекулярной формулы по продуктам сгорания (Класс вещества известен)
При сгорании неорганического соединения массой 7,6, состоявшего из углерода и серы, получено 2,24 л оксида углерода (IV) и 4,48 л оксида серы (IV). Определите молекулярную формулу вещества.
Решение:
Рассчитаем количество веществ CO2и SO2(n=![]() )
)
n(CO2)=![]() 0,1 моль
0,1 моль
n(SO2)=![]() 0,2 моль
0,2 моль
Определим количество вещества атомарных углерода и серы:
n(C)= n(CO2)=0,1 моль
n(S)= n(SO2)=0,2 моль
Найдём массы углерода и серы(m=![]() ):
):
m(C)=0,1 × 12 = 1,2 г
m(S)= 0,2 × 32 = 6,4 г
Найдём молекулярную формулу вещества:
n(C) : n(S) = 0,1 : 0,2 = 1 : 2
Молекулярной формулой вещества является – CS2.
Ответ: CS2.
1. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г, и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
2. При сжигании газообразного углеводорода с плотностью по водороду 21 получено 8,4 л оксида углерода (IV) (н.у.) и 6,75 г воды. Определите формулу углеводорода.
3. (Нормальные
условия (н.у.) – температура 0![]() и давление 760 мм рт.
ст. или 101.3 кПа.)
и давление 760 мм рт.
ст. или 101.3 кПа.)
4. При сгорании 0,9 г газообразного органического вещества выделилось 0,896 л (н.у.) углекислого газа, 1,26 г воды и 0,224 л азота. Плотность газообразного вещества по азоту 1,607. Установите молекулярную формулу органического вещества
5. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н. у.) углекислого газа, 0,63 г воды и 0,112 л (н. у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
Ответы: С12Н26; С₃Н₆; C2H7N; C2H7N.
5. Нахождение молекулярной формулы по отношению атомных и молекулярных масс элементов, входящих в состав вещества
Соотношение молекулярных масс оксида и йодида элемента первой группы главной подгруппы Периодической системы составляет 31:75. Назовите элемент.
Решение:
Обозначим Ar элемента буквой «x», тогда:
М(Э2O) = (2x+16) г/моль
М(ЭI) = (x+127) г/моль
Если М(Э2O) : М(ЭI)=31 : 75, то
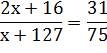
Решаем уравнение и получаем
x= 23.
Значит, Ar элемента = 23. Смотрим в Периодическую систему. Элемент- натрий (Na).
Ответ: натрий.
1. Молекулярная масса оксида этого металла (в степени окисления (с/о) +2) относится к молекулярной массе его нитрата как 17:29. Какой это металл?
2. Соотношение молекулярных масс гидроксида и йодида элемента(I) Периодической системы составляет 25:47. Назовите элемент.
3. Молекулярная масса бромида этого металла (в с/о +2) относится к молекулярной массе его карбоната как 2:1. Какой это металл?
4. Определите элемент(III), если молекулярная масса его гидроксида относится к молекулярной массе его оксида как 13:17.
Ответы: Барий, Серебро, Кальций, Алюминий.
6. Нахождение молекулярной формулы по отношению плотности и массовым долям элементов.
Газообразное вещество состоит из атомов кислорода. 1 л этого газа имеет плотность 2,143 г/л.
Решение:
Пусть формула вещества будет иметь вид Ox.
Молярная масса: М(O) = 16 г/моль
Найдём истинную молярную массу CxHy
по формуле М=ρ×![]()
(![]() =
=![]() )
)
М(Ox)= 2,143 × 22,4 = 48 г/моль
Вычислим, во сколько раз М(CxHy) больше М(CH2):
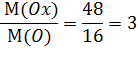
Выведем истинную формулу газа, умножив число атомов каждого элемента на 3, и получим: O3 (озон).
Ответ: O3.
1. В составе газообразного вещества 83% углерода и 17% водорода. 1 л этого газа имеет плотность 2,59 г/л.
2. Газообразное вещество состоит из углерода с массовой долей 0,82 и водорода с массовой долей 0,18. 1 л этого газа имеет плотность 1,96 г/л.
3. Газ на 80% состоит из углерода и на 20% из водорода. 1 л этого вещества имеет плотность 1,34 г/л.
4. Найдите формулу углеводорода, зная, что 1 л этого газа имеет массу 2,5 г, и он содержит 14% водорода по массе.
Ответы: O3;
C4H10; C3H8; C2H6;
C4H8.
Заключение
Во время работы над проектом я рассмотрела различные способы решения задач на вывод молекулярной формулы соединений, создала подборку задач по теме проекта и презентацию, которая позволяет изучить решения задач на вывод молекулярной формулы соединений. Цель работы достигнута.
Практическая значимость работы заключается в том, что данный проект может быть использован школьниками для повышения образовательного уровня при изучении тем по химии в старших классах.
Список источников
1. О. Ю. Косова Химия в расчётных задачах: учебно- методическое пособие / О. Ю. Косова – Челябинск: Взгляд, 2006 – 127 с.
2. образовательный сервис от Ростелекома: Ростелеком лицей, сайт «lc.rt.ru» [Электронный ресурс]. – Режим доступа: https://lc.rt.ru/?utm_source
3. Пак М. Алгоритмы в обучении химии: Книга для учителя / М. Пак – Москва: Просвещение, 1993 –64 с.
4. Сайт «himi4ka.ru» [Электронный ресурс]. – Режим доступа: https://himi4ka.ru/arhiv-urokov/urok-8-himicheskoe-kolichestvo-veshhestva-i-mol.html
5. Сайт «hishnik-school.ru» [Электронный ресурс]. – Режим доступа: https://hishnik-school.ru/bez-rubriki/nauchitsya-reshat-zadachi-po-himii-legko-sleduem-instruktsii/
6. Сайт «infourok.ru» [Электронный ресурс]. – Режим доступа: https://infourok.ru/algoritm-resheniya-zadach-na-opredelenie-molekulyarnoy-formuli-po-produktam-sgoraniya-1521510.html
7. Штремплер
Методика решения расчётных задач по химии: 8-11 кл.: пособие для учителя/ Г. И.
Штремплер, А .И. Хохлова – 3-е изд.
– Москва: Просвещение, 2001. – 207 с.
Приложения
ПриложениеА. Физические величины
|
Единица измерения |
Масса |
Количество вещества |
Молярная масса |
Объём |
Молярный объём |
Число частиц |
|
Наиболее часто применяемая |
г |
моль |
г/моль |
л |
|
(NA) |
|
В 1000 раз большая |
кг |
кмоль |
кг/кмоль |
|
|
|
|
В 1000 раз меньшая |
мг |
ммоль |
мг/ммоль |
мл |
мл |
|
ПриложениеБ. Формулы
|
Наименование |
Обозначение |
Формула |
|
Масса Количество вещества Молярная масса Относительная молекулярная масса Объём Молярный объём Плотность Относительная плотность Массовая доля Объёмная доля Число Авогадро Число молекул |
m n, v M Mr V Vm 𝜌 D ω φ NA N |
m=n× M
M= масса молекулы; │Mr│=│M│
22,4 л/моль
|
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.