
РАЕВОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«АЛТАЙСКИЙ ТРАНСПОРТНЫЙ ТЕХНИКУМ»
ИНДИВИДУАЛЬНЫЙ УЧЕБНЫЙ ПРОЕКТ
Тема:
Выращивание кристаллов
Выполнил:
Кудлик Максим
Студент 1 курса, группы ТМ02
по профессии 35.02.16
«Тракторист-машинист
сельскохозяйственного производства »
Руководитель:
Преподаватель физики
Утева Любовь Петровна
Проект защищён
«___ » __________ 2021г.
С оценкой ________________
Первомайское
2021год
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
Актуальность исследования………………………………….………...….2 стр.
ГЛАВА I.ОСНОВНАЯ ЧАСТЬ
1.1 Кристаллические тела……………………………………………….….4стр.
1.2 Зачем растят кристаллы…………………………………………..…….6стр.
1.3 Механизм роста кристалла………………………………………..…….6стр.
1.4 Способы роста кристаллов…………………………………..………….8стр.
ГЛАВА II. ПРАКТИЧЕСКАЯ ЧАСТЬ
2.1Выращивание кристаллов поваренной соли….…………….…..11стр.
2.2 Нахождение оптимальной концентрации раствора для роста монокристалла и поликристаллараствора……………………………………………………………..……....12 стр.
2.3Сравнение кристаллов медного купороса и поваренной соли..…....12 стр.
ЗАКЛЮЧЕНИЕ…………………………………………………………..….……13стр.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ ……..........................................14 стр.
ПРИЛОЖЕНИЕ……………………………………………………………….…..15стр.
ВВЕДЕНИЕ
Актуальность исследования.Тема кристаллизации веществ становится все более актуальной для всего человечества. В настоящее время кристаллы буквально вошли в каждый дом. Каждый человек в своей жизни хотя бы один раз любовался красивым блеском кристаллов. В сердце каждого телевизора, сотового телефона, компьютера находится кристалл. Перечень видов применения кристаллов уже достаточно длинен и непрерывно растет. Выращивание которых сохраняет природные богатства, и ускоряет научно-технический прогресс.В настоящее время изучением кристаллов занимается наука кристаллография.
Они часто встречаются в природе. Например, снежинки, морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев.
Все камни - это кристаллы! Причем не только яркие и блестящие драгоценные камни (алмазы, рубины, сапфиры), но и обычные, из которых состоят горы, скалы, ущелья и пещеры.Кристаллы красивы и разнообразны. Секрет их красоты - в симметрии.Сейчас мы знаем, что даже некоторые части нашего организма кристалличны, например, роговица глаза. Мир кристаллов и мир людей стали неразрывны.
Кристаллы завораживают своими правильными формами, большим разнообразием расцветок. Человечество с древних времен изучают их свойства. Кристаллы, как и живые существа, могут зарождаться, расти, стареть, и разрушаться. Почти любое вещество может при известных условиях дать кристаллы. Основное появление кристаллов основано на кристаллизации насыщенных и перенасыщенных растворов.
Выращивание кристаллов очень интересное и увлекательное занятие. Люблю экспериментировать и узнавать что-то новое. Поэтому решил исследовать процесс кристаллизации и вырастить кристаллы в домашних условиях.
Цель исследования
- вырастить кристаллы в домашних условиях и определить условия,влияющие на их рост.
Исходя из цели сформулированызадачи:
1. Анализ научной литературы, с использованием Интернета в поисках информации.
2. Изучить методики процесса кристаллизации.
3. Выполнить опытно-экспериментальную работу по изученным методикам.
4. Составить «рекомендации по выращиванию кристаллов в домашних условиях для юных исследователей»
Гипотеза: некоторые кристаллы легко выращиваются в домашних условиях.
Объект исследования: кристаллические вещества.
Предмет исследования: процесс кристаллизации.
Методы исследования:
1. Сбор информации, её систематизация.
2. Анкетирование, наблюдение
3. Проведение опытов.
4. Анализ, оформление результатов работы.
Новизна исследования заключаетсявпредставлениивыработанных рекомендаций юным
исследователям по выращиванию кристаллов в домашних условиях, которые способствуют повышению
интереса, активности и самостоятельности в опытно-экспериментальной деятельности, а
Новизна исследования заключается в представлениивыработанных рекомендацийюным исследователям по выращиванию кристаллов в домашних условиях, которые способствуют повышению интереса, активности и самостоятельности в опытно-экспериментальной деятельности.
Практическая значимость:практическое значение исследование состоит в том, что оно может быть использовано на уроках химии, физики, при организации исследовательской деятельности студентов.
ГЛАВА I.ОСНОВНАЯ ЧАСТЬ
«Почти весь мир кристалличен.
В мире царит кристалл и его
твердые, прямолинейные законы».
А.Е. Ферсман.
1.1 Кристаллические тела
Кристаллы (от греч. krýstallos, первоначально — лёд, в дальнейшем — горный хрусталь, кристалл). В древности люди думали, что кристаллы горного хрусталя и кристаллы льда это одно и то же, только лёд замерзает мгновенно, а горный хрусталь при сильном морозе. И лёд становится хрусталём через тысячу лет, а хрусталь становится алмазом через тысячу веков. Поэтому кристаллы наделялись множеством таинственных свойств: исцелять болезни, влиять на судьбу человека. Представления о кристаллах, их строении и свойствах развивались на протяжении нескольких веков. Точкой отсчета истории кристаллов может быть известие о существовании изумрудов в Индии за 2 тыс. лет до н. э., алмазов за 1000-500 лет до н. э., рубинов Цейлона за 600 лет до н. э.
Кристаллы состоят из отдельных частиц: молекул и атомов, располагающихся в строгом порядке. Они и образуют кристаллическую решетку. Каждому атому отведено место в определенном узле решетки, при этом образуются правильные многогранники. Кристалл может иметь от трех до нескольких сотен граней. Но при этом они обладают замечательным свойством. Все плоские грани пересекаются друг с другом под определенными углами. Углы между соответствующими гранями всегда одинаковы. Например, у кристаллов поваренной соли (NaCl) всегда их грани пересекаются под прямым углом.
Кристаллическими называются твёрдые тела, физические свойства которых неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Именно анизотропия физических свойств, а не геометрически правильная форма является важнейшим признаком кристаллического тела. Простейший пример анизотропии кристаллов – неодинаковая их прочность по разным направлениям. Это свойство наглядно проявляется при дроблении многих кристаллических тел. Кусок каменной соли при раскалывании разделился на части, ограниченные плоскими поверхностями, пересекающимися под одинаковыми углами.
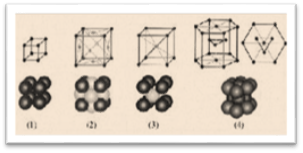 Для наглядного
представления внутренней структуры кристалла применяется способ его изображения
с помощью пространственной кристаллической решетки - пространственной сетки,
узлы которой совпадают с положением центров атомов или молекул в кристалле.В
основе кристаллической решетки лежит элементарная ячейка – фигура наименьшего
размера, последовательным переносом которой можно построить весь кристалл. Как
правило, атом принадлежит не одной элементарной ячейке, а входит одновременно в
состав нескольких соседних элементарных ячеек. На рисунке 1 примеры простых
кристаллических решёток:
Для наглядного
представления внутренней структуры кристалла применяется способ его изображения
с помощью пространственной кристаллической решетки - пространственной сетки,
узлы которой совпадают с положением центров атомов или молекул в кристалле.В
основе кристаллической решетки лежит элементарная ячейка – фигура наименьшего
размера, последовательным переносом которой можно построить весь кристалл. Как
правило, атом принадлежит не одной элементарной ячейке, а входит одновременно в
состав нескольких соседних элементарных ячеек. На рисунке 1 примеры простых
кристаллических решёток:
Рис.1
1 – простая кубическая; 2 – гранецентрированная кубическая; 3 – объёмно-центрированная кубическая; 4 – гексагональная
Кристаллические тела могут быть монокристаллами и поликристаллами. Большинство встречающихся в природе и получаемых в технике твердых тел представляют собой совокупность сросшихся друг с другом хаотически ориентированных маленьких кристаллов - кристаллитов. Такие тела называются поликристаллами. В отличие от монокристаллов поликристаллы изотропны, т. е. их свойства одинаковы во всех направлениях. Монокристаллом называют одиночный кристалл.
Примером образования кристаллов из пара и газа являются снежинки, иней.
1.2. Зачем растят кристаллы
Прежде всего, затем, что природные кристаллы не всегда достаточно крупны, часто они неоднородны, в них имеются нежелательные примеси. При искусственном выращивании можно получить кристаллы крупнее и чище, чем в природе.
Есть и такие кристаллы, которые в природе редки и ценятся дорого, а в технике нужны. В лабораториях выращивают большие кристаллы, необходимые для техники и науки, искусственные драгоценные камни, кристаллические материалы для точных приборов; там создают и те кристаллы, которые изучают кристаллографы, физики, химики, металловеды, минералоги, открывая в них новые замечательные явления и свойства. А самое главное – искусственно выращивая кристаллы, создают вещества, каких вообще нет в природе, множество новых веществ.
Напомним также, что гигантскими «фабриками искусственных кристаллов» являются все химические заводы, где вырабатывают различные соли, соду, химические удобрения и многие другие кристаллы, сахарные заводы, где синтезируют кристаллы лекарственных веществ, и прежде всего все металлургические заводы, где выплавляют металлы.
1.3 Механизм роста кристалла
Процессы роста кристаллов. Описывая строение кристаллов, пользуются их идеальными моделями. Отличие реальных кристаллов от идеальных заключается в том, что реальные кристаллы не обладают правильной кристаллической решеткой, а имеют целый ряд нарушений в расположении атомов, называемых дефектами. Знание условий образования дефектов и способов их устранения играет большую роль при использовании кристаллов на практике.
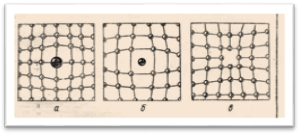
Рис.2 Схемы возникновения дефектов в кристаллах
Самые простые дефекты в идеальной кристаллической решетке возникают в результате замещения собственного атома в одном из узлов кристаллической решетки.Особую роль в процессе роста кристалла играют несовершенства его структуры, называемые дислокациями (смещениями). Простейшими видами дислокаций являются краевая и винтовая. Краевая дислокация образуется в месте обрыва «лишней» атомной полуплоскости. В случаи винтовой дислокации атомные плоскости образуют систему, напоминающую винтовую лестницу. Количество дислокаций в кристаллах может быть очень большим, достигая 108-109 см-3-.Кристаллов без дислокаций не существует. Постоянное наличие открытой ступеньки винтовой дислокации создает благоприятные условия для роста кристалла. Атомы, пристраивающиеся к ступенькам, наращивают ее, и за счет этого она начинает перемещаться по поверхности грани. Но это движение не будет перемещением ступеньки параллельно самой себе, так как один её конец неподвижен. Нетрудно сообразить, что если атомы укладываются с постоянной скоростью вдоль всей длины ступеньки, то она по мере роста начнет изгибаться и примет форму спирали. Постоянное наращивание ступеньки новыми слоями приведет к тому, что на грани кристалла образуется спиральная башенка (рис.3).
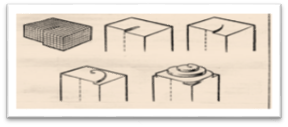
Рис.3
Центральная часть ее как бы ввинчивается в пространство, опережая в своём движении нижние ступеньки лестницы, которые со временем будут застроены полностью и исчезнут, превратившись в завершенный атомный слой.
1.4 Способы роста кристаллов
Выращивать кристаллы можно в химических и промышленных лабораториях
следующими способами:
1. Охлаждениенасыщенного горячегораствора.
2. Постепенное удаление воды из насыщенного раствора.
3.Выращивание кристаллов из расплавленных веществ при медленном охлаждении жидкости.
4.Конденсация паров.
Удивительно, но выращивать кристаллы можно не только в химических
и промышленных лабораториях, но и в домашних условиях. Самые популярные
вещества, из которых выращивают кристаллы дома – это поваренная соль, сахар.
Существует всего два способа выращивания кристаллов в домашних условиях:
1. Путем выпаривания воды, в котором находится вещество.
2.Путем изменения температуры воды, охлаждения.
Первый из них состоит в медленном испарении растворителя из насыщенного раствора, а второй – в медленном понижении температуры раствора. Чаще применяют второй способ. В качестве растворителей используют воду, спирты, кислоты, расплавленные соли и металлы. Недостатком методов выращивания кристаллов из раствора является возможность загрязнения кристаллов частицами растворителя.Кристалл растет из тех участков пересыщенного раствора, которые его непосредственно окружают.
В результате этого вблизи кристалла раствор оказывается менее пересыщенным, чем вдали от него. Так как пересыщенный раствор тяжелее насыщенного, то над поверхностью кристалла всегда имеется направленный вверх поток «использованного» раствора. Без такого перемещения раствора рост кристаллов быстро бы прекратился. Поэтому часто дополнительно перемешивают раствор или закрепляют кристалл на вращающемся держателе. Это позволяет выращивать более совершенные кристаллы.Чем меньше скорость роста, тем лучше получаются кристаллы. Это правило справедливо для всех методов выращивания.
II. Практическая часть
2.1 Выращивание кристаллов поваренной соли.
Процесс выращивания не требует наличия каких-то особых химических препаратов. У нас всех есть пищевая соль (или поваренная соль), которую мы принимаем в пищу. Её также можно назвать и каменной. Кристаллы поваренной соли NaCl представляют собой бесцветные прозрачные кубики. В идеале должны получиться прямоугольные кристаллы (это связано с тем, что NaCl имеет кубическую кристаллическую решетку).
Чтобы вырастить кристалл необходимо подготовить:
- соль;
- воду;
- кастрюлю;
- ложку, чтобы размешивать раствор;
- ёмкость, где будет находиться раствор.
Разведем раствор поваренной соли следующим образом: нальем воду водой (не более 50 °С – 60 °С). Насыпаем пищевую соль в стакан и оставляем на 5 минут, предварительно помешав. За это время соль растворится. Желательно, чтобы температура воды пока не снижалась. Затем добавим ещё соль и снова перемешаем. Повторяем этот этап до тех пор, пока соль уже не будет растворяться, и будет оседать на дно стакана. Мы получили насыщенный раствор соли. Переливаем его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне. Выбираем любой понравившийся более крупный кристаллик поваренной соли и помещаем его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Переносим ёмкость с насыщенным раствором и кристалликом в место, где нет сквозняков, вибрации и сильного света (выращивание кристаллов требует соблюдение этих условий).Накрываем чем-нибудь сверху ёмкость с кристалликом от попадания пыли и мусора.
Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик), то он будет расти гораздо быстрее (Приложение 1)
2.2.Нахождение оптимальной концентрации раствора для роста монокристалла и поликристалла–(приложение 2)
Вывод: в ходе опыта я выяснил: для того, чтобы вырастить монокристалл поваренной соли, надо 50 мл воды и 30 г соли. Для того, чтобы вырастить красивый поликристалл, надо 50 мл воды и 50г соли.
2.3.Сравнение кристаллов медного купороса и поваренной соли.
Для того, чтобы вырастить кристалл медного купороса, я поступал следующим образом: к 50мл очень горячей воды добавлял кристаллы медного купороса до получения насыщенного раствора (30 г). Опускал в насыщенный горячий раствор кристаллик на хлопчатобумажной нити (нить с «затравкой») и ставил раствор в теплое место (вода испаряется, и раствор все время является насыщенным)
Вывод: у веществ разного химического состава кристаллы имеют разную форму и отличаются по таким свойствам, как симметрия, выращивание, к тому же углы, образованные соответственными гранями, в кристаллах разных веществ будут неравными. Но есть и сходства, например, оба кристалла имеют кристаллическую решётку.
ЗАКЛЮЧЕНИЕ
При выполнении этой работы я выяснил, что мир кристаллов красив и разнообразен. Каждый его «представитель» уникален по своим свойствам, размерам и особенностям строения. Кроме того, что кристаллы красивы, они играют важную роль в жизни человека.
В ходе работы я исследовал очень интересное свойство кристаллов – их рост в искусственной среде. Оказывается, кристаллы можно вырастить дома, без каких- либо усилий. Для быстрого выращивания нужны оптимальные условия. Например, чтобы вырастить кристалл поваренной соли (за короткий срок), нужно поставить стакан с раствором в тёплое место, но раствор приготовить оптимальной концентрации – 50 мл воды и 30-50 г соли. Если кристаллизация происходит медленно, то вырастет монокристалл, а если быстро – поликристалл.
При изучении кристаллов я убедился: свойства их настолько разнообразны, что я смог исследовать лишь некоторые из них.
Вывод:
· при благоприятных условиях поваренная соль, медный купорос принимают форму кристаллов;
· кристаллы различных веществ имеют разную форму;
· кристаллы различных веществ имеют различные свойства (одни кристаллы окрашиваются, другие – бесцветны; одни кристаллы растут хорошо, другие – плохо).
· быстрее и легче кристалл растёт тогда, когда в насыщенный раствор помещается кристалл- «затравка».
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Афонькин С.Ю. Минералы и драгоценные камни. Школьный путеводитель.-СПб.: «БКК», 2012 г. – 96 с.
2. Белов Н.В. Энциклопедия драгоценных камней и кристаллов.- Минск: «Харвест», 2009 г. – 159 с.
3. Большая книга «Почему». Перевод с итальянского Ольги Живаго.- М.: РОСМЭН, 2011 г.- 240 с.
4. Журнал «Галилео. Наука опытным путём», №7, 2011 г.
5. Журнал для любознательных «Юный эрудит», №10 (октябрь), 2009 г.
6. ШаскольскаяМ.П.. Кристаллы. - М.: Наука, 1978 г. – 208 с.
7. http://www.geologiazemli.ru/articles/112 - Геология Земли .
8. http://ru.wikipedia.org/wiki/E519 - ВикипедиЯ – свободная энциклопедия.
9. http://www.kristallov.net/mineraly.html - Кристаллов.NET.
10. http://mirkristallov.com/- Мир кристаллов.
ПРИЛОЖЕНИЕ
Приложение 1
Рекомендации по выращиванию кристаллов в домашних условиях
Этапы процесса выращивания кристаллов в домашних условиях:
Этап 1: Растворить соль, из которой будет расти кристалл, в подогретой воде (подогреть нужно для того, чтобы соль растворилось немного больше, чем может раствориться при комнатной температуре). Растворять соль до тех пор, пока будете уверены, что соль уже больше не растворяется (раствор насыщен!). Рекомендуем использовать дистиллированную воду (т.е. не содержащую примесей других солей).
Этап 2: Насыщенный раствор перелить в другую ёмкость, где можно производить выращивание кристаллов (с учётом того, что он будет увеличиваться). На этом этапе следите, чтобы раствор не особо остывал.
Этап 3: Привяжите на нитку кристаллик соли, нитку привяжите, например, к карандашу и положите его на края стакана (ёмкости), где налит насыщенный раствор. Кристаллик опустите в насыщенный раствор.
Этап 4: Перенесите ёмкость с насыщенным раствором и кристалликом в место, где нет сквозняков, вибрации и сильного света (выращивание кристаллов требует соблюдение этих условий).
Этап 5: Накройте чем-нибудь сверху ёмкость с кристалликом (например, бумагой) от попадания пыли и мусора. Оставьте раствор на пару дней.
Важно помнить!
1. Кристаллик нельзя при росте без особой причины вынимать из раствора.
2. Не допускать попадание мусора в насыщенный раствор, наиболее предпочтительно использовать дистиллированную воду.
3. Следить за уровнем насыщенного раствора, периодически (раз в неделю или две) обновлять при испарении раствор.
Приложение 2
Таблица 1. Растворимость поваренной соли в г. на 100 г воды
|
Температура |
г/100 г воды |
|
0 |
35,7 |
|
20 |
35,9 |
|
50 |
36,8 |
|
80 |
38,1 |
|
100 |
39,4 |
Приложение 3
Таблица 2. Результаты исследования
|
Время, мин |
Длина, мм |
Скорость мм/мин |
|
1мин |
2мм |
2 |
|
2мин |
3мм |
1,5 |
|
3мин |
4мм |
1,3 |
|
4мин |
5мм |
1,25 |
|
5мин |
5мм |
1 |
Приложение 4
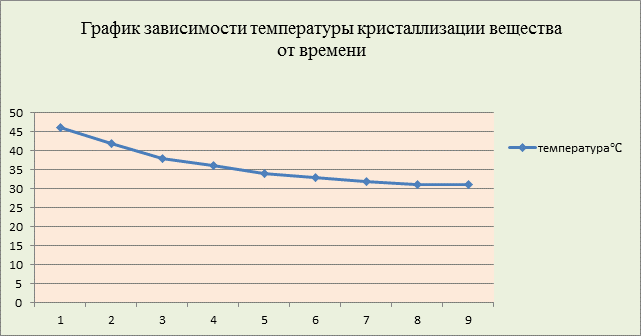
Таблица 3. Результаты измерения температуры кристаллизации вещества
|
Время, мин |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Температура, 0С |
46 |
42 |
38 |
36 |
34 |
33 |
32 |
31 |
31 |
Приложение 5
![]()
![]()
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.