
Практическая работа №1.
Теория электролитической диссоциации.

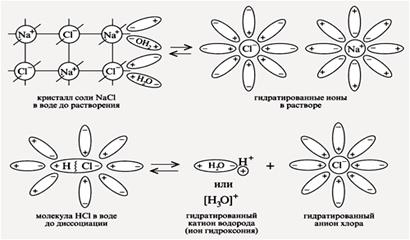
Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
Основные
положения теории электролитической диссоциации сформулированы в 1887 г.
шведским ученым С.А.Аррениусом. Теория Аррениуса не учитывала роли молекул
полярного растворителя в процессах диссоциации.
В гидратной теории, разработанной Д.И.Менделеевым и получившей дальнейшее
развитие в трудах русских ученых И.А.Каблукова и В.А.Кистяковского, рассмотрен
физико-химический процесс диссоциации электролитов в среде полярного
растворителя.
Основные
положения теории
электролитической диссоциации
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия
+11Na 1s22s22p63s1
при
обычных условиях легко отдает наружный (3s1) электрон
(окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия
+11Na+ 1s22s22p6 не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
|
NaOH |
Гидpaтированныe
анионы гидроксильных групп, двигаясь |
|
HCl |
Катионы
гидроксония H3O+, двигаясь к катоду, |
3.
Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:![]()
|
Порядок работы |
Задание |
Наблюдение и выводы |
|
|
1. Налейте в пробирку 1-2мл. концентрированной серной кислоты и опустите в неё кусочек цинка. Составьте уравнение реакции в молекулярном, ионном и сокращённом виде, покажите переход электронов и объясните, что в этой реакции является окислителем? |
Вывод: окислителем является..., т.к. ... |
|
|
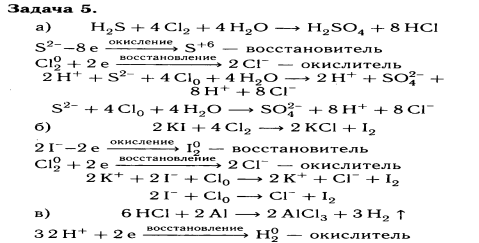
2. В шести пробирках дан раствор хлорида магния. А) прилейте раствор гидроксида натрия |
|
|
|
Б) прилейте раствор сульфата калия; В) прилейте раствор карбоната натрия; Г) прилейте раствор нитрата цинка |
|
|
|
Д) прилейте раствор ортофосфата калия Е) прилейте раствор сульфида натрия |
|
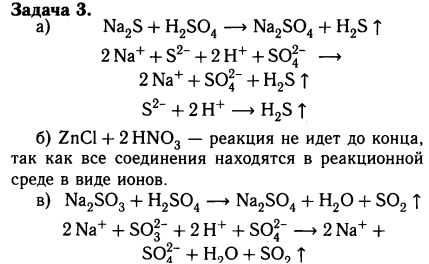
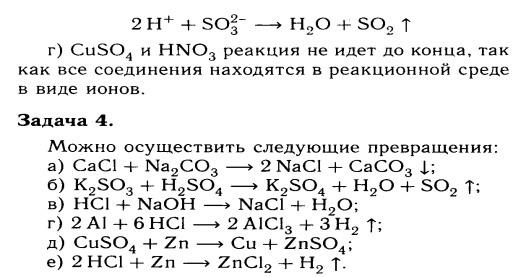
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.