
Тема урока. Строение атома. 11 класс ФИ учащегося _______________
Электронейтральная частица, состоящая из _____ заряженного ядра и ___ заряженной электронной оболочки - _____ .
Состав атома: ядро (___ и нейтроны) и электронная оболочка (____ ).
Для элементов А-групп число электронов на внешнем уровне равно номеру группы.
Задание 1. Заполни таблицу
|
Элемент |
|
|
|
Са |
|
|
|
|
|
Номер периода |
|
|
1 |
|
|
|
|
|
|
Номер группы |
II A |
|
|
|
|
|
…A |
…Б |
|
Число электронов внешнего уровня |
|
8 |
|
|
0 |
2 |
2 |
2. |
|
Значение n для электронов внешнего уровня |
|
|
|
|
|
|
|
|
n – главное квантовое число, равно номеру уровня
Задание 2. Составьте схему электронного строения атомов: (на обратной стороне листа)
F, Co, Cl, Cu, Cr, Na.
Задание 3. С помощью периодической системы определите химические элементы, если известны фрагменты их схем электронного строения:
а) +Х ) ) ) б) +Y ) ) в) + Z ) ) ) ) г) +… ) )
2 8 7 ? 2 ? ? ? 3 ? 4
Задание 4. Напишите символы всех химических элементов, в атомах которых число электронов на внешнем уровне равно номеру этого уровня.
Сдать работы
Тема урока. Строение атома. ФИ учащегося _________________________
Для элементов А-групп число электронов на внешнем уровне равно номеру группы.
Задание 1. Заполни таблицу
|
Элемент |
|
|
|
Са |
|
|
|
|
|
Номер периода |
|
|
1 |
|
|
|
|
|
|
Номер группы |
II A |
|
|
|
|
|
…A |
…Б |
|
Число электронов внешнего уровня |
|
8 |
|
|
0 |
2 |
2 |
2. |
|
Значение n для электронов внешнего уровня |
|
|
|
|
|
|
|
|
n – главное квантовое число, равно номеру уровня
Задание 2. Составьте схему электронного строения атомов: (на обратной стороне листа)
F, Co, Cl, Cu, Cr, Na.
Задание 3. С помощью периодической системы определите химические элементы, если известны фрагменты их схем электронного строения:
а) +Х ) ) ) б) +Y ) ) в) + Z ) ) ) ) г) +… ) )
2 8 7 ? 2 ? ? ? 3 ? 4
Задание 4. Напишите символы всех химических элементов, в атомах которых число электронов на внешнем уровне равно номеру этого уровня.
Сдать работы
Тема урока. Строение атома. 11 класс ВЫПОЛНЯТЬ В ТЕТРАДИ
Электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки - _____ .
Состав атома: ядро (___ и нейтроны) и электронная оболочка (____ ).
|
Порядковый номер элемента |
= |
Заряд ядра атома (со знаком +) |
= |
Число протонов |
= |
Число электронов |
Массовое число = число протонов + число нейтронов
Число нейтронов = массовое число – число протонов
Массовое число = атомная масса
Упражнение 1. Заполни таблицу. (перечерти в тетрадь)
|
№ |
Символ элемента |
Порядковый номер в ПС |
Заряд ядра атома |
Число |
Массовое число |
||
|
протонов |
электронов |
нейтронов |
|||||
|
1 |
|
|
+ 7 |
|
|
7 |
|
|
2 |
|
|
|
|
29 |
|
|
|
3 |
|
|
|
15 |
|
|
|
|
4 |
Sn |
|
|
|
|
|
|
|
5 |
|
15 |
|
|
|
16 |
|
Электронная оболочка атома состоит из уровней.
Число уровней в электронной оболочке атома = номеру периода в ПС
Упражнение 2. Заполни таблицу
|
Атом |
P |
N |
I |
Al |
Cl |
V |
Ca |
Au |
K |
Pt |
Pb |
S |
Sc |
|
Номер внешнего уровня |
|
|
|
|
|
|
|
|
|
|
|
|
|
Число электронов на внешнем уровне.
У элементов А-групп (главных подгрупп) число электронов на внешнем уровне равно номеру группы. У большинства элементов Б-групп (побочных подгрупп) число электронов на внешнем уровне равно 2. Однако у некоторых из них (Ag, Au, Cr, Cu, Mo, Nb, Pt, Rh, Ru) происходит «проскок» («провал») одного электрона внешнего уровня на предвнешний, за счет чего число электронов на внешнем уровне уменьшается на один (у Pd – «проскок» двух электронов)
Перечерти схему в тетрадь и заполни
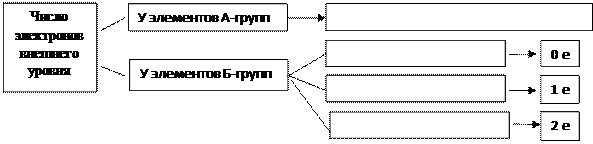
Номер уровня = значение главного квантового числа. n – главное квантовое число
Например, 2 уровень – главное квантовое число равно 2 (n=2).
Упражнение 2. Заполни таблицу
|
Элемент |
|
|
|
Са |
|
|
|
|
|
Номер периода |
|
|
1 |
|
|
|
|
|
|
Номер группы |
II A |
|
|
|
|
|
…A |
…Б |
|
Число электронов внешнего уровня |
|
8 |
|
|
0 |
2 |
2 |
2. |
|
Значение n для электронов внешнего уровня |
|
|
|
|
|
|
|
|
Уровни состоят из подуровней, на которых располагаются орбитали.
|
Максимальное число электронов на уровнях |
Максимальное число электронов на подуровнях |
|
1 уровень – 2 е 2 уровень – 8 е 3 уровень - 8 е (18 е) 4 уровень – 18 е |
s – подуровень – 2 е p – подуровень – 6 е d – подуровень – 10 е f – подуровень – 14 е |
Правило распределения электронов по подуровням (правило Клечковского)
1s 2s 2p 3s 3p 4s 3d 4p 5s
Упражнение 3. Изобрази схемы строения атомов: S, N, Li, Ca, Al.

Cl
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.