Технологическая карта урока химии по теме «Растворение. Растворимость веществ в воде. Классификация растворов» (8 класс)
Разработки уроков
docx
химия
8 кл
24.09.2019
В технологической карте описаны основные этапы урока:
1. Организационный момент. 1 мин.
2. Мотивационно – ориентировочный. 2 мин
3. Актуализация знаний. 5 мин
4. Постановка учебной задачи (целеполагание) 2 мин
5. Учебно-познавательная деятельность (изучение нового материала) 20 мин
6. Самостоятельная работа с различными источниками информации. 5 мин
7. Физкультминутка 1мин.
8. Применение знаний в новой ситуации2 мин.
9. Закрепление, обобщение и систематизация полученных знаний 5 мин
10. Подведение итогов урока. Рефлексивная деятельность. 2 мин
11. Информация о домашнем задании на следующий урок.
пояс.записка технол.карта ход урока.docx
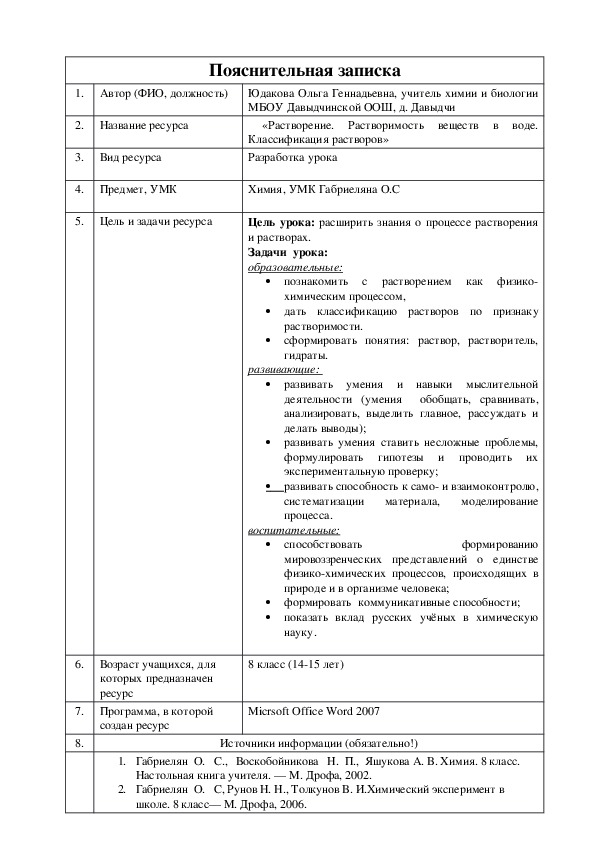
Пояснительная записка
1. Автор (ФИО, должность) Юдакова Ольга Геннадьевна, учитель химии и биологии
2. Название ресурса
3.
Вид ресурса
МБОУ Давыдчинской ООШ, д. Давыдчи
«Растворение. Растворимость веществ в воде.
Классификация растворов»
Разработка урока
4. Предмет, УМК
Химия, УМК Габриеляна О.С
5. Цель и задачи ресурса
Цель урока: расширить знания о процессе растворения
и растворах.
Задачи урока:
образовательные:
познакомить с растворением как физико
химическим процессом,
дать классификацию растворов по признаку
растворимости.
сформировать понятия: раствор, растворитель,
гидраты.
развивающие:
развивать умения и навыки мыслительной
деятельности (умения обобщать, сравнивать,
анализировать, выделить главное, рассуждать и
делать выводы);
развивать умения ставить несложные проблемы,
формулировать гипотезы и проводить их
экспериментальную проверку;
развивать способность к само и взаимоконтролю,
моделирование
систематизации материала,
процесса.
воспитательные:
способствовать
формированию
мировоззренческих представлений о единстве
физикохимических процессов, происходящих в
природе и в организме человека;
формировать коммуникативные способности;
показать вклад русских учёных в химическую
науку.
6.
Возраст учащихся, для
которых предназначен
ресурс
7. Программа, в которой
создан ресурс
8 класс (1415 лет)
Micrsoft Office Word 2007
8.
Источники информации (обязательно!)
1. Габриелян О. С., Воскобойникова Н. П., Яшукова А. В. Химия. 8 класс.
Настольная книга учителя. — М. Дрофа, 2002.
2. Габриелян О. С, Рунов Н. Н., Толкунов В. И.Химический эксперимент в
школе. 8 класс— М. Дрофа, 2006. 3. Габриелян О. С., Яшукова А. В. Химия. 8 класс. Методическое пособие. —
М. Дрофа, 2003
Методическая разработка урока химии в 8 классе
Растворение. Растворы. Растворимость веществ в воде.
Разработала: учитель химии
Юдакова
О.Г,.
первая
квалификационная
категория
Представлен конспект урока в 8 классе по УМК Габриеляна О.С., (учебник издательства
«Дрофа», 2018 год). Урок проводится в общеобразовательном классе. Данный урок является
вводным в разделе «Растворение. Растворы. Реакции ионного обмена и окислительно –
восстановительные реакции». Это последний и самый важный раздел в курсе химии 8 класса.
Тип урока – Изучение и первичное закрепление новых знаний и способов деятельности.
Формы организации познавательной деятельности учащихся на уроке: фронтальная, парная,
индивидуальная, групповая.
Методы и методические приемы: эвристическая беседа, наглядноиллюстративные
(демонстрационный опыт), частичнопоисковые(работа по учебнику), индивидуальное задание,
задание в парах, задание в группах.
Используемые педагогические технологии: технология сотрудничества, ИК технологии,
проблемное обучение, элементы личностно – ориентированной технологии;
Тема: Растворение. Растворимость веществ в воде. Классификация растворов
Цель урока: расширить знания о процессе растворения и растворах.
Задачи урока:
образовательные:
познакомить с растворением как физикохимическим процессом,
дать классификацию растворов по признаку растворимости.
сформировать понятия: раствор, растворитель, гидраты.
развивающие:
развивать умения и навыки мыслительной деятельности (умения обобщать,
сравнивать, анализировать, выделить главное, рассуждать и делать выводы);
развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их
экспериментальную проверку;
развивать способность к само и взаимоконтролю, систематизации материала,
моделирование процесса.
воспитательные:
способствовать формированию мировоззренческих представлений о единстве физико
химических процессов, происходящих в природе и в организме человека;
формировать коммуникативные способности;
показать вклад русских учёных в химическую науку.
Оборудование:
компьютер, проектор, мультимедийная презентация;
таблица растворимости кислот, оснований, солей в воде
термометр
химическая посуда: штатив с пробирками, стаканы, колбы, стеклянные палочки
химические вещества: песок, речная и морская вода, сульфат меди, хлорид натрия,
гидроксид натрия, нитрат калия, карбонат кальция, хлорид кальция, гидроксид кальция.
Планируемые результаты:
познавательные УУД: самостоятельное выделение и формулирование познавательной цели,
поиск и выделение информации, моделирование, формулирование проблемы, анализ, с целью
выделения признаков, синтез как составление целого из частей, выбор оснований и критериев
для сравнения установление причинноследственных связей;
личностные УУД: установление обучающимися связи между целью учебной деятельности и ее
мотивом, оценивание усеваемого материала исходя из личностных ценностей;
регулятивные УУД:
целеполагание, планирование, оценка результатов работы, внесение
необходимых дополнений и коррективов в план и способ действия в случае расхождения
эталона, реального действия и его результата;
коммуникативные УУД: планирование учебного сотрудничества с учителем и сверстниками,
инициативное сотрудничество в поиске и сборе информации. Деятельность учителя
Технологическая карта урока
Деятельность
учащихся
Примечание
I) Этап урока: Организационный момент.
1.Приветствие:
Здравствуйте ребята! Я рада приветствовать вас!
Сегодня у нас на уроке присутствуют гости. Давайте
повернемся к гостям и улыбнемся им. Молодцы!
Присаживайтесь. А мы продолжаем изучение
интереснейшей науки химии.
II)Этап урока: Мотивационно ориентировочный
Цель: Включение детей в деятельность на личностнозначимом уровне.
Учащиеся
приветствуют учителя
1.
Настрой учащихся на
учебную деятельность
– Сегодня наш урок мы начнем со слов великого
мыслителя П. Лапласа:
То, что мы знаем – ограничено;
То, что не знаем – бесконечно.
– Кто согласен с этой мыслью? Поднимите руку.
– У кого есть другое мнение? Поднимите две руки.
– Действительно, каждый сидящий здесь человек:
ученик 8 класса, учительязыковед, биолог, химик и
даже ученый не могут заявить, что он все знает. В
правоте этих слов мы сегодня с вами убедимся. И
пусть эти замечательные слова станут девизом нашего
урока.
– Так, что же мы с вами уже знаем?
– Покажем свои знания и начнем с химической
разминки.
III) Этап урока: Актуализация знаний
Цель. Повторение изученного материала, необходимого для «открытия нового знания»
Химическая разминка.
1. Обратим внимание на этот тренажер:
1
2
3
I
AlAl
OO
33
22
SOSO
HH
44
22
COCO
22
II
IV
V
Zn(OH)2
HNO3
H2S
HCI
ZnCI2
HBr
Ba(OH)
2
ZnSO4
H2CO3
Чтение химических формул, название веществ. Игра
«Третий лишний».
2.Химические реакции.
На прошлых уроках мы и научились писать
химические предложения в виде химических
уравнений. Как в русском языке предложения бывают
восклицательные, вопросительные и побудительные,
Учащиеся отвечают на
Определяются
вопросы.
имеющиеся
знания учащихся
Ученики работают с
карточками.
Определяются
имеющиеся химия?
Ученики
формулируют тему,
цели урока.
У вас на столах лежат карточки, подпишите их,
выполните предложенное задание. Время выполнения
– 3 минут.
Все справились с предложенным заданием. Положите
карточки на край стола.
IV Этап урока: Постановка учебной задачи
Цель. Формулирование темы и целей урока.
Вспомните, что изучает
В каком виде могут встречаться вещества в природе?
Обратите внимание на опыт.(растворение медного
купороса)
Что произошло с твердым веществом?
Итак, тема сегодняшнего нашего урока: Растворы.
Растворение. Типы растворов.
Давайте вместе подумаем над целями нашего урока.
расширить знания о процессе растворения и
растворах.
На какие вопросы мы должны ответить на
сегодняшнем уроке, чтобы достигнуть цели.
1) Что такое растворение, какой это процесс –
физический или химический?
2) На какие группы делятся вещества по
способности растворяться в воде?
3) От каких факторов зависит растворимость
веществ в воде?
Необходимый инструктаж:
Мы будем с вами работать сегодня вот с такими
картами
V ) Этап урока: Учебнопознавательная деятельность.
Цель. Познакомить с процессом растворения, на основе экспериментальных данных.
1.Беседа с учащимися:
Растворы играют важную роль в природе, науке и
технике. Особую роль на нашей планете играет вода.
2.Сообщение ученика:
3. Изучение свойств растворов занимает важное
место в современной науке. В химии процессы
растворения рассматриваются с позиций трёх теорий:
Ученики знакомятся с
маршрутным листом
Учащиеся
заслушивают
сообщение
Мобилизация и
настрой
учащихся на
изучение новой
темы
химические реакции бывают? ( соединения,
разложения, замещения, обмена)
знания учащихся
1. Физической
2. Химической
3. Физикохимической
VI) Этап урока: Самостоятельная работа с различными источниками информации.
Цель.Проверить умения в нахождении необходимой информации, её структурировании и
преобразовании.
Давайте представим себя в роли сторонников этих
теорий. 1 партасторонники физической теории, 2
партахимической теории, 3 рядфизикохимической
теории.
Через несколько минут вы должны объяснить
Самостоятельная основную идею своей теории и назвать имена учёных,
сторонников этой теории (обсуждение
сопровождается показом слайдов со схемой и фото
учёных).
работа по учебнику.
Заполнение таблицы
Признаки
Теория
сравнения
Сторонники
теории
(авторы)
Определение
растворения
химическая
Д.И.
Менделеев,
В.И. Каблуков
Результатом
химического
взаимодействи
я
растворенного
вещества с
молекулами
воды
физико
химическа
я
Д.И.
Менделеев
Результат
диффузии
и
химическог
о
взаимодейс
твия
(учебник
«Основы
химии»)
физическ
ая
Вант
Гофф,
Аррениус
и
Оствальд
Результат
диффузи
и, т е.
проникно
вения
растворе
нного
вещества
в
промежут
ки между
молекула
ми воды
Действительно доказательством химического
взаимодействия служат такие признаки химических
реакций как выделение или поглощение тепла при
растворении.
Давайте посмотрим Видеофрагмент.
В результате химического взаимодействия
образуются соединения гидраты – непрочные
соединения веществ с водой, существующие в
растворе.
Косвенным доказательством гидратации является
существование твердых кристаллогидратов.
Кристаллогидраты – соли и другие твердые
вещества, в состав которых входит вода. (запись в
тетрадь)
В этом случае вода называется кристаллизационной.
К кристаллогидратам относится хорошо
известная всем соль голубого цвета – медный купорос
CuSO4
. 5H2O
Na2CO3*10H2O – кристаллическая сода;
FeSO4*7H2O –железный купорос
CaSO4*2H2O гипс
Учащиеся
работают в
маршрутном
листе–
заполняют
таблицу
Учащиеся
просматривают
видеофрагмент.
Данный этап
направлен на
достижение
поставленных
целей и задач:
расширить
знания о
процессе
растворения и
растворах;
познакомить с
растворением
как физико
химическим
процессом,
научить давать
классификацию
растворов по
признаку
растворимости и
выяснять
причины
различной
растворимости
веществ,
сформировать
понятия:
раствор,
растворитель,
растворение. В настоящее время принята теория, объединяющая
обе точки зрения – физикохимическая теория
(Менделеев "Основы химии"
Растворение – физикохимический процесс.
Раствор – однородная система, состоящая из частиц
растворенного вещества, растворителя и продуктов
их взаимодействия.
Любой раствор состоит из растворенного вещества
(1 или несколько) – компоненты раствора и
растворителя. Тот компонент, который
количественно преобладает и находится в том же
агрегатном состоянии, что и раствор, называют
растворителем. Растворы отличаются от других
смесей тем, что частицы растворенного вещества
распределяются в растворителе равномерно.
VII) Физкультминутка
• Очень химию мы любим!
• Шеей влево, вправо крутим.
• Воздух – это атмосфера,
• Если правда, топай смело.
• В атмосфере есть азот,
• Делай вправо поворот.
• Так же есть и кислород,
• Делай влево поворот,
• Чем выше вверх, тем воздух реже.
• Друг другу улыбнулись нежно!
Учащиеся записывают
определения в
маршрутный лист
Ученики выполняют
физические
упражнения
VIII) Этап урока: Применение знаний в новой ситуации
Цель: Активизировать деятельность учащихся с помощью проблемных вопросов и
демонстрационных опытов
Итак, при растворении веществ в воде и в других
растворителях образуются растворы.
Растворы – однородная система, состоящая из частиц
растворенного вещества, растворителя и продуктов
их взаимодействия.
По агрегатному состоянию растворы бывают:
Учащиеся работают в
маршрутном листе
Задание: приведите примеры жидких растворов.
Как вы считаете, от каких факторов зависит
растворимость веществ в воде?
1. от температуры (перманганат калия растворяют в
горячей и холодной воде)
2. от природы растворителя (растворяют медный
купорос в воде и спирте)
Ученики выполняют
опыты, на основе
наблюдений делают 3. от природы растворённого вещества ( три стакана с
водой, растворяем сахар, оксид кальция, стекло)
В учебнике есть таблица растворимости
некоторых веществ, в зависимости от температуры.
Как правило, растворимость твёрдых веществ в воде
увеличивается с повышением температуры. В
учебнике найдите таблицу растворимости. Если
растворять в воде хлорид калия, то при комнатной
температуре может раствориться только 35г соли в
100 г воды; сколько бы мы не перемешивали раствор,
соли в нём больше не растворится – раствор будет
насыщен этой солью при данной температуре.
вывод от чего зависит
растворимость веществ.
Совместная работа с
учебником
Учащиеся работают в
маршрутном листе
Насыщенным раствором называется такой
раствор, в котором при данной температуре
вещество больше не растворяется.
Если же при этой температуре в 100г воды растворить
хлорида калия меньше, чем 35г, то раствор будет
ненасыщенным.
Ненасыщенным называется такой раствор, в
котором при данной температуре находится
меньше растворяемого вещества, чем в его
насыщенном растворе.(слайды)
При охлаждении насыщенного раствора возникает
избыток растворённого вещества, если оно не
выпадает в осадок, то образуется пересыщенный
раствор.
Пересыщенным раствором называется такой
раствор, в котором при данной температуре
находится в растворённом состоянии больше
вещества, чем в его насыщенном растворе при
тех же условиях.
При работе с различными веществами важно
знать их растворимость в воде. Если при комнатной
температуре в 100г воды растворяется больше 1г
вещества, то вещество считается хорошо
растворимым. Если меньше 1г – малорастворимым.
Растворимость которых меньше 0,01г – практически
нерастворимы.
Для того, чтобы определить растворимость
веществ в воде, необходимо пользоваться таблицей
растворимости солей, кислот и оснований в воде.
В верхней строке таблицы – положительные частицы
(катионы), в левом столбце – отрицательные частицы
(анионы). Ищем точку пересечения и смотрим букву –
Учащиеся работают с
таблицей
растворимости,
отвечают на вопросы это и есть растворимость.
Задание: определите растворимость CaCO3, CuSO4,
Al(OH)3, AgCl.
Но нерастворимых веществ не существует. Даже у
самого плохо растворимого вещества есть какаято
минимальная растворимость (пример золота и
серебра).
По количеству растворенного вещества:
Концентрированный раствор — раствор с высоким
содержанием растворённого вещества.
Разбавленный раствор раствор, содержащий малое
количество растворённого вещества.
Учащиеся отвечают на
вопросы, повторение
пройденного материала
IX) Этап урока: Закрепление и контроль знаний
Цель: Обобщить изученный материал и расширить знания учащихся
Итак, подведем итоги того что мы сегодня узнали
1. Укажите растворитель и растворенное вещество в:
спиртовом растворе йода, водном растворе сахара,
растворе натрия и воды.
2. Вставьте пропущенные слова:
Природная вода практически не является чистым
веществом, а представляет собой
_____________. Растворы – это однородные
___________. Они состоят из ____________ и
__________. ________ — это преобладающий
компонент раствора, находящийся в том же
агрегатном состоянии, что и раствор. Способность
вещества растворяться характеризуется
_______________. Раствор, в котором данное
вещество в данных условиях больше не
может растворяться, называется ____________.
Раствор, в котором растворяемое
вещество в данных условиях еще может растворяться,
называется ____________.
В результате химического взаимодействия
образуются соединения _______.
Ответы: раствор, системы, растворенного вещества и
растворителя,
растворитель, растворимостью, насыщенным
ненасыщенным, гидраты
Определение
степени и
качества
усвоения
нового
материала.
Добиться в
ходе
закрепления
повышения
уровня
осмысления
изученного
материала и
глубины его
понимания
Отработка и
полученных на
уроке знаний и
умений.
X) Этап урока: Рефлексия
Цель. Осмысление и оценка результатов проведенных исследований, оценка и самооценка учебной
деятельности. 1. Ребята, скажите, узнали ли вы на сегодняшнем
уроки чтото новое для вас? Что вы считаете главным
на уроке? Что было трудным?
1. Назовите не менее 10 слов, связанных с изученным
на уроке. (Учитель записывает
слова, которые называют ученики).
3. Осуществите самооценку своей деятельности в
течение урока и уровня знаний по
изученной теме.
Если вы были внимательны на уроке, уверены в себе,
и все изученные вопросы усвоили, поставьте себе
«5».
Если вы были внимательны, усвоили материал в
целом, а на вопросы затруднялись ответить, поставьте
себе «4».
Кто сомневается, поставьте себе «3».
XI) Этап урока: Домашнее задание
I уровень: §35, упр. 5, 7;
II уровень: §35, упр. 5, 7 + сообщение на тему «Вода в
природе», «История водопровода»,
«Удивительные свойства воды», «Вода в поэзии и
прозе».
Отвечают на вопросы
Выявление
интереса к теме
учащихся.
Учащиеся
осуществляют
самооценку
Учащиеся записывают
домашнее задание
Мотивирование
на обязательное
выполнение
домашнего
задания
Урок мне хотелось бы закончить арабская пословица
Ни один сосуд не вмещает больше своего объема,
кроме сосуда знаний; он постоянно расширяется Ход урока
I) Этап урока: Организационный момент.
Здравствуйте ребята! Я рада приветствовать вас! Сегодня у нас на уроке присутствуют
гости. Давайте повернемся к гостям и улыбнемся им. Молодцы! Присаживайтесь. А мы
продолжаем изучение интереснейшей науки химии.
II)Этап урока: Мотивационно ориентировочный
Цель: Включение детей в деятельность на личностнозначимом уровне.
– Сегодня наш урок мы начнем со слов великого мыслителя П. Лапласа:
То, что мы знаем – ограничено;
То, что не знаем – бесконечно.
– Кто согласен с этой мыслью? Поднимите руку.
– У кого есть другое мнение? Поднимите две руки.
– Действительно, каждый сидящий здесь человек: ученик 8 класса, учительязыковед, биолог,
химик и даже ученый не могут заявить, что он все знает. В правоте этих слов мы сегодня с вами
убедимся. И пусть эти замечательные слова станут девизом нашего урока.
– Так, что же мы с вами уже знаем?
– Покажем свои знания и начнем с химической разминки.
III) Этап урока: Актуализация знаний
Цель. Повторение изученного материала, необходимого для «открытия нового знания»
Химическая разминка.
1. Обратим внимание на этот тренажер:
1
I
Al2O3
II
Zn(OH)2
2 H2SO4
HCI
IV
HNO3
ZnCI2
V
H2S
HBr
CO2
3
Чтение химических формул, название веществ. Игра «Третий лишний».
2.Химические реакции.
Ba(OH)2
H2CO3
ZnSO4
На прошлых уроках мы и научились писать химические предложения в виде химических
уравнений. Как в русском языке предложения бывают восклицательные, вопросительные и
побудительные, химические реакции бывают? ( соединения, разложения, замещения, обмена)
У вас на столах лежат карточки, подпишите их, выполните предложенное задание. Время
химия?
выполнения – 5 минут.
Все справились с предложенным заданием. Положите карточки на край стола.
IV Этап урока: Постановка учебной задачи
Цель. Формулирование темы и целей урока.
Вспомните, что изучает
В каком виде могут встречаться вещества в природе?
Итак, тема сегодняшнего нашего урока: Растворы. Растворение. Типы растворов.
Давайте вместе подумаем над целями нашего урока.
растворения и растворах.
На какие вопросы мы должны ответить на сегодняшнем уроке, чтобы достигнуть цели.
1) Что такое растворение, какой это процесс – физический или химический?
2) На какие группы делятся вещества по способности растворяться в воде?
3) От каких факторов зависит растворимость веществ в воде?
V ) Этап урока: Учебнопознавательная деятельность.
Цель. Познакомить с процессом растворения, на основе экспериментальных данных.
расширить знания о процессе Растворы играют важную роль в природе, науке и технике. Особую роль на нашей планете
играет вода.
Сообщение делает ученик.
Изучение свойств растворов занимает важное место в современной науке. В химии процессы
растворения рассматриваются с позиций трёх теорий:
1. Физической
2. Химической
3. Физикохимической
VI) Этап урока: Самостоятельная работа с различными источниками информации.
Цель.Проверить умения в нахождении необходимой информации, её структурировании и
преобразовании.
Давайте представим себя в роли сторонников этих теорий. 1 партасторонники физической
теории, 2 партахимической теории, 3 рядфизикохимической теории.
Самостоятельная работа по учебнику. Через несколько минут вы должны объяснить
основную идею своей теории и назвать имена учёных, сторонников этой теории (обсуждение
сопровождается показом слайдов со схемой и фото учёных).
Теории растворов:
Представители физической теории растворов развивали такие ученые как Я.Х.ВантГофф,
С.Аррениус, В.Оствальд. Они считали, что процесс растворения является результатом
диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды.
Сторонники химической теории, Д.И.Менделеев, И.А.Каблуков, доказывали, что растворение –
это результат химического взаимодействия растворенного вещества с молекулами воды
(заполнение таблицы).
Действительно доказательством химического взаимодействия служат такие признаки
химических реакций как выделение или поглощение тепла при растворении.
Давайте посмотрим Видеофрагмент.
В результате химического взаимодействия образуются соединения гидраты – непрочные
соединения веществ с водой, существующие в растворе.
Косвенным доказательством гидратации является существование твердых кристаллогидратов.
Кристаллогидраты – соли и другие твердые вещества, в состав которых входит вода. (запись в
тетрадь)
В этом случае вода называется кристаллизационной.
К кристаллогидратам относится хорошо известная всем соль голубого цвета – медный
купорос CuSO4
. 5H2O
Na2CO3*10H2O – кристаллическая сода; FeSO4*7H2O –железный купорос
CaSO4*2H2O гипс
В настоящее время принята теория, объединяющая обе точки зрения – физикохимическая
теория (Менделеев "Основы химии"
Растворение – физикохимический процесс.
Раствор – однородная система, состоящая из частиц растворенного вещества, растворителя и
продуктов их взаимодействия.
VII) Физкультминутка
VIII) Этап урока: Применение знаний в новой ситуации
Цель: Активизировать деятельность учащихся с помощью проблемных вопросов и
демонстрационных опытов
Типы растворов:
Итак, при растворении веществ в воде и в других растворителях образуются растворы.
Растворы – однородная система, состоящая из частиц растворенного вещества, растворителя и
продуктов их взаимодействия. температуры. Как правило, растворимость твёрдых веществ в воде увеличивается с повышением
температуры. В учебнике найдите таблицу растворимости. Если растворять в воде хлорид
калия, то при комнатной температуре может раствориться только 35г соли в 100 г воды; сколько
бы мы не перемешивали раствор, соли в нём больше не растворится – раствор будет насыщен
этой солью при данной температуре.
Насыщенным раствором называется такой раствор,
в котором при данной температуре вещество больше
не растворяется.
Если же при этой температуре в 100г воды растворить
хлорида калия меньше, чем 35г, то раствор будет
ненасыщенным.
Ненасыщенным называется такой раствор, в
По агрегатному состоянию растворы бывают:
Задание: приведите примеры жидких растворов.
Как вы считаете, от каких факторов зависит растворимость веществ в воде?
1. от температуры (перманганат калия растворяют в горячей и холодной воде)
2. от природы растворителя (растворяют медный купорос в воде и спирте)
3. от природы растворённого вещества ( три стакана с водой, растворяем сахар, гидроксид
кальция, стекло)
В учебнике есть таблица растворимости некоторых веществ, в зависимости от
котором при данной температуре находится меньше растворяемого вещества, чем в
его насыщенном растворе.(слайды)
При охлаждении насыщенного раствора возникает избыток растворённого вещества, если оно не
выпадает в осадок, то образуется пересыщенный раствор.
Пересыщенным раствором называется такой раствор, в котором при данной
температуре находится в растворённом состоянии больше вещества, чем в его
насыщенном растворе при тех же условиях.
При работе с различными веществами важно знать их растворимость в воде. Если при
комнатной температуре в 100г воды растворяется больше 1г вещества, то вещество считается
хорошо растворимым. Если меньше 1г – малорастворимым. Растворимость которых меньше
0,01г – практически нерастворимы.
Для того, чтобы определить растворимость веществ в воде, необходимо пользоваться
таблицей растворимости солей, кислот и оснований в воде.
В верхней строке таблицы – положительные частицы (катионы), в левом столбце –
отрицательные частицы (анионы). Ищем точку пересечения и смотрим букву – это и есть
растворимость.
Задание: определите растворимость CaCO3, CuSO4, Al(OH)3, AgCl.
Но нерастворимых веществ не существует. Даже у самого плохо растворимого вещества есть
какаято минимальная растворимость (пример золота и серебра).
По количеству растворенного вещества: Концентрированный раствор — раствор с высоким
содержанием растворённого вещества.
Разбавленный раствор раствор, содержащий малое
количество растворённого вещества. (
Массовая доля вещества – это отношение массы
растворенного вещества к массе раствора.
IX) Этап урока: Закрепление и контроль знаний
Цель: Обобщить изученный материал и расширить знания учащихся
Итак, подведем итоги того что мы сегодня узнали
1. Укажите растворитель и растворенное вещество в: спиртовом растворе йода, водном растворе
сахара, растворе натрия и воды.
2. Вставьте пропущенные слова:
Природная вода практически не является чистым веществом, а представляет собой
_____________. Растворы – это однородные ___________. Они состоят из ____________ и
__________. ________ — это преобладающий компонент раствора, находящийся в том же
агрегатном состоянии, что и раствор. Способность вещества растворяться характеризуется
_______________. Раствор, в котором данное вещество в данных условиях больше не
может растворяться, называется ____________. Раствор, в котором растворяемое
вещество в данных условиях еще может растворяться, называется ____________.
В результате химического взаимодействия образуются соединения _______.
Ответы: раствор, системы, растворенного вещества и растворителя,
растворитель, растворимостью, насыщенным ненасыщенным, гидраты
X) Этап урока: Рефлексия
Цель. Осмысление и оценка результатов проведенных исследований, оценка и самооценка
учебной деятельности.
Рефлексия и подведение итогов:
1. Ребята, скажите, узнали ли вы на сегодняшнем уроки чтото новое для вас? Что вы считаете
главным на уроке? Что было трудным?
2. Назовите не менее 10 слов, связанных с изученным на уроке. (Учитель записывает
слова, которые называют ученики).
3. Осуществите самооценку своей деятельности в течение урока и уровня знаний по
изученной теме.
Если вы были внимательны на уроке, уверены в себе, и все изученные вопросы усвоили,
поставьте себе «5».
Если вы были внимательны, усвоили материал в целом, а на вопросы затруднялись ответить,
поставьте себе «4».
Кто сомневается, поставьте себе «3».
XI) Этап урока: Домашнее задание
Домашнее задание:
I уровень: §35, упр. 5, 7;
II уровень: §35, упр. 5, 7 + сообщение на тему «Вода в природе», «История водопровода»,
«Удивительные свойства воды», «Вода в поэзии и прозе».
Урок мне хотелось бы закончить арабская пословица
Ни один сосуд не вмещает больше своего объема,
кроме сосуда знаний; он постоянно расширяется
Спасибо за урок!
Используемая литература:
1. Габриелян О. С. Настольная книга учителя. Химия. 8 класс / О. С. Габриелян, Н. П.
Воскобойникова, А. В. Яшукова. – М.: Дрофа, 2002. 2. Габриелян О. С. Химический эксперимент в школе. 8 класс: учебнометод. пособие / О. С.
Габриелян, Н. Н. Рунов, В. И. Толкунов. – М.: Дрофа, 2005.
3. Гуревич О. Р. Тематическое и поурочное планирование по химии: 8 класс: к учебнику О. С.
Габриеляна «Химия 8 клас»/ О. Р. Гуревич. – М.: Экзамен, 2006.
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
24.09.2019
Посмотрите также:
© ООО «Знанио»
С вами с 2009 года.
![]()
О портале

