
Класс: 8 класс
Тема урока: «Строение атома»
Вид урока: интегрированный урок (физика, химия)
Тип урока: урок изучения нового материала
Цель урока: изучить строения атома
Задачи:
обучающие:
- познакомить учащихся с историческими фактами развития представлений о строении атома, моделями атома Томсона и Резерфорда;
- изучить планетарную модель атома, состав атома и атомного ядра;
- сформировать у обучающихся понятия положительный и отрицательный ионы
развивающие:
содействовать развитию навыков определения состава атома, состава ядра атома по периодической системе химических элементов;
развивать творческие и интеллектуальные способности учащихся, самостоятельность, умение работать в группах
воспитательные:
развивать познавательный интерес к физике и химии;
вырабатывать умение слушать и быть услышанными;
вырабатывать культуру умственного труда и естественно-материалистическое мировоззрение
Оборудование:
таблица периодической системы химических элементов Д. И. Менделеева;
модель-апликация «Модель атома Резерфорда-Бора»
Ход урока:
1. Организационный момент
2. Мотивация и целеполагание
На протяжении столетий ученые не могли дать объяснения наблюдаемым электрическим явлениям. Это стало возможно только после открытия строения атомов.
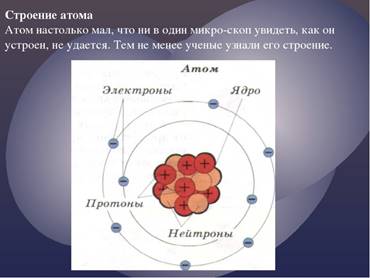
Кто помнит, что же такое атом? (Атом это мельчайшая структурная единица химического элемента.) Молекула любого вещества состоит из атомов. Атомы всех веществ, хотя и отличаются др от друга, состоят из протонов, нейтронов и электронов.
Открываем тетради и записываем тему урока: Строение атома.
Сегодня мы объединим уроки физики и химии, чтобы раскрыть строение одной очень маленькой частички – атома. В конце урока вы скажите мне почему столь маленькой частице так много внимания?
Совершим небольшой экскурс в историю развития взглядов на строение атома, начиная с древних времен до начала 20 века.
Слово «атом» придумал очень давно более 2500 лет назад древнегреческий философ Демокрит, согласно которому атом – мельчайшая химически неделимая частица вещества. У Демокрита и его сторонников появились противники. Одним из них является Аристотель. Он считал, что тело можно делить до бесконечности.
В России идеи о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов. Он различал два вида частиц материи и дал им названия «элементы» (равные по понятию «атом») и «корпускулы» (равные по понятию «молекула»). По Ломоносову, «элемент» есть часть тела, не состоящая из каких-либо других меньших частиц, а «корпускула» есть собрание элементов в одну небольшую массу. В переводе с греческого «атом» означает неделимый.
В центре любого атома расположено его ядро, которое состоит из протонов (+) и нейтральных частиц - нейтронов. Поэтому ядро любого атома заряжено положительно, и массы протона и нейтрона приблизительно равны.
Вокруг положительно заряженного ядра, как планеты вокруг Солнца, движутся отрицательно заряженные частицы - электроны. Такое движение электронов обусловлено взаимодействием с положительно заряженным ядром.
Число электронов, движущихся вокруг ядра атома, равно числу протонов в ядре. Поэтому суммарный отрицательный заряд всех электронов атома по модулю равен положительному заряду его ядра.
Это значит, что общий заряд атома равен нулю, следовательно атом в целом электрически нейтрален.
 Однако, существует одно исключение: у
водорода нет нейтронов в ядре, поскольку всё ядро водорода состоит из одного
протона, вокруг которого вращается один электрон. У гелия, например, ядро
состоит из двух протонов и двух нейтронов, а вокруг вращается два электрона.
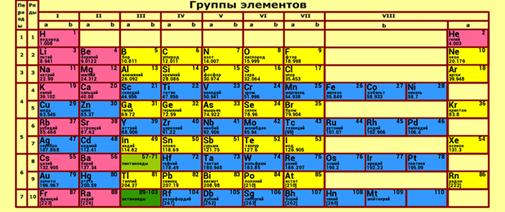
Вообще из периодической системы химических элементов Менделеева можно узнать
число протонов в ядре любого элемента, поскольку порядковый номер элемента
совпадает с этим числом. При нормальных условиях, атом содержит то же число
электронов. Например, у азота 7 протонов, а у хлора — 17.
Однако, существует одно исключение: у
водорода нет нейтронов в ядре, поскольку всё ядро водорода состоит из одного
протона, вокруг которого вращается один электрон. У гелия, например, ядро
состоит из двух протонов и двух нейтронов, а вокруг вращается два электрона.
Вообще из периодической системы химических элементов Менделеева можно узнать
число протонов в ядре любого элемента, поскольку порядковый номер элемента
совпадает с этим числом. При нормальных условиях, атом содержит то же число
электронов. Например, у азота 7 протонов, а у хлора — 17.
Мы можем предположить, что возможно каким-то образом отнять электрон у нейтрального атома или присоединить электрон к нейтральному атому. Действительно, это предположение верно, и такие процессы часто происходят. Электроны одних атомов могут переходить к другим атомам. Атомы с неравным количеством протонов и электронов называются ионами.
Если атом потерял один или несколько электронов, то он будет иметь положительный заряд и называться положительным ионом.
Если же атом, напротив, приобрел один или несколько лишних электронов, то он будет иметь отрицательный заряд и называться отрицательным ионом.
.
В некоторых веществах отдельные электроны покидают свое место в атоме и свободно движутся по всему объему вещества, подобно молекулам газа. Такие электроны называют свободными.
Тела, изготовленные из веществ, в которых имеются свободные носители заряда, называют проводниками.
Вещества, в которых нет свободных носителей заряда, называют диэлектриками. Тела, изготовленные из веществ-диэлектриков, иногда называют изоляторами.
6. Первичная проверка усвоения материала
Для закрепления материала выполним несколько простых упражнений.
Задача 1. Известно, что атом кислорода электрически нейтрален, а в его ядре находится 16 частиц. Сколько в атоме кислорода протонов, нейтронов и электронов?
В таблице Менделеева кислород имеет порядковый номер 8. Значит, в нём 8 протонов. Поскольку атом электрически нейтрален, в нём должно быть 8 электронов, чтобы уравновесить заряд ядра. Нам дано, что в ядре 16 частиц. Т.к. 8 из них являются протонами, оставшиеся 8 — это нейтроны. Значит, в атоме кислорода 8 нейтронов и 8 протонов, которые формируют ядро, а вокруг этого ядра вращаются 8 электронов.
Задача 2. Как называется атом кальция, который потерял 2 электрона? Каков заряд этого атома?
Для ответа на этот вопрос нам не нужна таблица Менделеева. Т.к. атом изначально нейтрален, то при потере электронов, он становится положительным ионом. Сколько бы ни было протонов в ядре, заряд каждого из них уравновешивается отрицательным зарядом электрона, за исключением двух, поскольку в атоме не хватает двух электронов. Поэтому заряд данного иона будет равен суммарному заряду двух протонов.
Задача 3. Атом содержит 6 нейтронов и электрически нейтрален. Можно ли найти число протонов и электронов?
Нет, потому что число протонов не всегда совпадает с числом нейтронов. Можно лишь сказать, что число протонов в этом атоме равно числу электронов, поскольку в противном случае, это был бы ион. Шесть нейтронов содержится в нормальном атоме углерода, но, 6 нейтронов могут находиться в некоторой разновидности атома гелия. Такие разновидности называются изотопами и часто являются радиоактивными. Подобные явления будут изучены подробнее в старших классах.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.