
Теория химического строения органических веществ
Составила: Савицкая Е.Б.
Содержание урока: Теории строения органических соединений: предпосылки создания, основные положения. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Гомология, изомерия. Зависимость свойств веществ от химического строения. Основные направления развития теории химического строения. Зависимость появления токсичности у органических соединений от состава и строения их молекул (длина углеродной цепи и степень ее разветвленности, наличие кратных связей, образование циклов и пероксидных мостиков, присутствие атомов галогенов), а также от растворимости и летучести соединения.
Цели урока:
Ход урока:
1. Организационный момент.
2. Актуализация знаний учащихся.
1) Что изучает органическая химия?
2) Какие вещества называют изомерами?
3) Какие вещества называют гомологами?
4) Назовите известные вам теории, возникшие в органической химии в начале XIX века.
5) Какими недостатками обладала теория радикалов?
6) Какими недостатками обладала теория типов?
3. Постановка целей и задач урока.
Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон, сформулированный Д.И. Менделеевым в 1869 г., вскрыл зависимость валентности элемента от его положения в периодической системе.
Оставалось неясным большое многообразие органических веществ, имеющих одинаковый качественный и количественный состав, но разные свойства. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. Йенс Якоб Берцелиус предложил называть эти вещества изомерами.
Ученые многих стран своими работами подготовили почву для создания теории, объясняющей строение и свойства органических веществ.
На съезде немецких естествоиспытателей и врачей в городе Шпейере был прочитан доклад, называвшийся “Нечто в химическом строении тел”. Автором доклада был профессор Казанского университета Александр Михайлович Бутлеров. Именно это самое “нечто” и составило теорию химического строения, которая легла в основу наших современных представлений о химических соединениях.
Органическая химия получила прочную научную основу, обеспечившую ее стремительное развитие в последующее столетие вплоть до наших дней. Эта теория позволила предсказывать существование новых соединений и их свойства. Понятие о химическом строении позволило объяснить такое загадочное явление, как изомерия.
Основные положения теории
химического строения сводятся к следующему:
1. Атомы в молекулах органических веществ соединяются в определенной
последовательности согласно их валентности.
2. Свойства веществ определяются качественным, количественным составом, порядком соединения и взаимным влиянием атомов и групп атомов в молекуле.
3. Строение молекул может быть установлено на основе изучения их свойств.
Рассмотрим эти положения более подробно. Молекулы органических веществ содержат атомы углерода (валентность IV), водорода (валентность I), кислорода (валентность II), азота (валентность III). Каждый атом углерода в молекулах органических веществ образует четыре химические связи с другими атомами, при этом атомы углерода могут соединяться в цепи и кольца. На основании первого положения теории химического строения мы будем составлять структурные формулы органических веществ. Например, установлено, что метан имеет состав СН4. Учитывая валентности атомов углерода и водорода можно предложить только одну структурную формулу метана:
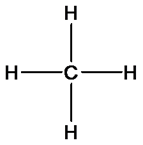
Химическое строение других органических веществ может быть описано следующими формулами:
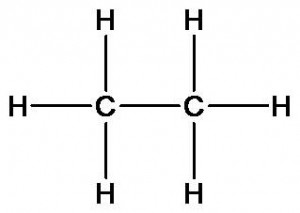
этан
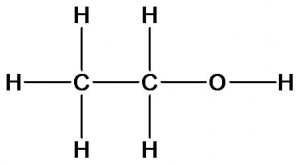
этиловый спирт
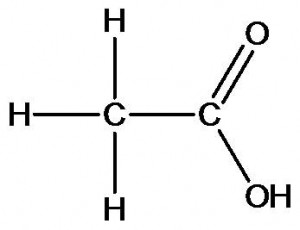
уксусная кислота
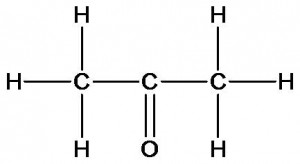
ацетон
Второе положение теории химического строения описывает известную нам взаимосвязь: состав – строение – свойства. Посмотрим проявление этой закономерности на примере органических веществ.
Этан и этиловый спирт имеют разный качественный состав. Молекула спирта в отличие от этана содержит атом кислорода. Как это скажется на свойствах?
|
Вещество |
Агрегатное состояние при н.у. |
Температура кипения, °С |
Температура плавления, °С |
|
С2Н6 |
газ |
– 182,8 |
– 88,6 |
|
СН3СН2ОН |
жидкость |
– 114 |
+ 78 |
Введение в молекулу атома кислорода резко меняет физические свойства вещества. Это подтверждает зависимость свойств от качественного состава.
Сравним состав и строение углеводородов метана, этана, пропана и бутана.
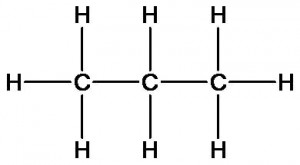
пропан
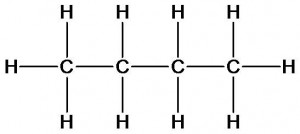
бутан
Метан, этан, пропан и бутан имеют одинаковый качественный состав, но разный количественный (число атомов каждого элемента). Согласно второму положению теории химического строения они должны обладать различными свойствами.
|
Вещество |
Температура кипения, °С |
Температура плавления, °С |
|
СН4 |
– 182,5 |
– 161,5 |
|
С2Н6 |
– 182,8 |
– 88,6 |
|
С3Н8 |
– 187,6 |
– 42,1 |
|
С4Н10 |
– 138,3 |
– 0,5 |
Как видно из таблицы, с увеличением числа атомов углерода в молекуле происходит повышение температур кипения и плавления, что подтверждает зависимость свойств от количественного состава молекул.
Молекулярной формуле С4Н10 соответствует не только бутан, но и его изомер изобутан:
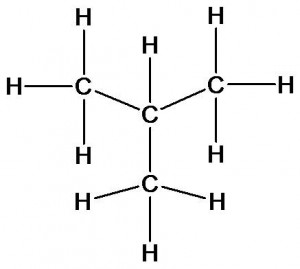
Изомеры имеют одинаковый качественный (атомы углерода и водорода) и количественный (4 атома углерода и десять атомов водорода) состав, но отличаются друг от друга порядком соединения атомов (химическим строением). Посмотрим как различие в строении изомеров скажется на их свойствах.
|
Вещество |
Температура кипения, °С |
Температура плавления, °С |
|
Бутан |
– 138,3 |
– 0,5 |
|
Изобутан |
– 159,4 |
– 11,7 |
Углеводород разветвленного строения (изобутан) имеет более высокие температуры кипения и плавления, чем углеводород нормального строения (бутан). Это можно объяснить более близким расположением молекул друг к другу в бутане, что повышает силы межмолекулярного притяжения и, следовательно, требует больших затрат энергии для их отрыва.
Третье положение теории химического строения показывает обратную связь состава, строения и свойств веществ: состав – строение – свойства. Рассмотрим это на примере соединений состава С2Н6О.
Представим, что у нас имеются образцы двух веществ с одинаковой молекулярной формулой С2Н6О, которая была определена в ходе качественного и количественного анализа. Но как узнать химическое строение этих веществ? Ответить на этот вопрос поможет изучение их физических и химических свойств. При взаимодействии первого вещества с металлическим натрием реакция не идет, а второе – активно с ним взаимодействует с выделением водорода. Определим количественное отношение веществ в реакции. Для этого к известной массе второго вещества прибавим определенную массу натрия. Измерим объем водорода. Вычислим количества веществ. При этом окажется, что из двух моль исследуемого вещества выделяется один моль водорода. Следовательно, каждая молекула этого вещества является источником одного атома водорода. Какой вывод можно сделать? Только один атом водорода отличается по свойствам и значит строением (с какими атомами связан) от всех остальных. Учитывая валентность атомов углерода, водорода и кислорода для данного вещества может быть предложена только одна формула:
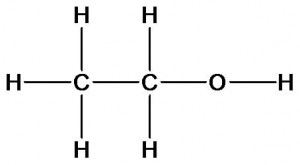
Для первого вещества может быть предложена формула, в которой все атомы водорода имеют одинаковое строение и свойства:
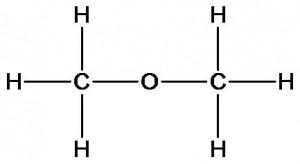
Аналогичный результат можно получить и при изучении физических свойств этих веществ.
|
Вещество |
Температура кипения, °С |
Температура плавления, °С |
|
Этиловый спирт |
– 114 |
+ 78,4 |
|
Диметиловый эфир |
– 138,5 |
– 25,0 |
Таким образом, на основании изучения свойств веществ можно сделать вывод о его химическом строении.
Значение теории химического строения трудно переоценить. Она вооружила химиков научной основой для изучения строения и свойств органических веществ. Подобное значение имеет и Периодический закон, сформулированный Д.И. Менделеевым. Теория строения обобщила все научные взгляды, сложившиеся в химии того времени. Ученые смогли объяснить поведение органических веществ в ходе химических реакций. На основе теории А.М. Бутлеров предсказал существование изомеров некоторых веществ, которые позднее были получены. Так же как и Периодический закон, теория химического строения получила свое дальнейшее развитие после становления теории строения атома, химической связи и стереохимии.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.