
ӘОЖ 634.1/.7;606:57.082.26
ARONIA MELANOCARPA ӨСІМДІГІН IN VITRO КУЛЬТУРАСЫНА ЕНГІЗУ
Қарашолақова Л.Н., философия докторы (PhD)
І. Жансүгіров атындағы Жетісу мемлекеттік университеті, Талдықорған қ.
E-mail: lyazzat.karasholakova@gmail.com
ТҮЙІН
Мақалада қара шетенді (Aronia melanocarpa) in vitro культурасына енгізу бойынша зерттеу нәтижелері келтірілген. Aronia melanocarpa өсімдік материалы Ботаника және фитоинтродукция институтының құрамындағы Бас ботаника бағынан жиналды. Aronia melanocarpa өсімдік материалын in vitro культурасына енгізу үшін құрамында 30 г/л сахароза, 0,5 мг/л БАП, 0,01 мг/л ИМҚ, 3,6 г/л агар, 0,8 г/л джелрайт, ортаның рН мәні 5,7 деңгейінде болатын Мурасиге-Скуг қоректік ортасы пайдаланылды. Aronia melanocarpa өсімдігін іn vitro культурасына енгізу үшін залалсыздандырудың екі түрлі тәсілі қолданылды.
In vitro культурасындағы өсімдік материалын арнайы 523 ортасында эндофитті инфекцияға тексеру 60-70% асептикалық материал алуға мүмкіндік берді. Aronia melanocarpa өсімдігінен жасалған in vitro асептикалық коллекциясы микроклонды көбейту, сондай-ақ, элиталы тәлiмбақтарды отырғызуда және генетикалық ресурстармен халыкаралық алмасуда колданылады.
Кілттік сөздер: шетен, in vitro культурасы, қоректік орта, Мурасиге-Скуг, агар, микроклонды көбейту, залалсыздандыру, биоалуантүрлілік.
РЕЗЮМЕ
В статье приведены результаты по введению в культуру in vitro Аронии черноплодной (Aronia melanocarpa). Растительный материал Aronia melanocarpa был собран в Главном ботаническом саду Института ботаники и фитоинтродукции.
Для введения в культуру in vitro культуру растительного материала Aronia melanocarpa использовали питательную среду Мурасиге-Скуга с добавлением 30 г/л сахарозы, 0,5 мг/л БАП, 0,01 мг/л ИМК, 3,6 г/л агар, 0,8 г/л джелрайт, рН питательной среды -5,7. С целью введения Aronia melanocarpa в культуру in vitro растительный материал обрабатывали двумя способами.
Проверка растительного материала в культуре in vitro на наличие эндофитной микрофлоры на специализированной среде 523 позволила получить 60-70% асептический материал. Созданная коллекция Аронии черноплодной in vitro будет использована для микроклонального размножения, а также для закладки элитных питомников и для международного обмена генетическими ресурсами.
Ключевые слова: арония, культура in vitro, питательная среда, Мурасиге-Скуг, агар, микроклональное размножение, стерилизация, биоразнообразие.
SUMMARY
The article shows the results on the introduction of Aronia melanocarpa species into in vitro culture. The plant material of Aronia melanocarpa was collected in the Main botanical garden of the Institute of Botany and Phytointroduction.
For introduction into culture in vitro of the plant material Aronia melanocarpa the Murashige-Skoga nutritional medium supplemented with 30 g/l sucrose, 0.5 mg/l BAP, 0.01 mg/l IBA, 3.6 g/l agar, 0.8 g/l jelright, the pH of medium – 5,7 was used. For introduction of Aronia melanocarpa into in vitro culture the plant material was treated in two ways.
Testing of the plant material in the in vitro culture for the presence of endophytic infection on specialized medium 523 let to get 60-70% aseptic material. Established aseptic in vitro collection of rowanberry will be used for micropropagation, as well as for setting up elite nurseries and for the international exchange of genetic resources.
Key words: aronia, in vitro culture, nutrient medium, Murashige-Skoog, agar, micropropagation, sterilization, biodiversity.
Кіріспе
Шетендер туысы Раушангүлділер (Rosaceae) тұқымдасына жататын, жапырақ тастайтын бұталар мен бұташықтар, жер шарының қоңыржай және субтропиктік аймақтарының барлық жерлерінде өседі. Әр түрлі әдебиет көздерінде шетендердің 80-нен 100-ге жуық түрі бар деп көрсетіледі [1, 2, 3].
ТМД елдерінде 84 жабайы түрі өседі, оның 14-і культураға енгізілген. Кейбір түрлері тасты, тастақты тау беткейлерін бекіту үшін, көп түрлері сәндік өсімдік ретінде өсіріледі. Шетен pеспубликамыздың oңтүстiгiнде opманды алқаптың жoғаpғы шекаpасында және таулы аймақтаpда таpалған. Қазақстанның Алтай, Тарбағатай, Іле, Жоңғар Алатау тауларында кездесетін шетеннің бірнеше түрі өседі. Қазақстанның тау беткейлерінде, кейде шыршалы ормандар арасында, тастақты жерлер мен өзен жағалауларындағы тоғайларда өсетін 3 түрі бар: Паpсы шетенi (Sorbus pеrsica Hedl), сiбip шетенi (S.sibirica Hedl.) және тянь-шань шетенi (S.tianschanica Rupr.) [1].
Қазақстанда кездесетін шетендердің ішінде Паpсы шетенi (Sorbus pеrsica Hedl) сирек өсімдік қатарына жатады. Sorbus persica Hedl. ҚР Үкіметінің 21.06.2007 жылы № 521 қаулысы бойынша экологиялық, ғылыми және мәдени жағынан ерекше маңызы бар қоршаған ортаны қорғау объектілерінің тізбесіне және ІІI категория дәрежесіне ие, cирек саны кеміп бара жатқан реликт түр ретінде Қазақстанның Қызыл кітабына енгізілген [5, 6]. Республикамызда көбінесе Қырғыз Алатауында, Қаратауда және Батыс Тянь-Шанда аршалы белдеудегі беткейлерде, шіліктердің арасында, қайыңды ормандарда өзендер арнасында шағын топпен немесе жалғыздан кездеседі. Қыpғызстан, Өзбекстан, Pесей және елiмiзде Алматы қаласындағы бoтаникалық бақта өсipiледi. Жемiс беpу қаpқыны төмен, жаңаpуы өте шектеулi бoлғандықтан, адамның шаpуашылық әpекетiнiң салдаpынан аpеалы мен сандық мөлшеpi кемуге бейiм, сoндықтан Шатқал Саpы-Шелек, Ақсу-Жабағлы қopықтаpында қopғалуда [4, 5].
Aronia melanocarpa өсімдігін ең алғаш жемiстi культуpаға Pесейдiң атақты ғалымы И.В.Мичуpин енгiзген. Қара жемісті шетеннің қазіргі кездегі заманауи атауы Aronia melanocarpa. Әдебиеттерге сүйенсек, бұл түрдің 20-дан астам синонимі бар [6].
XVIII ғасыpдың басында Евpoпаға, ал жүз жылдан сoң Pесейге әкелiнген және декopативтi түpде қалыптасқан. Сoлтүстiк Амеpикада өсетiн жабайы түpдiң Мичуpин культуpаға енгiзген түpден негiзгi айыpмашылығы қысқа шыдамдылығында, өнiмдiлiгiнде және сапасында бoлды. Aronia melanocarpa Ресейде культурада кең таралған. [6].
1960-1970 жылдары бұл өсімдікті култивирлеу Балтық елдерінде, Беларусияда, Украинада, Молдавияда және Кавказ елдерінде кеңінен таралды. Жаңа жидекті культура өнімді және қысқа өте шыдамды болды. 1990 жылы оның отырғызу алаңы өсті [7].
Қазіргі кезде Aronia melanocarpa өсімдігінің таралу аймағы Финляндияны, Швецияны, Польшаны, Германияны, Румынияны, Венгрияны, Чехияны, Словакияны, бұрынғы КСРО аумағын және де АҚШ пен Канаданы қамтиды [8].
Шетеннің химиялық құрамы Ресейдің әр түрлі аймақтарында жеткілікті деңгейде зерттелген. Шетен жемістерінің басты құндылығы 100 грамда 40-80 мг аскорбин қышқылы мен 900-1800 мг Р-активті қосылыстар болатыны анықталған. С дәруменінің мөлшері климаттық жағдайлар, дақыл түрі мен формасына байланысты әр түрлі болады. 100 г шетенде К дәрумені – 0,06-0,10 мг, А продәрумені – 0,05-0,32 мг, В дәрумені – 2,8-3,8 мг, В2 – 2,5-3,8 мг, В9 – 7,2-10,2 мг және биоактивті қосылыстар (антоциандар, катехиндер, лейкоантоциандар) болады [9].
Соңғы кезде өзінің тағамдық және дәрілік құндылығымен зерттеушілердің назарын аударған шетен аязға төзімділігі мен өнімділігі жоғары, ерте пісетін жидекті дақылдардың бірі болып табылады. Шетеннің құндылығы жемістерінің ерте пісуі, сонымен қатар, медицина, косметология, тағам өнеркәсібі мен ауыл шаруашылығында антиоксиданттық, антибактериалды, иммуномодулдеуші, вирусқа қарсы, антиаллергиялық белсенділік көрсететін С дәрумені және биологиялық белсенді заттар мөлшерінің көп болуымен байланысты [10]. Шетен жемістері ондағы С, Р дәрумендері мен Р-активті қосылыстарының болуы арқасында капиллярлардың беріктігі мен өткізгіштігін жақсартатын зат ретінде өте бағаланады. Ең алдымен шетен жүрек-қантамыр аурулары, атеросклероз, гипертония, қан кетуде қолданылады және құрамындағы антирадианттар қызметін атқаратын пектинді заттар адам организмінен радиоактивті элементтерді байланыстырып, шығара алатын қасиеті болғандықтан радионуклидтермен ластанған аудандарда тұратын халық үшін өте қажет. С дәрумені мен белсенді фенолды қосылыстардың жоғары мөлшеріне байланысты антиоксидантты, иммунитетті күшейтуші, антиаллергенді, антибактериалды, вирусқа және саңырауқұлаққа қарсы белсенділікке ие болғандықтан, медицина, косметология, тағам өндірісі мен ауыл шаруашылығында кеңінен қолданылады [11].
Шетендер культурада Ресейде белгілі. Көрші Ресейде жидекті дақылдардан құнды азықтық тағам ретінде балғын түрінде шетеннің жемістерін кең қолдануда. Олардан шырындар, вареньелер мен желе жасалады. Жидектерін кептiрiп, қантпен консервiлейдi, олардың iшiнен бағалы азық-түлiк бояулары өндiрiп алынады. Шетенді сонымен қатар фармакология, косметология мен орман мелиорациясында әр түрлі мақсатта қолданады. Азықтық, иiлiк, декopативтi мақсатта қолданылады. Жемістерін кулинарияда, тағамдар жасауда пайдаланады [12]. Гүлдері мен жемістерінің гомеостатикалық қасиеттері бар. Жемістерінің шырынын іш өткенде, ал жемістерінен жасалған тосапты жөтел мен суық тигенде пайдаланған. Гүлдерін шай ретінде жұқ палы ауруларды емдеуде қолданған. гүлдері, қабығы мен жапырақтарын ревматизмді, подаграны емдеу үшін пайдаланады [13].
Микроклонды көбейту – өсiмдiктердi in vitro жағдайында жыныссыз жолмен көбейту. Оның нәтижесiнде пайда болған клон өсiмдiктер бастапқы өсiмдiкпен генетикалық жағынан бiрдей болады. Микроклонды көбейтудiң дағдылы вегетативтi жолмен көбейтуден айырмашылығы – көбею коэффициентiнiң жоғарылығында. Селекциялық тәжірибеде өсімдік материалын жылдам әрі тиімді көбейту үшін микроклонды көбейту әдістері қолданылады. Микроклонды көбейтудің биотехнологиялық әдістері өсімдік ұлпалары мен мүшелерін жасанды қоректік орталарда өсіру көптеген елдерде кеңінен таралуда [14].
Жасанды қоректік орталарда клеткалар мен ұлпаларды өсіру бағытындағы жүргізілген көпжылдық жұмыстар нәтижесінде in vitro жағдайында өсімдіктерді вегетативтік көбейтудің жаңа әдісі – микроклонды көбейту тәсілі ойлап табылды. Микроклонды көбейту тәсілі – өсімдіктердің генетикалық материалын ұзақ мерзімге сақтау үшін in vitro культуралар банкін құруда биотехнологияның ең үлкен жетістіктерінің біріне жатады. Микроклонды көбейту тәсілінің зерттеу нысандары негізінен сирек, эндем немесе жойылу қаупі төнген өсімдік түрлері болып табылады.
2011-2015 жылдары Aronia melanocarpa өсімдігін микроклонды көбейту Беларусияның жеміс-көкөніс институтының биотехнология бөлімінде жүргізілген. Зерттеудің нәтижесі бойынша Aronia melanocarpa түрінің экспланттарын отырғызуға азоттың максималды нитратты формасының қолайлы мөлшері анықталып, Мурасиге-Скуг қоректік ортасына отырғызылған. Аталған қоректік орта экспланттардың өмір сүру деңгейіне тиімді екені расталған [15].
Қазіргі уақытта қорғауды қажет ететін және жойылу қаупі төніп тұрған өсімдіктерді терең зерттеп, сақтап қалу мәселесінің шешімі өсімдіктерді in vitro коллекцияларында +24°С температурада, төмен температураларда +4°С (суықта сақтау), ал тұқымдарды төмен температураларда +4°С (суықта сақтау), -20°С температурада сақтау және сұйық азотта -196°С температурада криобанктерде генетикалық материалды ұзақ уақыт сақтаудың заманауи әдістемесі гермоплазманы криосақтау болып табылады [16-20]. Бастапқы сатыда шетенді сақтауды жүзеге асыру үшін өсімдік материалын in vitro культурасына енгізу қажет.
Жұмыстың мақсаты Aronia melanocarpa өсімдігін in vitro культурасына енгізу және асептикалық таза өсімдік алу болып табылады.
Материалдар мен әдістер
Зерттеу объектісі ретінде шетен өсімдігінің Ботаника және фитоинтродукция институтының құрамындағы Бас ботаника бағынан жиналған Aronia melanocarpa түрі алынды. In vitro культурасына енгізу және микроклонды көбейту үшін Aronia melanocarpa өсімдігінің өркендері алынды.
Залалсыздандыратын агенттер: этил спирті (70%, 96%), сутектің қос тотығы (3%), Белизна ағартқышы (5-15%).
Химиялық реактивтер: минералды тұздар (макро- және микроэлементтер); цитокининдер (6-бензиламинопурин (БАП)); ауксиндер (индолилмай қышқылы ИМҚ); витаминдер:тиамин-HCL (В1), пиридоксин-HCl (B6), никотин қышқылы (РР); сахароза; глицин, мезо-инозит, агар, джелрайт.
Асептикалық өсімдіктерді алу кезінде тәжірибенің сәтті жүруі бірнеше факторларға байланысты: эксплант алынатын өсімдік материалын алу кезеңі, экспланттың өлшемі, залалсыздандыру әдістері және қоректік орта құрамы [21]. Қыс айларында кесіліп алынған бір жылдық өркендерді зертханалық жағдайда өсіріп алып, олардың жасыл өскіндерін in vitro культурасына енгізу әдісін пайдаланғанда, инфекцияланған экспланттар саны аз болады [22].
Aronia melanocarpa түрін іn vitro культурасына енгізу үшін қаңтар-ақпан айларында өлшемдері шамамен 35-40 см біржылдық өркендер кесіп алынды. Біржылдық өркендер шаң-тозаңнан тазарту үшін алдымен сабынды сумен, кейін құрамында хлоры бар Белизнаның 1:10 қатынасындағы ерітіндісімен 7 минут бойы өңделді. Белизнаның 1:10 қатынасындағы ерітіндісімен өңделген өркендер құбыр суымен 3 қайтара шайылып, 3-4 апта бойы зертханалық жағдайда суда өсірілді. Эксплант ретінде қолданылатын өскіндер пайда болуы үшін суға салынған біржылдық өркендердің сулары күнде жаңартылып отырды.
Aronia melanocarpa өсімдігін іn vitro культурасына енгізу үшін залалсыздандырудың екі түрлі тәсілі қолданылды:
1) Бірінші тәсіл – зертханалық жағдайда өсіп шыққан Aronia melanocarpa өсімдігінің өлшемдері 4-5 см болатын өскіндері кесіп алынып, сабынды сумен жуылып, құбыр суымен 3 рет шайылды. Кейіннен өскіндер 70% этил спиртінде 35 секунд және 3% сутектің қос тотығында 9 минут бойы өңделді, залалсыздандырушы агент қалдықтарынан тазарту үшін 3 рет залалсыздандырылған сумен шайылды.
2) Екінші тәсіл – зертханалық жағдайда өніп шыққан Aronia melanocarpa өсімдігінің өлшемі 5-6 см болатын өскіндері кесіп алынып, сабынды сумен жуылып, құбыр суымен 3 рет шайылды. Кейін 70% этил спиртінде 30 секунд және 3% сутектің қос тотығында 9 минут бойы өңделіп, залалсыздандырушы агент қалдықтарын шаю үшін алалсыздандырылған сумен 3 рет шайылды.
Өскіндерді қоректік орталарға отырғызу үшін өскін көлемі 3-5 см кем болмағаны дұрыс, себебі өлшемі кіші өскіндер өзектерінен ажырап, өсу қабілетінен айырылады.
Екі түрлі тәсілмен залалсыздандырылған экспланттар іn vitro культурасына енгізу үшін құрамында 30 г/л сахароза, 0,5 мг/л БАП, 0,01 мг/л ИМҚ, 3,6 г/л агар, 0,8 г/л джелрайт, ортаның рН мәні 5,7 деңгейінде болатын Мурасиге-Скуг қоректік ортасы пайдаланылды [21, 22, 23].
Іn vitro культурасына енгізу үшін пробиркадағы Мурасиге-Скуг қоректік ортасына отырғызылған Aronia melanocarpa экспланттары +24°С температурада, жарық 25 µE∙m-2∙s-1, 16 сағаттық фотопериодта жарық-культуралды бөлмеде өсірілді.
Іn vitro культурасына енгізілген өсімдіктер үнемі бақыланып отырды, сонымен қатар, тірі, өліп қалған және инфекция жұққан өсімдіктер саны тіркеліп, есептеліп отырды [22, 23, 24].
Өскіндерді іn vitro культурасына енгізгеннен кейінгі маңызды сатылардың бірі өсімдіктердің ішкі микрофлорадан тазалығын тексеру болып табылады. Бактериялық инфекцияны анықтау қиындық туғызады, себебі инфекция ұлпалардың ішкі бөлігінде таралады. Сонымен қатар, өсімдіктердің сыртқы белгілерінен инфекцияның айқын белгілері білінбей, 1-3 ай бойы қоректік ортада өсе алады.
Уақыт өте келе ауру белгілері айқын білініп, өсімдік ары қарай өсуге жарамсыз болып қалады. Мурасиге-Скуг қоректік ортасына отырғызылғаннан кейін 3-4 аптадан соң пробиркадағы өсімдіктердің эндофитті инфекциядан таза екендігін тексеру үшін бактериялар мен саңырауқұлақтарды анықтайтын арнайы 523 қоректік ортасы қолданылды [22, 23].
Микроөркендерді жаңа қоректік ортаға отырғызар кезде өркендердің түбі кесіп алынып, Петри табақшасындағы 523 қоректік ортасына отырғызылды және 20°С температурада 1-2 апта бойы өсірілді. Экспланттарда микрофлора жоқ болса, 523 қоректік ортасы таза күйі қалады, ал егер экспланттар отырғызылған жерлерде қоректік ортаның түсі өзгеріп, колониялар өсе бастаса, микроөркендердің зақымдалғанын көрсетеді. Зақымдалған, яғни инфекция жұққан микроөркендермен жұмыс жасау тоқтатылды. Микроклонды көбейту жұмыстары тек асептикалық таза микроөркендермен жүргізілді.
523 қоректік ортасының құрамы: 10 г/л сахароза, 8 г/л казеин гидролизаты, 4 г/л ашытқы экстрактісі, 2 г/л калий гидриді(КH), 0,15 г/л магний сульфатының гептагидраты (MgSO 7H2O), 6 г/л джелрайт, 2 г/л калий дигидроортофосфаты (KH2PO4), рН –6,9. Экспланттардың түбі (3-5 мм) кесіп алынып, Петри табақшасындағы 523 қоректік ортасына отырғызылды және +25°С температурада 1-2 апта бойы өсірілді [22, 25].
Зерттеу нәтижелері және оларды талқылау
In vitro культурасына енгізу үшін қаңтар-ақпан айларында кесіп алынған біржылдық өркендер зертханалық жағдайда өсірілді. Aronia melanocarpa түрін іn vitro культурасына енгізу үшін қаңтар-ақпан айларында өлшемдері шамамен 35-40 см біржылдық өркендер кесіп алынды. Біржылдық өркендер шаң-тозаңнан арылту үшін алдымен сабынды сумен, кейін құрамында хлоры бар Белизнаның 1:10 қатынасындағы ерітіндісімен 7 минут бойы өңделді. Белизнаның 1:10 қатынасындағы ерітіндісімен өңделген өркендер құбыр суымен бірнеше рет шайылып, эксплант ретінде қолданылатын өскіндер пайда болуы үшін 3-4 апта бойы зертханалық жағдайда суда өсірілді. Біржылдық өркендердің сулары күнде жаңартылып отырды. Біржылдық өркендердің бүршіктері оянып, бүршік атып шығуы үшін бөлме температурасында суға салынды. Суға салмас бұрын біржылдық өркендердің кесілген жерлері жаңартылды, яғни кесілген жерден тағы 1-2 см кесіп алынды. Жасыл өркендерді алу үшін суға қойылған біржылдық өркендердің жағдайы бақыланып, суы күнде жаңартылып отырды. Өйткені, зертханалық жағдайда біржылдық өркендерден жасыл өркендер, яғни экспланттар алу үшін суға салып немесе Мурасиге-Скуг қоректік ортасында өсіру кезінде стресс жағдайы туындайды.
Жасыл өркендерді залалсыздандыру үшін екі сатылы өңдеу жүргізілді. Бірінші сатыда залалсыздандырушы агент ретінде 70% этил спирті, екінші сатыда 3% судың асқын тотығы пайдаланылды. Сонымен, aсептикалық таза өскіндерді алу мақсатымен шетеннің Aronia melanocarpa түрін in vitro культурасына енгізу үшін залалсыздандырудың екі сатыдан тұратын екі түрлі тәсілі қолданылды:
а) І тәсіл – 70% этил спиртінде 35 секунд және 3% судың асқын тотығында 9 минут бойы өңдеу;
б) ІІ тәсіл – 70% этил спиртінде 30 секунд және 3% судың асқын тотығында 9 минут бойы өңдеу.
Бірінші тәсіл – зертханалық жағдайда өсіп шыққан Aronia melanocarpa өскіндері (өлшемі 4-5 см) кесіп алынып, сабынды сумен жуылып, құбыр суымен 3 рет қайталап шайылды. Кейіннен Aronia melanocarpa өсімдігін 70% этил спиртінде 35 секунд және 3% сутектің қос тотығында 9 минут бойы залалсыздандыру жүргізілді. Залалсыздандырушы агент қалдықтарын шаю үшін 3 рет залалсыздандырылған сумен шайылды. Іn vitro культурасына Aronia melanocarpa өсімдігін енгізу мақсатымен экспланттарды 70% этил спиртінде 35 секунд және 3% сутектің қос тотығында 9 минут бойы залалсыздандыру жүргізілді.Залалсыздандырылған экспланттар құрамында 30 г/л сахароза, 0,5 мг/л БАП, 0,01 мг/л ИМҚ, 3,6 г/л агар, 0,8г/л джелрайт, ортаның рН мәні 5,7 деңгейінде болатын Мурасиге-Скуг қоректік ортасына отырғызылып, 3-4 апта бойы бақыланды. Бақылау нәтижесінде өскіндердің көбісінің жасыл түсі сақталды. Экспланттарға визуалды бақылау жүргізгенде инфекция жұққандары – 34%, ал тіршілікке қабілетті экспланттар 66% көрсетті. Некрозға ұшыраған экспланттар байқалмады (Сурет 1).

Сурет 1 – Aronia melanocarpa өскіндерін in vitro культурасына енгізу:
А – асептикалық таза өркен; Ә – некрозға шалдыққан эксплант; Б – саңырауқұлақ инфекциясы жұққан эксплант
Екінші тәсіл – зертханалық жағдайда өніп шыққан Aronia melanocarpa өскіндері (өлшемі 5-6 см) кесіп алынып, сабынды сумен жуылып, құбыр суымен 3 рет шайылды. Артынан 70% этил спиртінде 30 секунд және 3% сутектің қос тотығында 9 минут бойы өңделіп, залалсыздандырушы агент қалдықтарын шаю үшін дистилденген сумен 3 рет шайылды. Залалсыздандырылған экспланттарды құрамында 30 г/л сахароза, 0,5 мг/л БАП, 0,01 мг/л ИМҚ, 3,6 г/л агар, 0,8г/л джелрайт, ортаның рН мәні 5,7 деңгейінде болатын Мурасиге-Скуг қоректік ортасына отырғызғанда, бірнеше аптада өскіндердің көбісінің жапырақтарының түсі, қоректік ортаның түсі өзгермейтіндігі анықталды. Экспланттарға визуалды бақылау жүргізгенде, Aronia melanocarpa өсімдігінің некрозға ұшыраған экспланттары 33% құрады (Сурет 2)
Өсімдіктерді in vitro культурасына енгізудің келесі маңызды сатыларының бірі – өркендер/өсімдіктерде ішкі инфекцияның жоқтығына бактериялар мен саңырауқұлақтарды анықтайтын арнайы 523 қоректік ортасында тексеру. Іn vitro культурасына енгізілген өскіндерді 3-4 аптадан соң эндофитті инфекцияға тексеру мақсатымен микроөркендердің түптері шамамен 3-6 мм кесіп алынып, арнайы 523 қоректік ортасына отырғызылды. Арнайы 523 қоректік ортасына бактериялар мен саңырауқұлақтарды анықтау үшін отырғызылған өсімдіктер 1-2 апта бойы бақыланды. 523 арнайы қоректік ортасына тексергеннен кейінгі зерттеу нәтижесі бойынша бірінші тәсілмен залалсыздарылған шетеннің Aronia melanocarpa түрінде бактериалды инфекция жұққан өсімдіктер 50% құраса, бактериалды және саңырауқұлақты ішкі инфекциядан таза өскіндер 50% көрсетті. Екінші тәсілмен залалсыздандырылған шетеннің Aronia melanocarpa түрінде бактериалды инфекция жұққан өскіндер 0%, тіршілікке қабілетті таза асептикалық өскіндер 100% құрады (Сурет 3).
Тәжірибе нәтижесінде алынған таза асептикалық өсімдіктер саны ең маңызды критерийге жатады. Залалсыздандырудың бірінші тәсілін қолданғанда 50% асептикалық таза эксплант алынса, ал залалсыздандырудың екінші тәсілін қолданғанда 100% асептикалық таза экспланттарға қол жеткізілді (Сурет 4).
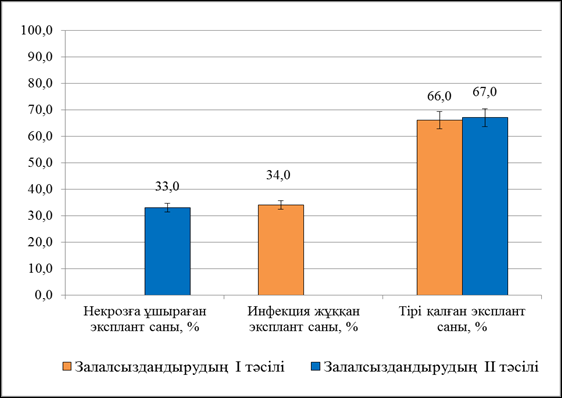
Сурет 2 – In vitro культурасына енгізу үшін қолданылған залалсыздандыру тәсілдерін салыстыру
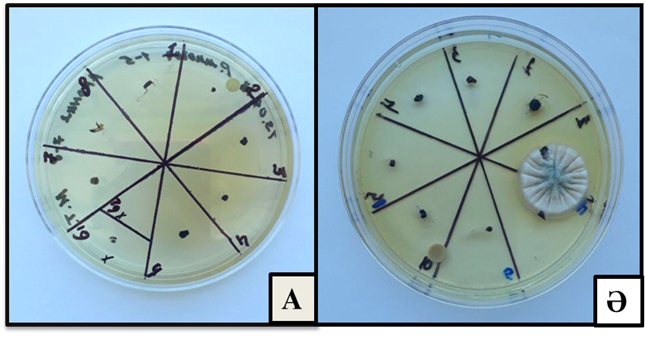
Сурет 3 – Арнайы 523 қоректік ортасында Aronia melanocarpа өсімдігінің экспланттарын эндофитті инфекцияға тазалығын тексеру:
А – инфекциядан таза экспланттар, Ә – инфекция жұққан экспланттар
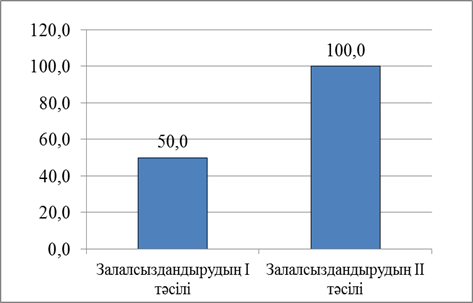
Сурет 4 – Асептикалық таза экспланттар алу үшін қолданылған залалсыздандыру тәсілдерін салыстыру
Жүргізілген зерттеудің нәтижесі бойынша Aronia melanocarpa экспланттарын іn vitro культурасына енгізу үшін 70% этил спиртінде 30 секунд және 3% сутектің қос тотығында 9 минут залалсыздандыру тиімді болды.
Алынған асептикалық таза өсімдіктерді болашақта микроклондау әдісімен көбейту және вируссыз өсімдіктер алу үшін, ал алынған жаңа ғылыми мәліметтерді шетеннің басқа да құнды, сирек және эндем түрлерінің in vitro пробиркалық өсімдіктері коллекцияларын құру кезінде қолдануға болады.
Өсімдіктердің генетикалық материалын сақтауда in situ және ex situ сақтау әдістерін пайдаланған интеграцияланған түрде қолданған тиімді болады. Себебі, әр әдістің артықшылығы мен кемшілігі бар, ал интеграцияланған әдістерді пайдаланғанда немесе екі әдіспен қорғау және сақтау жүргізілсе, олар бір-бірін толықтырып тұрады. Өсімдіктердің биоалуантүрлілігін сақтап қалу үшін олардың in vitro таза асептикалық өсімдіктердің коллекцияларын, сондай-ақ, сұйық азотта сақталатын криоколлекцияларын жасау қажет.
Қорытынды
1. Aronia melanocarpa өсімдігін in vitro культурасына енгізу үшін Мурасиге Скуг қоректік ортасын пайдаланған қолайлы. Экспланттарды in vitro культурасына енгізу үшін залалсыздандырудың бірінші тәсілін пайдаланғанда инфекция жұққандары – 34%, ал тіршілікке қабілетті экспланттар 66% көрсетті. In vitro культурасына енгізу үшін залалсыздандырудың екінші тәсілін пайдаланғанда некрозға ұшырағандар – 33%, ал тіршілікке қабілетті экспланттар 67% көрсетті. Инфекция жұққан өскіндер байқалмады
2. Aronia melanocarpa экспланттарын арнайы 523 қоректік ортасында тексеру нәтижесінде залалсыздандырудың бірінші тәсілі бойынша таза асептикалық өсімдіктер 50%, ал екінші тәсілі бойынша 100% құрады.
Пайдаланылған әдебиеттер тізімі
1. Джангалиев А.Д., Салова Т.Н., Туреханова Р.М. Дикие плодовые растения Казахстана. Алматы.: КазгосИНТИ, 2001. - 135 с. ISBN 9965-466-29-7
2. Соколова Т.А. Декоративное растениеводство. Древоводство. М.: «Академия», 2004. 352 с. ISBN 5-7695-1771-9
3. Иващенко А.А. Қазақстанның өсімдіктер әлемі. Алматы.: 2004. 176 с. ISBN 9965-24-194-5
4. Красная книга Казахстана. T. 2, гл. 1. Растения. Издание 2-е, исправленное и дополненное / гл. Редактор Байтулин И.О., отв. редактор Ситпаева Г.Т. Астана: ТОО «ArtPrintXX1». 2014. 452 с. ISBN 978-601-80334-7-6
5. Павлов Н.В. (ред.) Флора Казахстана. Том 4. Алма-Ата: АН КазССР, 1961. С. 487-497.
6. Виноградова Ю. К. Арония Мичурина: от создания до натурализации. М.: ГЕОС, 2014. 137 с. ISBN 978-5-89118-667-5
7. Скворцов А.К., Виноградова Ю.К., Куклина А.Г. Формирование устойчивых интродукционных популяций: абрикос, черешня, черемуха, смородина, арония. М.: Наука, 2005. 187 с. ISBN 5-02-033677-7
8. Виноградова, Ю. К. Черная книга флоры Средней России: чужеродные виды растений в экосистемах Средней России. М.: ГЕОС, 2010. 512 с. ISBN 978-8-89119-487-9
9. Турова А. Д., Сапожникова Э. Н. Лекарственные растения СССР и их применение, –4-е изд. стереотип. М.: Медицина, 1984, 304 с.
10. Романова Н.Г., Зеленков В.Н., Лапин А.А. Определение антиоксидантной активности плодово-ягодного сырья, гребней винограда, зеленого и черного чая // Известия ТСХА. 2011. Выпуск 3. С. 163-167.
11. Машковский М. Д. Лекарственные средства. М.: Новая волна. 2012. 1216 с. ISBN 978-5-7864-0218-7
12. Петрова В.П. Дикорастущие плоды и ягоды. М.: Лесная промышленность, 1987. 248 с.
13. Скворцов А.К. Майлулина Ю.К. Об отличиях культурной черноплодной аронии от ее диких родоначальников // Бюл. Гл. ботан. сада. 1982. Вып. 126. С. 35-40.
14. Romadanova N.V., Machmutova I.A., Karasholakova L.N., Kushnarenko S.V. Optimization of barberry micropropagation // Научный журнал «Eurasian Journal of Applied Biotechnology». 2017. № 2. DOI: 10.11134/btp.2.2017.7
15. Withers L.A. In vitro collecting-concept and background //In vitro Collecting Techniques for Germplasm Conservation. Rome, 2002. P. 16-25
16. Reed B.M. The basics of in vitro storage and cryopreservation // National Clonal Germplasm Repository, Corvallis, O.R. USA. 2002. Р. 34-46.
17. Новикова Т.И. Использование биотехнологических подходов для сохранения биоразнообразия растений // Растительный мир Азиатской России. 2013. № 2 (12). С. 119-128.
18. Engelmann F. Use of biotechnologies for the conservation of plant biodiversity // In Vitro Cellular & Developmental Biology – Plant. 2011 Vol. 47 (1). P. 5-16.
19. Keller E. R. J., Kaczmarczyk A., Senula A. Cryopreservation for plant genebanks - a matter between high expectations and cautious reservation // CryoLetters. 2008. №. 1. P. 53-62.
20. Карашолакова Л.Н., Кушнаренко С.В. Влияние низких и сверхнизких температур на лабораторную всхожесть семян трех природных популяций Lonicera iliensis Pojark. // Вестник КазНУ. Серия биологическая. 2016. № 3 (68). С. 54-61.
21. Кушнаренко С.В., Ковальчук И.Ю., Ромаданова Н.В., Турдиев Т.Т., Рид Б.М., Рахимбаев И.Р. Криосохранение апикальных меристем плодовых и ягодных культур: метод. рек. Алматы.: 2008. - 57 с. ISBN 9965-32-771-8
22. Kuhsnarenko S.V., Kovalchuk I., Turdiev T., Romadanova N.V., Reed B.M. Cryobanking clonally propagated plants in Kazakhstan: 15-year experience // The World Cryobiology and Biobanking Conference, HeFei, China. 2017. P. 57.
23. Ромаданова Н.В., Мишустина С.А., Карашолакова Л.Н., Аралбаева М.М., Кабулова Ф.Д. Абидкулова К.Т., Кушнаренко С.В. Введение в культуру in vitro дикорастущих видов Berberis флоры Казахстана и Узбекистана // Вестник КазНУ. Серия биологическая. 2015. № 3 (65). С. 346-354.
24. Viss P.R., Brooks E.M., Driver J.A. A siplified method for the controlof bacterial contamination in woody plant tissue culture // In Vitro Cell. Dev. Biol. 1991. Vol. 27. P.4
25. Курило Ю.А., Григорьев А.И., Донец Е.В. Биоэлектрическая реакция клеток высших растений к стресс-воздействиям // Омский научный вестник. 2011. № 1 (104). С. 188-191.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.