
ПРАКТИКУМ
Опыт 1. Отношение аминокислот к индикаторам
Реактивы и оборудование: 1% раствор глицина, 1% раствор аланина, универсальная индикаторная бумага.
Выполнение опыта: определите с помощью индикаторной бумаги значение рН растворов глицина и аланина. Какая реакция данных растворов?
Ход реакции:
.. + + H
![]() H2N CH2
H2N CH2 ![]() COOH H3N CH2 COO- 2O NH2 CH2 COO- + H3O+
COOH H3N CH2 COO- 2O NH2 CH2 COO- + H3O+
биполярный ион
Раствор глицина имеет слабокислую реакцию среды (рН ~ 6,1), т.к. в биполярном ионе кислотность –NН3+ группы несколько больше основности группы —СОО-.
Опыт 2. Амфотерные свойства аланина
Реактивы и оборудование: 1% раствор аланина, 0,1% раствор соляной кислоты с индикатором конго, 0,1% раствор гидроксида натрия с фенолфталеином, 2 пробирки, водяная баня, электрическая плитка.
Выполнение опыта: в первую пробирку внесите 10 капель раствора аланина и добавьте 2-3 капли раствора соляной кислоты с индикатором конго. Отметьте изменение окраски индикатора от синей до розово-красной. Появление окраски можно ускорить, нагрев пробирку.
Во вторую пробирку внесите 10 капель раствора аланина и добавьте по каплям раствор гидроксида натрия с фенолфталеином. Отметьте изменение окраски – исчезновение малиновой. Почему изменяется окраска индикатора? Ход реакции:
![]() CH3
CH3![]() CH COOH + HCl
CH COOH + HCl ![]() CH COOH Cl-
CH COOH Cl-
N+ H3
N..H2
аланин хлорид
α – аминопропионовой кислоты
![]() CH3 CH COOH
+ NaOH
CH3 CH COOH
+ NaOH ![]() CH COO-
Na+ + H2O
CH COO-
Na+ + H2O
NH2 NH2
натриевая соль
α – аминопропионовой кислоты
Опыт 3. Реакция α – аминокислот с нингидрином
Данная реакция является качественной реакцией на α – аминокислоты.
Реактивы и оборудование: 1% раствор глицина, 0,1% раствор нингидрина, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 10 капель раствора глицина и добавьте 2-3 капли раствора нингидрина. Через несколько минут наблюдается появление фиолетовой окраски. Появление окраски можно ускорить, нагрев пробирку. Ход реакции:
O
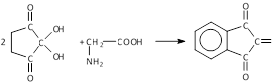
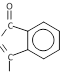 N C + CO2 + H C
N C + CO2 + H C![]() +
3H2O H
+
3H2O H
OH
нингидрин глицин продукт реакции
сине-фиолетового цвета
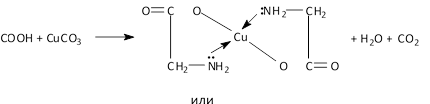
Опыт 4. Образование комплексных солей меди (II)
Реактивы и оборудование: 1% раствор глицина, карбонат меди (II) (СuCO3), 2н раствор гидроксида натрия (NaOH), 1 пробирка, водяная баня, электрическая плитка.
Выполнение опыта: в пробирку внесите 20 капель раствора глицина, добавьте на кончике лопаточки карбоната меди (II) и нагрейте.
К полученному раствору прибавьте 2 капли щелочи. Ход реакции:
![]()
 2 CH
2 CH
NH2
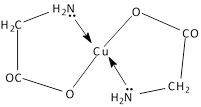
комплексная хелатная
соль меди
Выпадение осадка гидроксида меди (II), как это наблюдается с обычными солями меди, не происходит.
Из этого следует сделать вывод, что при действии глицина на соль меди (II) образуется не обычная медная соль, а комплексное хелатное соединение (от греч. слова hela – клешня), в котором атом меди связан не только с атомом кислорода гидроксила, но и с атомом азота аминогруппы.
Опыт 5. Реакция аминокислот с азотистой кислотой
Реактивы и оборудование: 1% раствор глицина, раствор нитрита натрия (NaNO2), концентрированная соляная кислота (HCl), 1 пробирка.
Выполнение опыта: в пробирку внесите 5 капель раствора глицина и 5 капель нитрита натрия. Добавьте 2 капли концентрированной соляной кислоты и осторожно взболтайте. Наблюдается выделение пузырьков газа и образование оксикислоты.
Ход реакции:
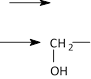 NaNO2 + HCl HNO2 +
NaCl
NaNO2 + HCl HNO2 +
NaCl
![]() CH COOH + HNO2 COOH
+ N2
CH COOH + HNO2 COOH
+ N2 ![]() + H2O
+ H2O
NH2
гликолевая кислота
Опыт 34. Реакция аминокислот с формальдегидом (муравьиным альдегидом)
Данная реакция лежит в основе метода формольного титрования (метод Серенсена) и используется для количественного определения карбоксильных групп в α – аминокислотах.
Реактивы и оборудование: 1% раствор глицина, индикатор метиловый оранжевый, раствор формальдегида.
Выполнение опыта: в пробирку внесите 10 капель раствора глицина и 1 каплю индикатора метиловый оранжевый. Добавьте 5 капель формальдегида.
Ход реакции:
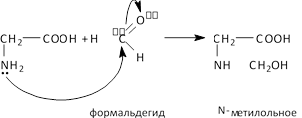
производное глицина
Опыт 6. Биуретовая реакция
Биуретовая реакция обусловлена наличием в соединениях пептидной группировки (—СО—NН—). Эту цветную реакцию с солями меди в щелочной среде дают биурет, амиды и имиды кислот, пептиды и белки. Окрашенные продукты реакции являются комплексами.
Реактивы и оборудование: 1% раствор белка, 0,2н раствор сульфата меди (CuSO4), концентрированный гидроксид натрия (NaOH), 1 пробирка.
Выполнение опыта: в пробирку внесите 5 капель раствора белка и добавьте 5 капель гидроксида натрия и 1 каплю раствора сульфата меди. Ход реакции:
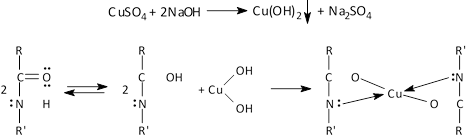
|
кетоформа полипептида |
енольная форма полипептида |
биуретовый комплекс меди сине-фиолетовая окраска |
Опыт 7. Ксантопротеиновая реакция
Данная реакция является качественной реакцией на ароматические аминокислоты.
Реактивы и оборудование: 1% раствор белка, концентрированная азотная кислота (HNO3), концентрированный гидроксид натрия (NaOH), 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 5 капель раствора белка и добавьте (осторожно!) 3 капли концентрированной азотной кислоты. Содержимое нагрейте до образования желтой окраски. Пробирку охладите и добавьте, не взбалтывая приборку, 2-3 капли концентрированного гидроксида натрия. Ход реакции:
to
![]() HO CH COOH + HO NO2
HO CH COOH + HO NO2 ![]()
NH2
тирозин
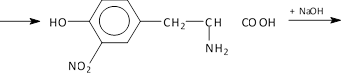
нитротирозин (желтая окраска)
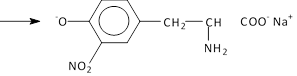
оранжевая окраска
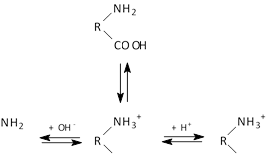
Опыт 8. Буферные свойства раствора белка
Реактивы и оборудование: 1% раствор белка, раствор соляной кислоты с индикатором конго, раствор гидроксида натрия с фенолфталеином, 2 пробирки.
Выполнение опыта: в первую пробирку внесите 10 капель раствора белка и постепенно по каплям прибавьте раствор соляной кислоты с индикатором конго. Отметьте изменение окраски раствора по мере постепенного добавления избытка кислоты с конго.
Во вторую пробирку внесите 10 капель раствора белка и добавьте постепенно по каплям раствор гидроксида натрия с фенолфталеином. Отметьте окраску раствора при добавлении избытка щелочи.
Почему не сразу изменяется окраска индикатора?
Ход реакции:
R![]()
COO- COO- COOH
в щелочной среде в изоэлектрической в кислой среде
точке
Белок в растворе проявляет буферные свойства, т.е. может связывать как появляющиеся водородные, так и гидроксильные ионы. По мере добавления определенного объема раствора кислоты или щелочи окраска индикатора конго переходит от красной к синей, а розовая окраска фенолфталеина исчезает. По мере добавления избытка реагента окраска индикаторов восстанавливается.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.