
А.Ю.СТАХЕЕВ

(составная часть простых и сложных тел)
«Вся сущность теоретического учения в химии лежит в отвлеченном понятии об элементах. Найти их свойства, определить причины их различия и сходства, а потом, на основании этого, предугадать свойства образуемых ими тел — вот путь, по которому идет
эта наука.»
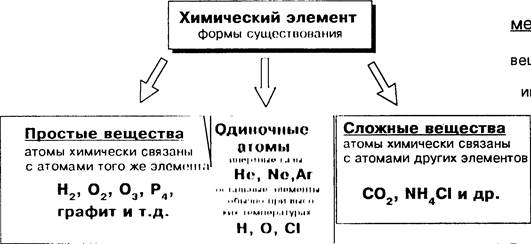
Д. И. Менделеев Химический элемент: вид атомов, характеризующийся определенным зарядом ядра.
о 1 омы не, Но,Аг
Существование химического элемент н форме нескольких простых веществ называется аллотропией
С — алмаз, графит, фуллерены и др. О — 02 , 03 и др.
S — моноклинная, ромбическая и др.
Р — белый, красный, черный
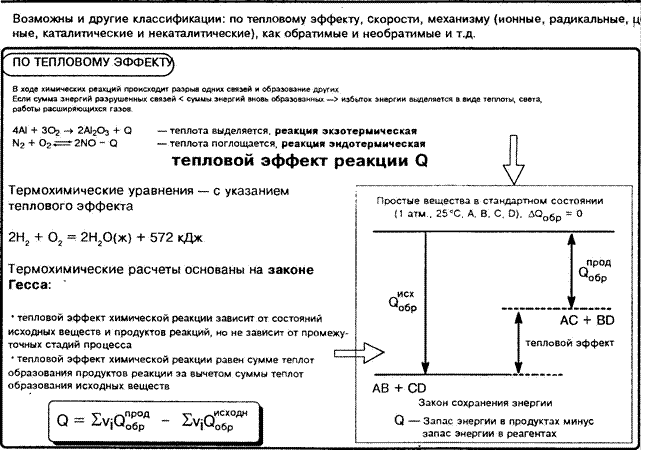
ЯВЛЕНИЯ ФИЗИЧЕСКИЕ
|
Физические без изменения состава и строения веществ Нагревание утюга Испарение сухого льда (СО 2) |
|
Химические изменяются состав и строение веществ 203 = 302 2Cu + 02 = 2си02 сасоз = СаО + |
 при
смешении механическая смесь химическое соединение
при
смешении механическая смесь химическое соединениевещества сохраняют образуется новое вещество химическую индивидуальность
нагрев
Н 2 + ![]() 2HCl
2HCl
1. При составлении механической смеси веществ их можно брать в любых количественных соотношениях. Чтобы получить химическое соединение, не оставив в избытке какое-либо исходное вещество, их надо брать в строго определенных стехиометрических соотношениях, определяемых уравнением химической реакции, а в конечном счете — составом исходных и конечных веществ. 2. Свойства веществ, составивших механическую смесь — сохраняются, вступивших в химическую реакцию — не сохраняются.
З. Составные части смеси могут быть разделены на основании их физических свойств, для разложения химического соединения необходимо проведение химической реакции.
4. При механическом смешении не наблюдается выделения или поглощения теплоты. При химических реакциях теплота, как правило, выделяется или поглощается .
СТРОЕНИЕ АТОМА открытия конца XlX — начала ХХ в привели к ВЫВОДУ:
атом делим, состоит из ядра О и электронов е
|
|
|
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
В центре — О - ядро, вокруг врашдются электроны, в целом атом электронейтрален.
![]()
![]() НО — электрон, двигаясь с ускорением
(центростремительная сила), должен излучать и терять энергию 1913 г. — Н.
БорПостулаты Бора:
НО — электрон, двигаясь с ускорением
(центростремительная сила), должен излучать и терять энергию 1913 г. — Н.
БорПостулаты Бора:
дополнил планетарную модель1. Электрон движется вокруг ядра по строго определетеорией квантов Планка —нным (стационарным) орбитам и при движении по энергия может поглощаться и испускатьсяним не излучает энергию только порциями;2. Энергия излучается и поглощается при переходе Н. Бор объяснил линейчатый (дискретный)электрона с орбиты на орбиту спектр атома водорода
)овременное состояние:
|
924 Г. — Л. де Бройль — двойственная природа (дуализм) лепрона, — электрон волна и частица одновременно. Электрон — волна «размазан» в пространстве, представляет собой как бы блако. Для отражения этой особенности поведения электрона в атоме ведено понятие электронной орбитали. Согласно современным представлениям: электроны формируют электронные слои (называемые таюке оболочками или уровнями), характеризуощиеся главным квантовым числом п. Уровень расщепляется на подуровни, характеризующиеся орбитальным или азимутальным квантовым числом 1 = О, 1,... п-1. т.е. для п = З О, 1, 2 Каждый подуровень с квантовым числом I содержит 21+ 1 орбиталей, характеризующихся магнитным квантовым числом т; т = 1, 1—1, ...О ... —l+l, —l. Значение I определяет форму орбиталей, т — ориентацию в пространстве 2 з 4 п = 1, I = 0 уровень содержит одну Ы)рбиталь п = 2, 1 = 0, уровень содержит одну 2.9 и три 2р орбитали (всего 4 орбитали). п = З, 1 = 0, 1, 2 уровень — одна 3s, три Зр и пять 3d орбитали (всего 9 орбиталей). КРОМЕ ТОГО, электрон имеет спин — 4-е квантовое число (s = ±1/2)
Заполнение орбиталей: 1 Очередность заполнения — принцип наименьшей энергии. 2 Принцип Паули — в одном атоме не может быть двух электронов с одинаковыми значениями п, 1, т и s. З. Правило Хунда — в пределах подуровня электроны располагаются так, что их суммарный спин максимален. |
ЯДРО Было установлено, что ядра состоят из протонов р и нейтронов оп р + оп — ядерные силы Нуклид — вид атомов с определенными числами протонов и нейтронов ( 235 40 14 др.) Изотопы — нуклиды одного элемента €157Cl, ) Изотопы одного элемента химически неразделимы. Радиоактивный распад: 88 = 2 Н е +88 (а-распад) 38Sr = р— +39 у (Р —-распад) ! если ядро атома испускает ачастицу, то образуется элемент, расположенный на 2 клетки левее, если испускается р-частица — на 1 клетку правее.
ЯдеРНЬР реакции
кратко U (d,2n$38 Np |
5
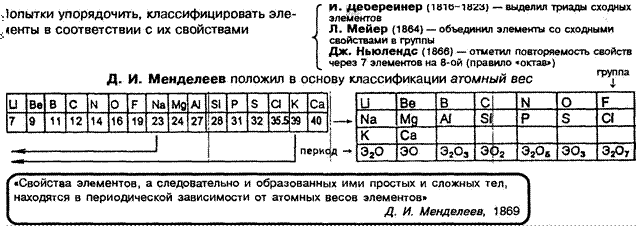
при составлении таблицы Д.И. Менделеев (в отличие от предшественников):
1. Сравнил между собой не только сходные элементы, но и несходные естественные группы элементов;
2. Изменил атомные веса 20 элементов (Верз ВеО 13.5 9)
З. При определении положения — руководствовался в первую очередь химическими свойствами I е Те; Со е М;
4. Ряд элементов не был открыт — оставил пустые клетки (под Si — экасилиций (Ge) и др.)
Г. Мозли (1913 г.) — заряды ядер атомов последовательно возрастают на 1
=![]() номер элемента соответствует значению
заряда его ядра.
номер элемента соответствует значению
заряда его ядра.
![]()
![]() Современная трактовка: Свойства
элементов и их соединений находятся в пер,юдической
Современная трактовка: Свойства
элементов и их соединений находятся в пер,юдической ![]() зависимости от
значения заряда ядератомов (равного атомному номеру элемента в
периодической таблице элементов),
зависимости от
значения заряда ядератомов (равного атомному номеру элемента в
периодической таблице элементов),
Заряд ядра определяет число электронов в нейтральном атоме и число запс---е--, электронных оболочек в невозбужденном атоме, а также их заселенность (химические ГЕ: й : :
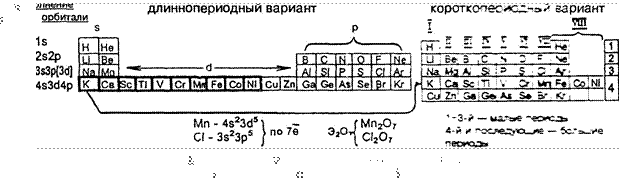 1
1
В МАЛОМ ПЕРИОДЕ: заполнение одного электронного уровня пе*ход
к следуп.д.—у ![]()
![]() U пе*ход ру-ому
эле«трн-юму •рыч:ю» расположенюму Р.ЛЬИЕ от яра. поэтому — О 0 0 о о о о уменьшение
притяжения внешнего
U пе*ход ру-ому
эле«трн-юму •рыч:ю» расположенюму Р.ЛЬИЕ от яра. поэтому — О 0 0 о о о о уменьшение
притяжения внешнего
![]()
![]() О. 155 нм
радиус нейтрального атома 0.064 нм
О. 155 нм
радиус нейтрального атома 0.064 нм
В периоде наблюдается увеличение эаряда яра, увеличение притяжения е к яру, увеличение электроотрицательности — способности атома оттягивать к себе электроны -» переход от металлическуи свойств к неметаллическим Тенденция образования устойчивой внешней электронной оболочки (оболочки инертного газа) 1. Атомный номер элемента = заряду ядра элементн начала периода элементы конца периода 2. Номер периода = числу уровней (обычно) З. Номер группы = тах. полок степень отРЮТ S, образуют преимущ. „легко принимают е, окисления (обычно) образуя О- ионы ковалентные связи образуя Э-ионы
4. Металлические свойства возрастают сверху вниз и справа налево
5. Металлические свойства проямяют
В—руппена увеличение числа электронных уровней (слоев) элементы с малым числом валентных в невозбужденном атоме; электронов на ВкиЛ*М ровне (оболочке) увеличение размера атома; 6. Периодиччость свойств объясуменьшение притяжения внешнего электрона к яру; няется опре№лењюй гювторяеыостью в уменьшение способности присоединять электрон; успение металлических свойств теней (оболочек)
заполнении электрьњ:х
ХИМИЧЕСКАЯ СВЯЗЬ
Взаимодействие атомов, приводящее к образованию

 обобществление
обобществление
ИОННАЯ СВЯЗЬ электронов
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Явление, при котором одни вещества превращаются в другие, называют
ХИМИЧЕСКОЙ РЕАКЦИЕЙ
|
По числу исходных и образующихся веществ |
По изменению степени окисления атомов |
|
|
Без изменения степени окисления |
С изменением степени окисления окислительно-восстановительные |
|
|
СОЕДИНЕНИЯ
несколько веществ продукт более более простого состава сложного состава |
СаО + нао = РЬО + 502 = PbSi03 СаСО3 + нао + соа = С Н +H 0= С Н ОН |
на + СК = 2HCl PbS + 403 = PbS04 + 402 |
|
РАЗЛОЖЕНИЯ
более сложное несколько веществ более простого состава |
Разложение кристаллоги№атов, кислот. оснований (на щелочей!), солей кислородсодержащих кислот и др.
СаСО3 = СаО + соа
|
4HN03 = 2+0 + 4N02 + 02 диспрогюрционирование «сюз = 3004 + ка |
|
ЗАМЕЩЕНИЯ А + ВС АВ + С простое сложное сложное простое |
2kBr + = 2kCl + |
|
|
ОБМЕНА АВ + СО АС + ВО наиболее распространены реакции между сложными веществами. протекающие без изменения стегени окисления и сопровождающиеся удалением продукта (продуктов) реакции в виде газа, осадка или образованием малодиссоциирующе. го соединения. |
AgN03 + КВГ = AgBr + КНОЗ Нейтрализации Без изменения степени кОН + на = NaCl + нао окисления малодиссоц Ги№олиза CH3COONa + + NaOH малодиссоц. |
|
|
|
|
|
Необходимо отметить: существует много реакций, которые трудно отнести к одному определен-
ному типу:
ГЧНЗ + С02 + НЮ + гчаа = NH4Cl + ГЧаНСО3Ј; 302 203
 работы расширяющихся азов.
работы расширяющихся азов.
2A1203 +
-—2NO -
|
Скорость протекания (химическая кинетика) Скорость гомогенной химической реакции определяется количеством вещества (числом молей Ап), превращенного в объеме (V) за промежуток времени
Чем определяется скорость? Реакция происходит при столкновении молекул реагирующих веществ, поэтому скорость определяется О числом столкновений и О их энергией О Концентрация (число молекул в единице объема). Чем выше концентрация, тем чаще происходят столкновения. для А + В -» С - k[Al • [В] где К — константа скорости (К = В, если, например, [А] = [В] = 1)
Закон действующих масс (К.М.Гульд6ерг и П.Вааге, 1864 г)
Так как доля молекул, обла№ющих необходимой энергией, быстро увелтивается с ростом температуры, скорость реакции резко возрастает с ростом температуры. Приближенное правило Вант- Гоффа: скорость возрастает в 2-4 раза при нагревании на 1 СС. Еакт Уравнение Аррениуса: К = const•e- R — газовая постоянная, Т — температура, К О катализатор — изменение механизма реакции -» уменьшение энергии активами -» увеличение скорости. Ингибитор — уменьшение скорости реакщи. |
|
Глубина протекания (химическая термодинамика) Многие химические реакции не удается довести до конца Н 2 + смесь чистый
Реакции, протекающие одновременно в двух ПРОТИВОПОЛОЖНЫХ направлениях, называют обратимыми 2 При равновесии: = пр Химическое равновесие
имеет динамический характер для реакции: ТА + ПВ
|
|||
|
Способы смешения химического равновесия П9ИНЦИП Ле Шател»е: если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие (изменить Т, Р, концентрамю), то равновесие в системе смещается в том направлении, при котором эффект воздействия уменьшается.
Катализатор не влияет на положение равновесия (константу равновесия), а только ускоряет его достижение |
 Сущность химической реакции состоит в
получении новых веществ,
Сущность химической реакции состоит в
получении новых веществ,  в перегруппировке атомов исходных веществ в продукты реакции
в перегруппировке атомов исходных веществ в продукты реакции
реакции, протекающие с изменением степеней окисления атомов
Условно считают, что окисление — это отдача атомом, ионом, молекулой электронов, а восстановление — присоединение к ним электронов. При окислении степень окисления атома возрастает, при восстановлении уменьшается.
Окисление одних атомов (А) в данной реакции: А —п ; = (А — восстановитель) всегда сопровождается
восстановлением других атомов (Э) в данной реакции: Э +пб = Эп- (Э — окислитель)
ВОССТАНОВЛЕНИЕ
понижение степени окисления
![]()
повышение степени окисления
ОКИСЛЕНИЕ
![]()
|
|
|
для того, чтобы определить направление протекания и продукты реакции, необходимо установить:
|
Окислители: 1. Простые вещества, образованные атомами |
Восстановители: 1. Атомы металлов l—III групп и др. (Na, Са, А, Fe...) |
элементов-неметаллов Vl—Vll групп (5, 03 , О 2. Отрицательно
заряженные ионы неметаллов ![]() Bra и др.)
Bra и др.)
2. Многие многозарядные ионы металлов: З. Многие сравнительно малозарядные ионы металFe3+ + е = Fe2+; Си2+ + е = Си* лов (Fe*, Мп 2* и др.)
З. Ионы, содержащие атомы элементов в высоких 4. Ионы и молекулы, содержащие атомы в проместепенях окисления: жуточных степенях окисления: мпоа- (Мп И), crp:- (Ст М)
4. Ионы и молекулы, содержащие атомы неметал- soa, $0 2- нзроз и др. лов в высших степенях окисления: 5. на, СО, сна, ГЧНЗ, С
+5 +5 6. Гидриды металлов l-lll групп (Сана, ИН и др.) НГЧОЭ, КС:ОЗ и др.
5. Кислоты (за счет ионов Н Ф )
6. Пероксиды, надпероксиды, озониды нра, к,оа, коз
![]()
для составления уравнений окислительно-восстановительных реакций
используют: метод електронно-ионноп бадаьеа![]()
|
(в водных растворах) |
газ, тв., |
|
1 . найти окислитель и восстановлель. |
1 . Найти окислтель и восстановлель |
|
2. Определить, какие ионы существуют в растворе |
2. Записать схемы полуреакций окисления и восстановления |
|
З. Записать схемы полуреакций окисления и восстановления |
З. Сбалансировать заряды и электроны |
|
4. Сбалансировать число атомов в каждой части, добавляя |
4. суммировать полуреакции в полное электронное |
|
н * или нао — в кислой среде |
уравнение |
|
ОН - или Н 20 — в щелочной |
5. Найти коэффициентн А +430 2 -9 А 203 |
|
т.о., наибольшая окислительная
активность КМпО 4 в кислой среде (обычно используют разбавл. Н 2604) |
2kcr02 + + ВКОН 2k2Cr04 + 6kBr + 4H20 k2Cr207 + ина 2crC13 + заат + жа + 7H20 |
![]()
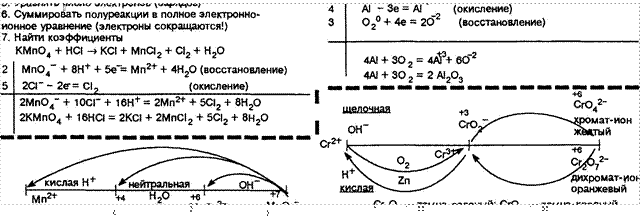 (гаэ
+ газ + тв. + тв.)
(гаэ
+ газ + тв. + тв.)
5. Уравнять электронов (зарядов) О
ионное уравнение ![]() сокращаются!)
сокращаются!)
7. Найти коэффициентн кмп04 + на ка + мпаг + + нао
Гомогенные системы переменного состава, состоящие из двух и более компонентов
![]()
Растворитель — количественно преобладает и находится в том же агрегатном состоянии, что и образующийся раствор
![]()
|
истинные растворы |
|
растворы неэлектролтов |
|
коллоидные растворы |
|
суспензии (твердые в ждцком) эмульсии (жидкие в ждцком) |
- 
![]() 10-9 _: 10-10 м
10-9 _: 10-10 м ![]()
Устойчивость ![]()
определяется
размером распределенных частиц - 10-6 _: 10-6 м ![]()
- 10-4 —: 10-5 м
|
Количественная характеристика |
Качественная характеристика |
|
|
|
т, (масса растворенного вещества) Массовая доля W = т2 (общая масса раствора) обычно выражают в процентах Если количество растворенного вещества п отнесено к общему объему раствора У, то говорят о молярной концентрации С растворенного веирства
|
Концентрированные: относителычо высокое содерхание растворенного вещества. Например, 95—9896 масс. H2S04 |
|||
|
подобное растворяется в подобном |
![]() избытокнад
твердым веществом
избытокнад
твердым веществом
Равновесие: насыщенный раствор. Отсутствие равновесия — ненасыщенный раствор (концентрация ниже насыщенного), или пересыщенный раствор — выше насыщенного.
Концентрация насыщенного раствора — мера растворимости вещества, его способности растворяться в данном растворителе.
|
выделяется, то с увеличением температуры растворимость уменьшается. Например, растворение в воде 02. Если темота в результате растворения: поглои.рется, то с увеличением температуры растворимость увеличивается. Например, растворение в воде ка, kN03 и др. для газов — закон Генри — с увеличением давления растворимость газа увеличивается. |

![]() Преимущественно химический процесс
Р2О5 + ЗН О = 2Н РО
Преимущественно химический процесс
Р2О5 + ЗН О = 2Н РО
2Na + 2Н2О = 2NaOH + на Т
Растворение
+ бензол
можно выделить физически растворенное вещество
![]()
 гча*04 • 10H20
гча*04 • 10H20
![]() сольватация разрыв связей (гидратация)
сольватация разрыв связей (гидратация)
![]() энергия образование А• ПНЮ дар о
энергия образование А• ПНЮ дар о
![]() поглощается новых связей энергия
выделяется общий тепловой эффект
поглощается новых связей энергия
выделяется общий тепловой эффект
![]() Растворы
многих солей, кислот,1. Проводят электрический ток (хотя в сухом состоянии —
изоляторы) оснований2. Некоторые коллигативные свойства растворов (Ткипения '
3*ерзачия и т.д.) изменяются т.о., как будто число частиц в целое число раз
больше, чем число молекул (формульных единиц) растворенного вещества.
Растворы
многих солей, кислот,1. Проводят электрический ток (хотя в сухом состоянии —
изоляторы) оснований2. Некоторые коллигативные свойства растворов (Ткипения '
3*ерзачия и т.д.) изменяются т.о., как будто число частиц в целое число раз
больше, чем число молекул (формульных единиц) растворенного вещества.
Электролиты — вещества, растворы и расплавы которых проводят электрический ток
|
|
|
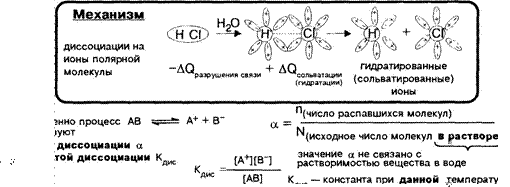 Количественно
процесс АВ характеризуют степенью диссоциации а
Количественно
процесс АВ характеризуют степенью диссоциации а
дис
Условное деление электролитов по силе для О. 1 моль/л растворов
396 3096
![]()
![]()
![]() Слабые электролиты H2S, Электролиты
среднейСильные электролиты
Слабые электролиты H2S, Электролиты
среднейСильные электролиты
Н СОЗ, СНЗСООН, Фенол, силы (по 1- й ступени) Н2$Оз, Н РО гидроксиды щелочных и гчнз н 20 Константа диссоциациищелочноземельных металлов, некоторые кислоты, соли (почти все).
Произведение растворимости
Ступенчатая диссоциацияМалорастворимые соли — это сильные электролиты. Их растворимость мб.
+ н 804— -3охарактеризована концентрацией ионов
3P041 в насыщенном растворе
[Н5[НРО42-]BaSO = Ва2+ + SO 2Н2РOГ Н + + НРО42— 10-8
= const
НРО 2— н + + РО з— = 10-13[Basoal
[НР04 ]К • = прBasoa [Ва25ро 23
Вода — слабый электролитПри Т = const ПР = const
2Н2О Нз0+ + ОН - — аутодиссоциацияЕсли осадок
— 10-14 (22 0 ) (ионное произведение воды)
[Н20ј = const Водородный показатель
Н20
нейтральная РН = 7 > [он а —кислая рн
< [он а —щелочная рн > 7
Ионные реакции: реакции между ионами, протекающие в растворе электролитов
Протекают в случае образования осадков Ъ, легколетучих веществ Т и малодиссоциированных веществ
![]() Смеси
ионов, реакции не идут. Na2S04 + Вась = 2NaCl + BasoaJ
Смеси
ионов, реакции не идут. Na2S04 + Вась = 2NaCl + BasoaJ
Нельзя говорить об изменении в ионной форме:
состава исходных веществ 2Na+ + SO 2- + Ва2 ++ 2Cl- = BasoaJ + 2Na+ + 23-
![]() + ва2+ = BaS04J — краткая форма
+ ва2+ = BaS04J — краткая форма
катод анод
 катиона аниона
катиона аниона
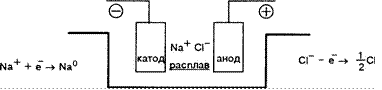
![]() суммарногча+
+ а- + 2
суммарногча+
+ а- + 2
2
2Naa 2Na + а
2
(Э Раствор NaCl
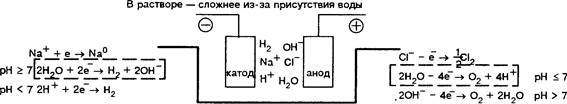
![]() а-420 + 23- -» + нД +
юнсуммарно2+420 + 2NaC| -1 + 1-12 Т + 2ГЧаОН
а-420 + 23- -» + нД +
юнсуммарно2+420 + 2NaC| -1 + 1-12 Т + 2ГЧаОН
Еще сложнее электролиз протекает в смесях солей. Возможность осуществления того или иного процесса зависит от окислительно-восстановительных свойств ионов в растворе для металлов — электрохимический ряд напряжений (ряд стандартных потенциалов Е 0 )
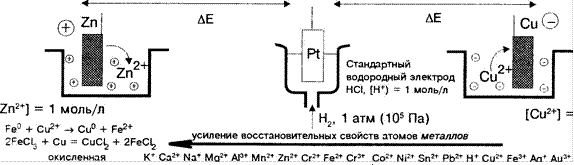 [Си +] = 1 моль/л
[Си +] = 1 моль/л
форма восстановленная К Са Na Мо А Мп Zn Cr Ее Cr2* Со Ni .Sn РЬ Н Си Fe2+ Ао Аи
 2
2
Э Э
02 + 48 +
Оксиды — сложные вещества, состоящие из 2-х элементов, один из которых — кислород в степени окисления —2
|
Формула |
Название |
Формула |
Название |
|
со |
оксид углерода (П) |
|
оксид железа (Ш) |
|
НО |
оксид азота (И) |
сгоЗ |
оксид хрома (Vl) |
|
N205 |
оксид азота (V) |
|
оксид марганца (Vll) |
Агрегатное состояние при н.у.: газы (М), СО, СО2 и др.), жидкости (НР) и твердые (Fe203, MgO, СаО и др.) вещества. Получение оксидов
1 ) Окисление кислородом а) простых веществ: 2Mg + 02 = 2MgO
6) СЛОЖНЫХ веществ: 2H2S + ЗО = 2Н20 + 2S02
2) Разложение а) нагреванием солей: 2CuSO — 2СиО + 2S02 + О громе •2kN03 солей = 2kN02 щелочных + металлов:О2
![]() = 2РЬО + 4N02 + 02
= 2РЬО + 4N02 + 02
![]() б)
нагреванием= СаО + Н О гидроксиды щелочных металлов оснований:= сио + нр не
2ИОН разлагаются, = иго + нркроме ИОН
б)
нагреванием= СаО + Н О гидроксиды щелочных металлов оснований:= сио + нр не
2ИОН разлагаются, = иго + нркроме ИОН
в) нагреванием кислородсодержащих кислот в случае термически неустойчивых
кислот (Н2СОз, Н S03) простое нагревание ![]() = S02 + нр в случае термически
устойчивых кислот — нагревание в присутствии Р2О5
= S02 + нр в случае термически
устойчивых кислот — нагревание в присутствии Р2О5
![]() 2HC104
2HC104 ![]() + нр Р2О5
+ нр Р2О5
; 2HNOз ро 3=N0 2 5 + нр
З) Разложение высших оксидов и окисление низших:
4Cr03 2Сгрз + ЗО2 4FeO + 02 = 2FeP3
4) Вытеснение летучего оксида менее летучим при высокой температуре:
Na2C03 + Si02 = Na2Si03 + СОД
5) Взаимодействие кислот — окислителей (Н SO HN03) с металлами и некоторыми
неметаллами:
И + 4HN0+ 2N02T + 2Н20
![]() 2H
soa + С + СОД + 2Н20
2H
soa + С + СОД + 2Н20
![]()
|
ОКСИДЫ |
![]() несолеобразующие
(N20, NO,
несолеобразующие
(N20, NO,
СО и др.)
|
Основные — реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1) Некоторые — с водой (оксиды щелочных и щелочнозеМУ1ЬНЫХ металлов): СаО + нр = 2) Все — с кислотами Реаоз + вна = 2FeC13 + ЗН О З) С кислотными оксидами СаО + соа = сасоз 4) С амфотерными оксидами Li20 + A120 = 2LiAI02 |
м отерные ПО, А|20з, СЪОЗ, МПО2 Взаимодействуют как с кислотами, так и с основаниями.
ИО + 2NaOH + нр = Реагируют с основными и кислотными оксидами
ИО + СаО = СаИО2
ИО + SiO = znSi03 |
ислотные — реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1) Большинство — с водой + нр = н so4 2) Со щелочами 2NaOH + = Na2SiO + Н2 З) С основными оксидами
З (шлак) 4) С амфотерными оксидами |
С позиций теории диссоциации основания — соединения, образующие при растворении в воде из отрицательных ионов только ионы гидроксида ОНС позиции протонной теории Й. Бренстеца и Т. Лоури основания — акцепторы протонов (NH + Ю = NH4+)
С позиции электронной теории Г. Льюиса основания — доноры электронной пары (ОН- , HF и др.)
|
Физические Твердые
кристаллические вещества. В воде растворимы щелочи: ИОН, NaOH, свойства :
КОН, СОН, НЬОН, растворы щелочей мылки на ощупь, разъедают кожу, ткань — едкие щелочи |
|
ПОЛУЧЕНИЕ Щелочи можно получить по реакциям: 1 Металл + вода 2Na + ан О = 2NaOH + Н Т 2. Оксид + вода Li20 + Н О = ион СаО + Н О Нерастворимые в воде основания:
Исключение Na2C03 + = 2NaOH + сасозЈ насыщенный раствор |
|
2. С кислотными оксидами кон + со2 = кнсоз жон + с02 = касоз + нр 2NaOH
+ спя.а•лжи. З. Растворы щелочей имеют РН > 7, изменяют окраску индикаторов. В щелочной среде окраска лакмуса — синяя, фенолфталеина — малиновая 4. Щелочи взаимодействуют жон + ио = крп02 + н от с амфотерными оксидами 5. Щелочи
взаимодействуют с 6. При нагревании: гидроксиды щелочных металлов — не разлагаются (кроме ИОН) щелочноземельных — разлагаются при прокаливании 7. |
|
Амфотерные гидроксиды (АЦОН)з, реагируют с кислотами щелочами |
гидроксиды щелочных и щелоч- ОН ноземельных металлов — гироксид кальция щелочи ОН
Ее— О— Н гидроксид железа
(Ш)
С позиции диссоциации шслоты — соединения, образующие при растворении в воде из положительных ионов только ионы водорода Н+ (ионы гидроксония НзО+). С позиции протонной теории Й. Бренстеда и Т. Лоури кислоты — доноры протонов (НС“ НзРО4 и др.). С позиции электронной теории Г. Льюиса кислоты — акцепторы электронной пары (Н 0+

свойства твердые — Н РО , Н SiO
некоторые существуют только з растворах — H-SO![]() Химические свойства
Химические свойства
О Растворы кислот имеют рН<7, окрашивают метилоранх
лакмус в красный цвет
(Э Все кислоты реагируют с основаниями
(реакция нейтрализации)
Э С основными оксидами (и амфотерными)
О Кислоты, анионы которых — неокислители, реагируют с металлами, стоящими в ряду стандартных потенциалов до водорода, с выделением водорода
Э С солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество
О При нагревании кислородсодерпщие кислоты разлагаются
Н S04 + = FeSO, — 2+-0
Берз + вна = 2FeCl. - ЗН-О
И + 2на = znC12 + н2
+ вааа = ва$04Ј +
2HCl + гчаасоз = 2NaCl + нр +C02T
= наот + Si02 = наот + .S03T
|
соли С позиции теории диссоциации соли — сильные электролиты, существующие в водных растворах в виде положительно заряженных ионов металлов и отрицательно заряженных ионов кислотных остатков (иногда в растворах солей имеются также ионы Н+ и он-). Соли можно рассматиривать
как продукт полного или частичного замещения атомов водорода (Н) в молекуле
кислоты на металл (H2S04 —» NaHS04 Na2S04) или замещения гидроксогрупп в
основании на кислотный остаток
|
|||||||||||||||||||||||||||
Получение
|
1. С использованием |
металлы с неметаллами: |
|
металлов |
металлы с кислотами: металлы с солями: |
|
2. С использованием |
основные оксиды с кислотами: |
|
оксидов З. Реакцией нейтрализации |
кислотные оксиды с основаниями: кислотные оксиды с основными: амфотерные оксиды: |
|
4. Из солей |
соли с солями |
соли с основаниями соли с кислотами
кислые соли получают такими же способами, что и средние,
2NaOH + = Na2S04 + 2H О
2NaOH + = на СОЗ + Н О
2 1 — средняя
Избыток кислоты, взаимодействуя со средней солью, переводит ее в кислую
2Mg + = МОСь zn + H2S0 = znsoa + нД
вытесняет стоящий левее в электрохимикеском ряду левее Н, или — кислота окислитель +403 , Н 2SO
сао + 2на ='ёасц + с02 + = сасоз + нр СаО + со2 = сасоз + СаО =
+ 2NaOH = Na2S04 + 2H О на + NaHC03 = Naa + нр + со Т
AgN03 + Naa = + NaN03 cusoa + 2NaOH = + Na2S04
Na2C03 + = 2NaCl + Н О + СОД
реакчи. один из продуктов №лжен у№ляться из зоны реак№и
но при других мольных соотношениях регентов
NaOH + Н soa = NaHS04 + Н О
NaOH + СО2 = NaHC03
1 1 — кислая
Саз (род) 2 + Н род = ЗСаНРО4
+ 4НзРО4 =
основные соли образуются при взаимодействии некоторых солей с щелочами: Zf1Cl + NaOH — Zf10HClJ + NaCl. Основные соли обычно хуже растворимы в воде, чем средние
Физические свойства твердые кристаллические вещества. Многие соли имеют высокие температуры пл. и кип. По растворимости в воде делятся на хорошо (NaCl, КС), мало (PbCi:, CaS04) и практически нерастворимые (BaSO„ PbS04, PbS, СаСОз), Сильные электролиты.
Хитческие
свойства 1. Разлагаются при прокаливании (см. получение оксидов). 2.
Взаимодействуют с металлами, другими солями, щелочами, кислотами (см. выше)![]()
З Заказ 2263
Гидролиз солей — взаимодействие солей с водой, приводящее к присоединению протона Н+ молекулы воды к аниону кислотного остатка и (или) групп ОН- молекулы воды к катиону металла. Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям, и анионами, соответствующими слабым кислотам. Обычно гидролиз обратим и протекает на 15— 2096 (т.е. в гидролизе участвуют 15—2096 соответствующих катионов или анионов).
|
Соль образована слабым основанием и сильной кислотой cuCl2 = си 2+ + 20Си2+ + Н 20=2 + Н+ Образуется слабодиссоциирующий катион Си(ОН)+. Среда в растворе кислая сись + |
|

Гидролизу подвергаются соли как неорганических, так и органических кислот:
СН COONa = СН СОО- + Na+ сн соо- + нр + он-
СН COONa + СООН + NaOH
а) при нагревании раствора (т.к. гидролиз — обычно эндотермический процесс)
б) при разбавлении раствора водой:
![]() = АР+ + за-
= АР+ + за-
![]() А13+
+ Н 0 + Н+
А13+
+ Н 0 + Н+
АЦОН)2++ Н + + Н+
АЦОН) + + Н + Ю
![]()
![]() NaF = На + + рЕ- + Н + ОН-
NaF = На + + рЕ- + Н + ОН-
NH4N03 + нр ——NH3. Н 20 + НМ)з
+ NaOH
2AlCl3 + 3Na2C03 + знр = 2АЦОН)зЈ + ЗСО$ + 6NaCl
ПОДГРУППА ЩЕЛОЧНЫЕ МЕТАЛЛЫ И, на, К, Rb, cs
|
Электрохимический ряд стандартных потенциалов ! И, cs, К, На... большая энергия гидратации иона Li+ (малый радиус) |
|
В природе: Na — 2.64% (по массе), К — 2.5%(по массе), И, Rb и Cs — значительно меньше NaCl — поваренная соль (каменная соль), галит На SO • 10Н О — глауберова соль NaN03 — чилийская селитра Na3AlF, — криолит тОН О — бура — сильвин калийные удобрения • NaCl — сильвинит |
|
очень мягкие металлы, легко Физические — режутся ножом. На срезе свойства: белого цвета с серебристым металлическим блеском, исчеза- ющим на воздухе из-за окисления. Плотность увеличивается от 0,53 (И) до 1,90 (Cs) г/см з . Т понижается от 181 (И) до 29 0С (Cs). |
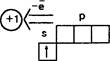
![]() увеличениеусиление
радиусавосстановительных атомасвойств
увеличениеусиление
радиусавосстановительных атомасвойств
малая электроотрицательность, относительно небольшая энергия ионИэациИ
|
Химические свойства |
ПОЛУЧЕНИЕ т.к. щелочные металлы — это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей: 2NaCl = 2Na + ад на катоде: Na+ + е = Na на аноде: СГ — е = 1 рад |
|||
|
очень активны, наиболее сильные восстановители 1. С кислородом Rb, Cs — самовоспламеняются 2Na + 02 = нара; Ж + 202 = — пероксиды 4Li + 0 = 2Li О — оксид лития 2. С галогенами — с выделением большого количества тепла СЦ + 2Na = 2 NaCl — галогенид (хлорид) З. С серой при нагревании — сульфид
4. Литий взаимодействует с азотом (при комнатной тем-ре) — нитрид
5. С водородом при нагревании Н 2 + 2Na = 2NaH — гидрид 6. Легко окисляются даже водой 7-420 + 2Na = 2NaOH + Н Т |
||||
|
+ 1 Соединения щелочных металлов Щелочные металлы — самые сильные восстановители, их ионы (Na+ К+ и др.) не проявляют окислительных свойств |
|
||||
|
Гидроксиды (едкие щелочи) твердые кристаллические вещества, типично ионные соединения, сильные основа- ния . NaOH — едкий натр, каустическая сода; КОН — едкое кали Получение 1. Электролиз водного раствора NaCl: катод: 2H20 + 2е = Н Т + 20H- анод: 2CI- -2е = ад суммарная реакция: 2н2о + 2NaCl = а 2 Т + н 2 Т + 2NaOH 2. Каустификация соды:
сабо» |
оли — типично ионные соедюнения, как правило — хорошо растворимы в воде (кроме некоторых солей И — LiF, ИЗРО и др.). Образованные слабыми кислотами соли гидролизуются. Na СО • 1 ОН О — кристаллическая сода Na2C03 — кальцинированная сода NaHC03 — питьевая сода — поташ Получение соды аммиачный способ (метод Сольвэ) — насыщение раствора NaCl газами СО2 и NH • МН з + СО2 + Н 20 = NH НСОз NH4HC03 + Naa = ГЧаНСОзЈ + NaHCO выпадает в осадок (сравнительно мало растворим). кальцинирование — прокаливание 2NaHC03 = нароз + СОД + H20T |
Качественные реакции: окрашивание пламени ионами Li+ — карминово-красное — желтое К* — фиолетовое |
|
||
ПОДГРУППА Па. Ве, Mg и щелочноземельные металлы са, sr, Ва
|
щелочноземельные металлы реагируют с водой как металлы, так и их оксиды («земли») возрастает радиус атома, усиливаются металлические свойства, возрастают восстановительные свойства |
|
Магний: легкий (р 1.74 г/см 3 ) серебристый В природе: в земной коре содержится магния металл, епл 650 0 С, устойчив на воздухе 2.3596 по массе, кальция Кальций: легкий (р 1.55 г/см 3 ) металл, на Встречаются только в виде соединений — воздухе быстро окисляется и разрушается, силикатов, алюмосиликатов. Минералы: MgC03 епл 842 0 С — магнезит, MgC03 • СаСОз — доломит, MgC12 • 6Н О — бишофит, СаСОз — мел, мрамор известняк, CaSO 2Н О — гипс, CaF2 — флюорит, CaF2 — фторапатит |
|
Химические свойства Mg и Са Оба металла — сильные восстановители. Степень окисления в соединениях всегда +2 2Mg + 02 = 2MgO (при поджигании) 2М + UF = U + 2MF2 (кальций- и магнийтермия) 2Са + 02 = 2СаО (при комнатной температуре) Оксиды MgO и СаО — основные. сао — негаМ + = (М = МО, са) шеная известь, MgO — жженая магнезия
М + Н 2 = МН2 — гидридыпри нагревании МО + Si02 MSi03 2М + Si = M2Si — силициды2Mg + СО2 2Mgo + С
МО + 2H О = + НД (кипячение) 2Mgo + 5C = МЩСЗ + 2C0 Гидроксид
М + 2HCl =
MCl2 + Н 2 Т основание. Гидроксид основание.
|
|
ПОЛУЧЕНИЕ т.к. металлы lla подгруппы сильные восстановители, то получение возможно только путем электролиза расплавов солей. В случае Са обычно используют CaCl2 (с добавкой CaF2 для снижения t0 плавления) caCl2 |
|
ЖЕСТКОСТЬ ВОДЫ Жесткость воды — наличие в воде растворимых солей Са2+ Mg 2+ и др. Обусловливает образование накипи. В жесткой воде плохо мылится мыло: 2C, H35COONa + са 2 + =
«смягчение» водыcaCl2 + Na2C03 = сасозЈ + 2NaCl добавлением соды
|
ПОДГРУППА
та. АЛЮМИНИЙ![]()
|
В природе: многие горные породы по своему составу — алюмосиликаты О, Si, щелочные и щелочноземельные металлы) глины — Al203 • nSi02 тН2О бокситы — A1203 • пН2О нефелины — kNa3[AlSi0414 |
|
Физические свойства: серебристо-белый металл, пластичный, легкий (2,7 г/смЗ ), хорошо проводит тепло и электрический ток. Т = 6600С |
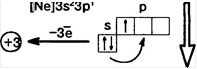 В неметалл
В неметалл
А! оксиды и гидрослды ба проявляют амфоln терные свойства
TI металлические свойства
Получение — электролизом расплава (расходуется около 16 кВт • час на 1 кг А!)
|
|
|
|
|
|
Активныи металл, восстановитель, устоичив на воздухе и в воде из-за наличия плотной защитной пленки А|2Оз. с простыми веществами 1. 4Al + 302 = 2Al203 + а — покрывается пленкой оксида, но в мелкораздробленном виде горит с выделением большого количества теплоты. 2, Алюминотермия — получение металлов: Fe, Cr, Мп, Ti, и другие, например:
= 2AlCl3 (Bra, l2) — на холоду 4. 2Al + .3S — - Al2S3 — при нагревании 5. 4Al + ЗС -— Al4C3 — при нагревании |
со сложными веществами 1. 2Al + 6H20 = ИЦОН)з + знат — после разрушения пленки A1203 2. Растворяется в щелочах 2Al + 2NaOH + 6+420 = гироксоалюминат натрия З. 2Al + 6HCl = 2AlCl3 + знат 4. С НГЧОЗ и концентрированной H2S04 на холоду не реагирует — пассивируется. При нагревании: 2Al + = А! + 6HN03 = + 3N02T + знр |
Соединения со степенью окисления +3
|
Оксид N203 — очень твердый (корунд, рубин), тугоплавкий — 2050 0 С. Не растворя- ется в воде Получение: 2АЦОН)з = Al203 + знао Свойства: амфотерный окси + 6на = 2AlCl3 + знр + 2NaOH + знр = перевода в растворимое состояние л:.-ользуют сплавление: + 2NaOH = 2NaAl02 + нр Al203 + Na2C03 = 2NaAl02 + С02 метаалюминат |
Гидроксид АЦОН)з Получение: осаждение из растворов солей НР) = АЦОН)зЈ + 3NH4Cl
+ соа = + NaaC03 + нр Амфотерные свойства:
|
![]() -«:гие соли N(+3) хорошо растворимы в воде
(кроме АРО4), они гидролизуются (кислая
-«:гие соли N(+3) хорошо растворимы в воде
(кроме АРО4), они гидролизуются (кислая
![]()
![]() 2
2
|
В природе: Резо, — магнетит (магнитный железняк) Fea03 — гематит (красный железняк) Fea03 • хН20 — лимонит (бурый железняк) FeS2 — пирит FeC03 — железный шпат (сидерит) По распространению — 4-й элемент (4,696 по массе) земной коры |
|
|
|
|
|
|
|
+3 |
|
|||
|
шиишт |
|
|
|
|
3d 3d
—--;я Оподоболочка звестны соединения, содержащие железо в ругих степенях окисления пол чение
|
иенный газ становление : Е зазование шлака науглерокивание сгорание кокса зрячее кислохдное дутьё |
Рур (Рев, Резо, , кокс — С. флюсы — 3Fe203 + СО = 2Еез04 + С Резо, + СО = ЗГ-еО + СО Г-еО + СО = Ее + соа Г-еО + С = Ее + СО сасоз = СаО + С02 СаО + Si02 = CaSiOз(щлак) Ее + С чугун ас +0 = асо с +0 = со 2 шлак металл-чугун Доменный процесс |
примеси SiO 2), известняк Сасо з 45000 поос 80000 1 оооос 120000 1600ос ЧУГУН (ВыИ.» затвердевании |
8 сч 2.1496 С) |
Получение стали урление С (Р, Si. S, Мп) 1. КИСЛОРОДНЫЙ конвертер с + 02 = c02 2Fe + 02 = 2FeO 2. Мартеновская печь = C02 4Р + 502 = 2P205 2 = 2 Si + 02 = Si02 и др. З. Электродуговой метод 4. Возможно и бездоменное получение стали — хрупкий, расширяется при |
изические свойства: чистое железо — пластичный металл, плотность 7,87 г/см з , tпл 1 35 0 С. Существует а-железо (кубическая объемноцентрированная решетка) и у-железо (к. бическая гранецентрированная решетка). C-Fe обладает магнитными свойствами.
лезо — металл средней химической активности, восстановитель, в сухом воздухе покрывается
з. цитной пленкой оксида, во влажном — ржавеет: Fe + Н О + О -» • хн О.
4Fe + 302 = 2Fea03 конц. НГЧОз, конц. H2S04 с железом не реагируют
|
сильныеокислители 3Fe + 20(чист. ) 04 2Fe + 6Haso = + 3S02T + 6+420 |
|
|
заа + 2Fe = 2FeC13 Ее + 4HN03 = + нОТ + 2H20 |
|
|
|
(1:1) |
|
слабые 6-е + S = FeS |
г-е + ана = + нат |
|
окислители 6-е + CUSO, = Feso, + си |
Г-е + Haso и менее) = Feso, + нат |
|
Fea03 — порошок бурого цвета |
FeO — порошок черного цвета |
|
Получение: |
Получение: |
|
4FeS2 + 1102 = 2Fea03 + 8S02T |
Регоз + €-l2 = 2FeO + нр |
|
46-е + 302 = 2Fea03 |
Fecp, д г-ео + C02 + со |
|
— амфотерный гироксид с преобладанием основных свойств |
оксалат |
|
сплавление |
FeO + Н 20 |
|
NaaC03 + - 2NaFe02 + соа |
FeO — основный оксид |
|
6на + = 2FeC13 + знр |
2HCl + Г-еО = + нао |
|
NaFe02 + 2H20 = + NaOH |
+ ЖОН = + жа |
|
окислитель: 2FeCl3 + 2kl = 2FeC12 + + 2kCl |
соединения Fe(+2) на воздухе, как правило, неустойчивы, т.к. обладают восстановительными |
|
качественные реакции на Fe3 + |
свойствами и легко окисляются (особенно в щелочной среде) |
|
1) Г-еЗ+ + SCN- = [FeSCN1 2 + красное окрашивание |
качественная реакция на Fe 2 + |
|
2) Г-еЗ+ + К [Fe(CNY6] синее окрашивание |
Г-е2+ + синяя окраска |
|
гексацианоферрат(П) киия, |
гексацианоферрат(Ш) киия, |
|
желтая кровяная соль |
красная кровяная соль |
![]() подгрУППА
подгрУППА ![]() ВОДОРОД Н
ВОДОРОД Н ![]() VIIa ПОДГРУППА
VIIa ПОДГРУППА
щелочные металлы галогены
|
Состоит из протия Н ( т н) (99.985%), дейтерия D ( 2 Н) и следов радиоактивного трития Т ( э н). Во Вселенной — наиболее распространенный элемент (9096 массы Солнца — водород). В земной коре — 1 % по массе. Входит в состав воды, метана, нефти, каменного угля. В свободном виде встречается очень редко |
Н
протон элементарная частица отсутствие электронных оболочек малый размер

Химические: при обычных условиях довольно Физические: газ без цвета и запаха. малоактивен (реагирует только с 5), т.к. —252 0 0. Самый легкий газ. Плохо молекула Н 2 прочна. растворим в воде. Растворяется в некоторых металлах (Pd, Ni), переходя в атомарное
восстановитель состояние.
1. Потеря электрона — образование протона — окислитель
Н Ф — (в водных растворах — ион гидроксония
образование гидрид-иона
НзО+) Н- — при взаимо-
2. Наиболее характерно — образование поляр- действии со щелочными и щелочноземельныных ковалентных связей (валентная оболочка ми металлами
2Н + О = 2Н О (со взрывом) «гремучая» смесь 2+12 + 02 '-12 + 2Na = 2ГЧаН
Н
2 2 ТЫНз + Са = Сан
Н + F = 2 НР — со взрывом при любой температуре 2 2
Н + Cl2 = 2 НС! — на свету цепная реакция
Bra, l2 — менее энергично, не идут до конца гидриды — ионные соединения, сильные
Н S — пропускание На над нагретой до восстановители:
ГЧаН + Н
150-200 0 0 серой О = ГЧаОН + Н2
Восстановление оксидов: ЗН + Ре О = 2Fe + ЗН О ЗН + W03 = W зн О Оксиды металлов, более активных, чем Ре, водородом до металла не восстанавливаются.
применение: синтез на, ?ЧНз, при восстановлении оксидов некоторых металлов, реакции
гидрирования в органической химии, для получения маргарина — гидрирование растительных жиров, синтез метанола СН ОН и др.
ПОДГРУППА VlIa. ГАЛОГЕНЫ (F, Cl, вг, 1)
d отсутствует у F
![]()
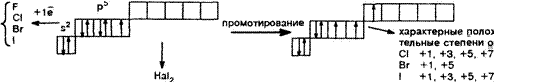 степень окисления —1
степень окисления —1
|
размер атома, поляризуемостъ, интенсивность окраски (от зеленовато-желтой до темно-фиолетовой), энергия межмолекулярного взаимодействия |
||||||||
|
Химические свойства: галогены — сильные окислители, взаимодействуют с металлами, неметаллами, сложными веществами. F2 — наиболее реакционноспособен, реакции идут на холоду. при нагревании — даже с участием Аи, Pt С простыми веществами: Со сложными веществами: Si + 2F2 = SiF4 Si02 + 2F2 = SiF4 + 02 2Na + F2 = 2NaF Хе + 2F2 = Хер4 многие металлы в атмосфере фтора загораются. На поверхности М, Си и некоторых других возникает защитная пленка, реакции прекращаются
— химически менее активен. Реакция 2Hl протекает при 3000Спредыдущий вытесняет последующий из галогенидов Cl2 + 2kBr = КС! + ВГ2 |
||||||||
|
увеличивается
! Si02 + 4HF = SiF4 + 2Н20 галогенид-ионаспособность
— Agl желтый осадоккислоте Получение ННа|: 1. caF2 + = caso, + 2HF 2. Н 2 + C12 = 2HCl З. + ЗН2О = + Н з роз 4. Аз + ЗН2О = + Н роз 5.H2S + SJ + 2Hl |
В природе:
F — флюорит CaF2, фторапатит • CaF2
Cl — каменная
соль NaCl, сильвинит NaC| • ![]() в водах, сопутствующих нефти, в водах горьких озер и др.
в водах, сопутствующих нефти, в водах горьких озер и др.
электролиз фторидов электролиз раствора NaCl, НСЛ + КМпО4 и щ).
бромиды
иодиды
2Nal + мп02 + ан S04 + м:Б04 + ![]() SO + и др.
SO + и др.
 кислородные
сое нения
кислородные
сое нения
|
В природе всегда степень окисления NaCl — поваренная соль, галт NaCl, — сильвинит КС: — сильвин MgC12 • • бН2О — карналлит |
Физические свойства: т = -340, газ зеленовато-желтого цвета, ядовит, немного растворим в воде.
Получение:
в технике: электролиз раствора NaCl; в лаборатории: 16HCl + ЖМП04 = 2Mnc12 + + + 8H20 или ана + саоаа -» сц + нр + саа2
|
Химические свойства C12: сильный окислитель с простыми веществами: 1. 26-е + заа = 2FeClз 2. 2P + 502 = ара5 З. си + = СИСь 4. Н + Cl2 = 2HCl на свету цепной механизм:
С Na, С, 02 — непосре№твенно не реагирует |
со сложными веществами: 1. Вытесняет бром из бромидов СЦ + 2kBr = 2kCl + ВЪ 2. Окисляет S02 и др. вещества: + S02 + 2H20 = 2HCl + З. С органическими веществами: реакции
замещения: С 2Не + C12 —» C2H5Cl + НС! (на свету) присоединения: Н ас=сна +
аг -» 4. С водой: Н2О + С!2 НС! + НСЮ —Q (хлорная вода) 5. С растворами щелочей на холоду: жон + = ка + као + нр при нагревании: хон + заа = ха + каоз + знао 6.
С (белильная или хлорная известь) |
|
Получение HCI: в промышленности: + на = ана в лаборатории: NaCl + — бесцветный газ с резким запахом, хорошо растворим в воде (400 л НС! в 1 л воды — макс. 37—4096 НС!). Водный раствор — сильная хлороводородная (соляная) кислота. Может проявлять восстановительные свойства (за счет СР): гипоа + 4на = мпа? + + 2H20 Соли — хлорцы, ионные соединения, хорошо растворимы в воде (кроме AgCl, PbCla, Hg2Cla, cuCl) Качественная реакция: белый творожистый осадок в КИСЛо среде: Ag+ + а- = AgcW Aga + 2NH3 • нао = — 2Н О ! В отличие от AgBr и Agl, AgCl растворяется в избытке раствора аммиака. |
Кислородные соединения
на свету НС! + 02 О НОС| НС] + НСЮз caC12 ню + ско
ксюз — бертолетова соль, разлагается при нагревании 2kClO = 2kCl +302 Т (катализатор МпО2) 4kClO Применение мора: получение НО, обеззараживание воды, синтез органических соединений, хлорирование руд и др |
ПОДГРУППА ша. О, S, Se, Те
(халькогены — образующие руды [меди])
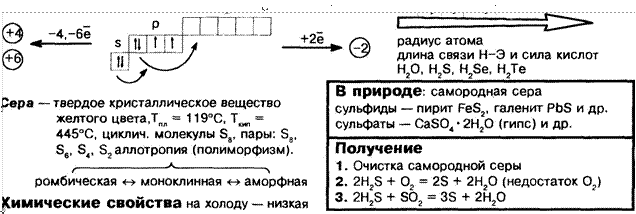 желтого цвета, Тпл 1190 0, ткип
желтого цвета, Тпл 1190 0, ткип ![]() 445 0 0,
циклич. молекулы Sg, пары: Se, Ss, * , S2 аллотропия (полиморфизм).
445 0 0,
циклич. молекулы Sg, пары: Se, Ss, * , S2 аллотропия (полиморфизм).
ромбическая е» моноклинная е» аморфная
реакционная способность, при нагревании возрастает
1. как окислитель + S = FeS
2.
|
-2 |
+4 |
|
|
бесцветный газ с запахом тухлых яиц, слабо растворим в НР Получение:
FeS + 2HCl = FeC12 + Н S Химические свойства: Водный раствор H2S — слабая кислота (слабее Н SO )
гидролиз S 2- + Н О HS- + ОНкачественная реакция: рь2+ + S2- PbSJ черного цвета восстановитель обычно окисляется до S 0 , иногда до S(+4) и S(+6) в зависимости от силы и количества окислителя 2H S +0 = 2S + 2H20 недостаток 02 ж s + 30 = во + о избыток о2 с галогенами 2S + ВЪ = 2HBr + S Н S + 402 + 4Н О = Н SO + НМ) — зависит от концентрации + 2HNO = S + 2N02 + 2H О и даже со слабыми окислителями НЭ + 2FeCl3 = + 2на + 2H S + |
В природе — вулканические газы О S бесцветный газ с резким запахом Получение: 1. S + 02 = — горение серы 2. 4FeS2 + 1102 = 2Fea03 + 8S02 — обжиг пирита в лаборатории
си + ан so = CUSO + SO + Н О Химические свойства: кислотный оксид SO + Са(ОН)2 CaSO + Н О soa + '-420 Н SO — сернистая кислота средней силы
растворимы только гидросульфиты сульфиты щелочных как правило. металлов. гидролиз растворимы окислительно-восстановиNaS03 тельная двойственность восстановитель с окислителями soa + Вь + 2H О = Н SO + 2HBr бромная вода, обесцвечивание 2Na2S03 + 02 = 2Na2S04 окислитель с восстановителями soa + = 3s + ан о диспропорционирование ак = 3k2S04 + к; (прокаливание) присоединение S: на + Na2S203 тиосульфаты (кипячение раствора с |
= 16,80, Т = 44.8 0 C кил Получение: а) В контактном аппарате, содержащем катализатор V20s, 400—6000С
2s02 + б) Поглощением S03 в поглотительной башне методом противотока H2SO получают раствор 503 в H2SO, — олеум. Олеум разбавляют до 9896 Н SO4
серная кислота но/ Хо сильная кислота (при диссоциации по 1-й ступени). Концентрированная — водоотнимающее свойства (обугливание): с н о = 120 + 1 ж о 12 22 11 сахар окислительные свойства за счет- S(+6)
с металлами, стоящими после нг , при си + 2Н SO, = CuSO, + SO + 2H О с активными — смесь + н», s02, s, нр + uso, На холоду: пассивирует Ре, А, ст Разбавленная — как обычная кислота. окислитель — н *
Качественная реакция: Ва2 + + SO , 2- = BaSO белый осада не растеоримый в кислотах |
с
р р В природе состоит из
![]() оке160,
170 180. Самый рас-
оке160,
170 180. Самый рас-
пространенный элемент валентность 2 земной коры (49,1 масс.%). только со фтором ст. окисления -2 (главная) Атмосфера содержит 21 % кисло по объем
Возможны также степени окисления —1 (пероксиды Na202t Н2О2), -1/2 0<204), +1(F202) и +2 (ВО)
Получение:
в промышленности
Перегонка жидкого воздуха, т.к. Т О2 = -183 00, а = -196 00 в лаборатории
1. Электролиз водных растворов солей и щелочей 2Н О = 2Н + 02 (см. получение Н2)
2. Разложение перманганата калия, ЖМП04 = Камп04 + мп02 + 02
|
пероксида водорода, |
2Н2О2 = 2Н2О + 02 (катализатор МпО2) |
|
бертолетовой соли |
жаоз = жа + 302 (катализатор мп02) |
|
З. Из пероксида бария |
2Ва02 = 2ВаО + 02 |
Свойства:
|
Физические: бесцветный газ, без запаха. Тхип —183 0 С, в 1 л НР растворяется 0.04 г 02 Парамагнитен — втягивается в магнитное поле |
Химические: в реакциях со всеми простыми веществами — окислитель. Непосредственно не реагирует с галогенами, инертными газами, Аи, Pt, кислородные соединения которых получают косвенными путями |
Реакции
|
с неметаллами S + 02 = S02 4P + 502 = 2405 с + 02 = соа + 02 = 2H20 N2 + 02=22N0 2000ос |
с металлами сгорают с образованием оксидов 2 МО + 02 = 2MgO 3Fe + 20 = Fe304 (чистый кислород) А, Cr — тонкая защитная пленка оксида щелочные металлы (кроме И) при нагревании в сухом 02 образуют пероксиды: 2Na + 02 = нара и надпероксиды: ж + 202 = кд |
со сложными веществами при горении в избытке кислорода образуются, как правило, соответствующие оксиды: 2H2S + 302 = 2S02 + 2H20 сн4 + 202 = соа + 2-120 при нерстатке 02 — сажа (С), СО... санрн + 302 = 2002 + знр 4FeS2 + 1102 = 2Fea03 + 8S02 пирит |
Газообразный кислород существует в двух аллотрОпныХ модификациях — дикислород 02 и трикислород 03 (озон)
Озон 03 образуется при электрических
разрядах: 02 + энергия 20; О + 02 = Оз суммарно 30![]() - 286 кдж
- 286 кдж
Озон — нестойкое вещество, легко распадающееся, обладает сильным окислительным действием
PbS + 403 = PbS04 + 402
03 + 2kl + Н О = + ЖОН + 02 — качественная реакция на озон
|
ПРИМЕНЕНИЕ 02 основано на его использовании как окислителя: в металлургии при производстве стали и чугуна 60 0/0 промышленного 02 для получения ННОз, Н SO«, обжига руд (например, FeS2, CuFeS2, PbS и др.) горение Н 2 + О — при сварке металлов |
|
В ПРИРОДЕ с участием 02 совершается дыхание — один из важнейших жизненных процессов. Наличие в атмосфере кислорода обеспечивает гниение органических веществ. Содержание гислорода в атмосфере постоянно, т.к. его расход компенсируется образованием кислорода - зи фотосинтезе: СО? + НР С (НР)т + О2 - (исление кислородом углеводов, жиров и белков служит источником энергии живых организмов |
5- Высокая ЭО атома О, большой дипольный момент
![]() молекулы,
прочные водородные связи приводят к н сильной ассоциации молекул (Н2О)п.
При 2000 п в среднем 4, при 100 0С п = 1 и 3 0/0
п = 2.
молекулы,
прочные водородные связи приводят к н сильной ассоциации молекул (Н2О)п.
При 2000 п в среднем 4, при 100 0С п = 1 и 3 0/0
п = 2.
Чистая водр не имеет вкуса, цвета и запаха, в тонких слоях — бесцветная, в толще — голубоватая. Наибольшая плотность при +4 0С — 1 кг/л, при 0 0 0 — 0.998 кг/л, так как согласно
одной из точек зрения Т 0 0 0, Т 100 00. Характеризуется высокой
теплоемкостью (4.13 кДж/моль • кг • К), высокой теплотой испарения.
Химические свойства:
Вода реагирует с простыми веществами:
|
О С щелочными и щелочноземельными, а при |
Са + ан о = + нат |
|
|
нагревании — и с другими металлами |
+ 4Н2О = Резо, + 4H2T |
|
|
ф) С галогенами Вода реагирует со сложными веществами |
2F2 + 2Н2О = 4HF + 02 Т + Н2О — нао + на |
|
|
О С оксидами основными |
СаО + Н 2 О = Сарн)? |
|
|
кислотными |
s03 + нр = н so |
|
|
(Э С ионными гидридами |
КН + На О -9 КОН + Н Т |
|
|
Э Образование кристаллогидратов |
NaOH + 2Hao ГЧаОН 240 CUSO, + CUSO, • 5Нао |
|
|
О Гидратация непредельных |
сна=сна + нр снзснрн (Н Ф ) о |
|
|
органических соединений |
СЊСН + Н 20 -9 |
(Hg2+) |
|
Э Гидролиз ионных и ковалентных (в том |
+ + нс: |
|
|
числе — органич.) соединений |
+ 4+420 нзро, + 5на о о снзс + нон снзс, + снзон |
|
|
Особые свойства воды: |
оснз он |
|
|
О Вода — катализатор |
2.Al + |
|
|
С) вода — очень слабый электролит: |
Н 2 О — НФ + ОН- |
|
В ЧИСТОЙ воде П И 220С НФ = [ОН- = 10-7 моль/л, рн = 7
Очистка: 1) От крупных частиц — фильтрованием 2) От растворенных солей:
временная жесткость — + = 2СаС0зЈ + 2Н20 или кипячением:
= сасозЈ + соа + нао постоянная жесткость — CaSO + NaaC03 = СасозЈ + NaaSO
З) От взвесей — добавлением солей алюминия или железа (Ш)
+ = + 3CaS04J + 3N4C03 + знр = + .3N*04 + зсоат
Рыхлые осадки мОН), 4) Обеззараживание — хлорирование или озонирование и Fe(OH), захватывают 5) В случае необходимости — дистилляция или деминерализация
примеси
(пропускание через катионит в Н+ форме и анионит в ОН- форме)
Пероксид водорода Н2О2 — жидкость. Обычно в фармакологии (антисептик) 396-ный
водный раствор или 3096-ный раствор в промышленности (пергидроль). Легко разлагается при хранении. при нагревании на свету. Разложение катализирует МпО2 2H20i = 2Н О + О
Получение: ва02 + Haso, = Baso,J + НР; H2S208 + 2Н2О -9 2H2S04 + Н2О2
пероксид надсереая r-va
Свойства: 1) Очень слабая кислота: Н 2 2О Н 4 + НОГ, соли — пероксиды Н2О2 + -9 Вао + 2Н О
2) окислитель: Н 0 -1 2 + 2kl + H2SO 4 = + к + 0-2
3) восстановитель: 5H О-' + ЗН SO + 2КМп04 = + 2Mnso, + + 500
Применение Н2О2 и пероксидов: отбелка различных материалов, хим. промышленность, з,ашение, медицина, поглощение СО : 2Na О + 200 -» 2Na СО + О
2
|
В природе: 0.01% массы земн. коры, 78.196 по объему атмосферного воздуха. NaN03, КГЧОз — селитры |
 +5
+5
Получение: О в промышленности — фракционирование хщцхого (Кт 02 = —183 • С, N2 = -1960
Ф в лаборатории — разложение нитрита аммония при нагревании:
NH4N02 = N2 + 2H20, NaN02 + NH4Cl = N2 + NaCl + 2H20
Физические: газ без цвета, запаха и вкуса, имические: молекула очень устойчива
= —196 00, плохо растворим в воде (2.3 мл в (прочная тройная связь, Е = 942 кДж/моль)
100 мл Н2О при 00С) низкая реакционная способность
Восстановитель: высокая температура (эл. дуга, 300000) N2 + О = 2NO —Q «замороженное» равновесие, продувка через разряд
Окислитель: при комнатной температуре — только с
И, при нагревании — с другими металлами Реагирует с водородом. При давлении 20—40 МПа, температуре 400—500 00 и в присутствии катализатора — желе-
6Li + N2 = 2Li3N нитрид
ЗСа + N2 = сазГЧ2
Р, t. кат
3Н2 + Н 2 2NH3 + а
за, активированного различными добавками.
Аммиак NH з
В промышленности: см. выше Н2 + 2 В лаборатории: нагрев солей аммония со щелочами или нагревание NH • Н О
(NH4)2S04 + 2NaOH = NaS04 + 2NH3T + ан О
резким запахом, хорошо растворим в воде (при 700 л в 1 л НР)
Химические свойства:
NH3 + Н+ = 4+ _ион аммония донорно-акцепторное взаимодейН ствие, присоединяет Н Ф —» ион
аммония
треугольная пирамида
Основание: при реакции с кислотами — соли NH3 + HCl = М-1 Cl хлорид аммония при растворении в воде:
+ Н о + + ОН— ИРЛОЧНаЯ Реакция
396 водный раствор — «нашатырный спирт»
Восстановитель: за счет N 3-, окисляется обычно до ГМ;
О + 8NH3 = N2T + 6NH4Br
Н О горение
02 + гчнз
НО + Н О стадия получения РЕкат.
з
э зсио + 2NH3 = гут + зси + знр (оксиды некоторых металлов)
Окислитель: за счет Ю:
2Na + 2NH3 -» 2NaNH2 + Н2 амид
ГЧН4+ — ведет себя как катион щелочного металла
Соли аммония хорошо растворимы в воде В водных растворах соли аммония существуют
в виде ионов:
(NH4)2S04 = 2ГЧН + + SO 2-
Разложение при нагревании:
О если кислота летучая, а анион
неокислитель: нагрев тетра5др
охлажд
(Э если кислота нелетучая, а анион — неокислитель, то происходит частичное разложение:
(NH4)2S04 = NH3T + NH4HS04
Э если анион — окислитель, то происходит окисление азота в ионе аммония:
ГЧН4ГЧОз = гчр + 2H20
(NH4)2CrP7 = + 41-1 О + СЪОЗ
Качественная реакция на ион НН4 — выделение аммиака при реакции солей аммония со
щелочами:
гчн а + ГЧаОН = нас: + гчнзт + нр
Аммиачная вода NH
Селитры NaNO , ПОЗ, МН НОз
Сульфат аммония (NH4)2S04
Карбамид (мочевина)
29или о-
строение молекулы азотной кислоты
Положительные степени охи ления
|
+0 Оксид азота ('), N20 Получение: МН НОЗ = N20 + 2+420 бесцветный газ со сладковатым запахом, заметно растворяется в Н О |
+2 Оксид азота Ш), НО Получение: в промышленности (стадия производства HNO ) pt 4NH3 + 502 = 4NO + ен О в лаборатории ЗСИ + 8HNO бесџетный газ, труд•ю сжижаемый, плохо растворим в Н О |
+0 Оксид азота (lll), N203 Получение: NO + Кислотный оксид со щелочами + 2NaOH = 2NaN02 + нр нитрит натрия HN02 — кислота средней силы. неустойчивая кислота диспропорционирует
2HN02 = Н О + гчоа + NO хранение окислительно-восстановтельная
двойственность 2Hl + 2HN02 = + 2NO + 2H20 восстановитель: 2КМпО4 + 6HN02 = КГЧОЗ + kN02 + ЗН О Соли азотистой кислоты — нитриты (kN0 , NaNO ) |
+0 Оксид азота (М), N02 Получение: 1. 2NO + 02 = 2N02 2. си + 4HN03 = + 2N02 + ОНЦ. 2 З. бурый газ +1400C бесцв. кристалл. |
+0 Оксид азота (И, N205 Получение: 1. 6HN03 + = 2Нзро, + 3N205 деги№атация HNOз 2. 2N02 + оз + оа бесцветные нестойкие кристаллы 2N20s = 4N02 + 02 |
|||||
|
несолеобразующий |
Кислотный оксид N205 + нр = 2HN03 |
||||||||
|
кислотный оксид |
|||||||||
|
>500 0 C — разлагается 2N20 = 2N2 + 02 поэтому окисляет вещества, реагирующие с 02 н 2 о + н 2 = Н 2 + н 20 2N20 + С = + 2N2 |
При растворении в воде — 2N02 + нр = нгчоз + HN02 со щелочами: 2N02 + 2NaOH = NaN03 + NaN02 + Н 20 сильный окислитель: N02 + СО = NO + соа N02 + soa NO + (нитрозный способ получения серной кислоты) |
сильный окислитель |
|||||||
|
несолеобразующий |
Азотная кислота HN03 Получение: В лаборатории NaN03 + Н;О, = NaHSO, + НГЧОЗТ В промышленности pt 1) 4NH3 + 502 4NO + 6H20 2) 2NO + 02 = 2N02 (при охлаждении) 3) 4N02 + 02 + 2H20 = 4HN03 (под давлением 02) |
||||||||
|
окисл тельно- восстановительная двойственность восст ановитель: 2NO + 02 = 2N02 2NO + = 2NOCl окислитель: 2NO + 2S02 = 2S03 + 2 в водном растворе: 2NO + 2H О + 2S02 = ГЫ + 2H SO4 |
|||||||||
|
Химические свойства HN03 сильная
кислота, окислитель: HNO |
Физические свойства Бесцветная жидкость, при —42 0 С переходл в кристаллическое состояние, с НР смешивается в любых соотношениях |
||||||||
си + 4HNOЩкт•ц.) = + 2N02 + 2H20 ЗСИ + 8HNO = + 2NO + 4H20 Зразб.) 4Mn + 10HNOЦразб.) + N20 + 5H О 4Zn + 10HNO+ NH,N03 + знр Щ*екь разб.) |
|||||||||
|
Неметаллы: окисляются до соответствующих кислот, HN03 N02 или NO (в зависимости от разбавления) |
|||||||||
|
Качественная реакция на ион НОЗ 2NaN03 + 3H2S04 + си = 2N02T + cuS04 + 2NaHS04 + 2+420 бурый газ |
|||||||||
|
р + 5HNOЩ«хи.) = нзро, + 5N02T + нр + 10HNO = + 10N02T + Анр Зкхц.) S + 6HNO - Haso, + 6N0 Т + 2H О |
1 объем НГЧОз + З объема HCl -» «царская водка» Аи + НГЧОЗ + 4HCl -» НО + ан О + H[AuCl4J |
|
|||||||
|
Нитраты И [илочные |
— хорошо растворимы в воде. Разлагаются при сильном нагревании. и щелочноземельные металлы Малоактивные металлы 2NaNO, О Т 2Pb(NO ) = 2Pb0 + 4N02T + 0$ 2AgN03 = 2Ао + 2N02T + ОД |
||||||||
|
|
|||||||||
|
|||||||||
ма ПОДГРУППА. м, Р, As, Sb, Bi. ФОСФОР Р
нет у азота
|
|
МН восстано- |
|
известны и другие степени окисления |
о неметаллы вительные р |
|
Фосфор: несколько аллотропных модификаций |
свойства As AsH |
|
Белый (желтый) фосфор, молекулярное строение Ра, tM |
металлы SbH |
|
440С, сильно ядовит, растворим в CSz, C2HsOH и др. |
ВЖ |
|
Окисление белого фосфора на воздухе сопровождается свечением. Химически активен. |
основность з |
|
Красный фосфор полимерное строение. не ядовиты, |
В природе: земн. кора 0.196. В свободном |
|
Черный фосфор нерастворимы в воде и органи- |
виде не существует. Фосфорит |
|
ческих растворителях нагревание, лов. давление |
фторапатит — • CaF2 и др. |
|
Белый фосфор Красный фосфор |
Получение: + 10C + 6Si02 — |
|
нагревание. пониж. рвление |
10СOТ + 6CaSiO + Р Т (электр. печь) |
Химическая активность фосфора значительно выше, чем N2 восстановитель: 502 + 4P = 2P205 30 + 4Р = 2Р2Оз (недостаток 02)
+ 2P = 2PCl5 312 + 2P = 2Pl
ЗР + 5HN03 + 2H20 = ЗНзРО4 + 5NO 2P + 5CuS04 + 8H20 = 5H2S04 + 5Си + 2Нзро4
окислитель: 2Р + 3Mg = Мо Р (фосфи магния)
—3 менее соединения стойчивыс водородом чем ГМ— +3 более кислородные устойчивы, соединениячем у N +5
фосфиды: СазР2 раз, Р20з соединения фосфора в этой степени ЗСа + 2P = сазР2 Образуются при недостатке окисления наиболее устойчивы, фосфин: РНз окислителя поэтому свойств не проявляют окислительных сазР2 + 6H20 = + 2РНзт 2P + заа -» па Р О — белый порошок, получают фосфин — ядовитый газ, бес- 4P + 302 = 2Р20з сгоранием Р в избытке О • цветен, плохо растворим в НР, кислотный оксид Р2Оз: 4P + 502 = 2P205 нестоек. 4NaOH + Раоз = 2ГЧа2НРОз + нр сильное водоотнимающее
РН — более слабое основание, Раоз + знр = 2HsP03 действие чем ГЧНз двухосновная фосфористая 6HN03 + = 2НзРО4 + 3N20 рнз + Н! = — в воде соли кислота средней силы кислотный оксид фосфония полностью гидроли- ЗВаО + = зуются. 6NaOH + Р205 = + ЗН О
РНз — сильный восстановитель при растворении в Н О
РН- + 202 = нзР04 р 205 + Н 20 (HP03)n соли — фосфиты (Naaнеоз и др.) метафосфорная кислота П24 восстановитель: + 2H20 = 2H4P207
Р20з + О2 = р 205 пирофосфорная кислота
Ортофосфорная кислота — кислота средней силы, окислитель-сй силы за счет Р(+5) не имеет.
• эяда солей: средние фосфаты (КзРОа, и др.); гидрофос-
:a-s (СаНРО4, К2НРО4) и дигидрофосфаты кнаР04 + нр = 2Нзро4
Средние фосфаты, кроме фосфатов щелочных металлов, в ортофосфорная или просто
-еоастворимы.
• РО з- + Н ОН- + НРО 2-
•—ест=нная реакция: в нейтральной среде ЗАО * + РО 3 - = АО т:м:•.: харк
— .слотый фосфорит, «фосфоритная мука» — нерастворим в воде
+ гн SO = са(Н Р04)2 + 2CaS04 —
+ 4НзРО, = — двойной суперфосфат
+ Н РО = СаНРО + 2Н О — преципитат, нерастворим в НР,
растворим только в кислых почвах
ЗГЧНЗ + 2НзРО4 = ГЧН4Н2РО4 + (ГЧН4)2НРО4 — аммофос
+ соль К — аммофоска
фосфорная кислота
хон
— легко гидролизуется: PC15 + 4Н2О НзРО4 + 5HCl
В промышленности:
+ 3H2S04 = 2НзРО4
3CaSO •Ј экстракционная фосфорная кислота
|
IVa подгруппа. УГЛЕРОД С
Физические свойства: 4 аллотропные модификации алмаз графит карбин фуллерит ФЗ-гмбридизация, Фа- гибридизация, sp- гибридизация состоит из фуллеренов Сю, тетраэдрические о- слоистая структура. Сто и р., имеющих форму связи прочные, большое расстояние и непроч- сферы или сфероида. Растворим в орг. =с=с=с=с= ковалентные, ные связи между слоями, растворителях. Получают при испарении поэтому очень поэтому мягкий. Хорошая линейный полимер, графита в атм. Не и др. меторми. тверд. Изолятор. р электропроводимость. твердое вещество = 3.51 г/см з р = 2.22 Химические свойства
получение нагревание без малоактивен, на холоду реагирует только с F2 CF4
доступа воздуха восстановительные е слабо выражены окислительные
С +0 = соа — ниже 1 ) Са + 2С = СаС2 карбид кальция древесины каменного 2) С + Н О = СО + на выше (др. способ СаО + ЗС = СаС2 + СО) С + 2H О = соа + 2H2 ок. З) СИО + С = Си + СО при нагревании Самый чистый С (сажа): 4HN03 + ЗС = 3002 + 4NO + 7-420 2) 2Н + С = СН4 и др. углеводороды крекинг метана |
Углеводороды (СНО С Н Оксид углерода (ll), СО угарный
СбН6 и др.) газ донорно-акцептор-
Карбиды — получают при непо- :сео: ное взаимодействие средственном взаимодействии С с высокая прочность связи, 1080 кдж/моль.
металлами, или оксидами металлов. Бесцветный газ без запаха, ядовит, т.к.
2 группы карбидов. соединяется с гемоглобином крови. Плохо растворим в Н О.
Получение: характера — карбиды переходных + с = 2с0 нагревание без
соа металлов (F%C и др.). Электронная с + нр = со + н доступа воздуха проводимость, металлический блеск, в лаборатории:
хим. инертность, термостойкость. действие конц. HiSOa на НСООН или Н2С2Оа ll Ионные карбиды — более муравьиная к-та НСООН = СОТ + Н О
электроположительные металлы. щавелевая к-та Н С О = СОТ + СО + Н О
Бесцветны, прозрачны, не проводят восстановитель электрический ток, полный гиролиз:
1) + 12H20 = 4АЦОН)з + Регоз + ЗСО = 2Fe + ЗСО Т
ЗСН$ (ВеаС) хо + 02 = +
2) саса + 2H20 = + СО + C12 -» СОСЦ — фосген (свет, катал.) санат несолеобразующий, но при 200 0 C
(Na2Ca, к,са, srq, васа, сира, „о
МР2Сз и др.) СО с +элементами образует ОГЧа прочные
При гидролизе — ацетилен С Н и др. комплексы — карбонилы Сог(СО)
пропин СзН, и др.
соли качественная реакция
«вскипание“ (сильная кислота) карбонаты гидрокарбонаты
1. сасоз + 2HCl = саза + СО Т +растворимы в Н 20 — хорошо растворимы,
только щелочных и NH + неустойчивы
2. СО вызывает помутнение (кроме наНСОз),
сильный гидролиз известковой и баритовой воды
+ сог = сасоз$ + нр 2NaHC03 = NaaC03 + нао + соа
возможно растворение осадка:
карбонаты щелочных сасоз + н о + СОДизбыток) = разложения, остальные металлов карбонаты плавятся при нагре-без
вании разлагаются:
>9000С
СаСО сао + со Т
З
Оксид углерода (lV) СО2
0=С=о углекислый газ неполярная, линейная молекула. Без цвета и запаха, растворим в НР (880 мл в 1 л НР). При давлении 50 атм сжижается. -760С — «сухой лед» Получение:
в промышленности — обжиг известняка, конверсия метана и др.
в лаборатории — вытеснение сильной
сасоз + 2на = саза + со Т + н о Окислительные свойства выражены слабо. Обычно соа не поддерживает горения. Только при высоких температурах реагирует с металлами, сродство к кислороду которых больше, чем у С тио + сог = тисо + с Кислотный оксид. при
растворении в Н О образуется небольшое количество слабой угольной кислоты соа + н о нр д=нгсоз
он в свободном виде о=с
— неустойчива он
Получение солей угольной кислоты:
соли угольной кислоты — карбонатн и гипокарбонаты
1) 2NaOH + СОГ = ГЧагСОз + Н О
NaaC03 + Н О + соа = 2ГЧаНСОз (изб. СОД
|
металлы размер атома, |
2)
СаО + COZ сасоз З)
Обменная реакция ваза + на СОЗ = васоз$ + 2NaCl КРЕМНИЙ ![]()
кристаллический — темно-серый, алмазо- «аморфный» кремний — подобная структура, ФЗ-гибридизация, высокодисперсный бурый порометаллический блеск, полупроводниковые шок, более реакционноспособен, свойства. Химически инертен. Плотность чем кристаллический
2,33 г/смз , 1415 0 С
легкость отдачи е
В природе: 2-е место по распростра-
ненности (27.6% массы земной коры). Кремнезем — Si02 (песок, кварц). Силикаты и алюмосиликаты.
NaAlSi308 полевой шпат
|
+4 Si02 — оксид кремния (lV), существует в нескольких кристал- —4 кремнииводороды лических модификациях, тугоплавок, инертен, но реагирует с HF: (силаны) SiH4, Si2H6 и др. 4HF + Si02 = SiF Т + 2H О Получают из силицидов: 6HF + Si02 = + 2H О + 4HCl = 2MgC12 + Кислотный оксид: SiH4T сплавл. Горят на воздухе: 2NaOH + Si02 Na2Si03 + НР SiH + 202 = Si0Q + 2H О сплавл. силициды: MgaSi, Ca2Si и др. + Si02 + (более летуч) Окислительных свойств SiO Высокодисперсный SiOz, образующийся при горении кремнийводородов, измель- 2 чении горных пород и ф. опасен, т.к. при попадании в лёгкие вызывает силикоз. не проявляет, исключения (при сильном нагревании): Силикаты — соли кремниевых кислот. Силикаты Na, К растворимы 2Mg + Si02 = 2MgO + Si в воде. Их называют жидким стеклом (силикатный клей). ЗС + = SiC + 2C0 Сильный гидролиз (кремниевые кислоты — оч. слабые) 2NaaSi03 + + 2NaOH Кремниевые кислоты метасиликат соли поликремневых nSi02 • тн О: натрия кислот — диметасиликат На и т.п. Н SiO — ортокремниевая Кремниевые кислоты слабее угольной: Н SiO — метакремниевая NaaSi03 + 7-420 + 2002 = 2NaHC03 + H2Si03J H2Si205 — диметакремниевая, и т.д. |
|
Нестойкие при нагревании: Цементы: прокаливание во вращающихся печах, в газовом Н Si03 = Н О + Si02 — образупламени смеси глины A1203 • xSi02 • уН2О, известняка СаСОз и др. ется силикагель (развитая поверхобычный цемент (СаО, Si02) портланд-цемент ность — адсорбент, осушитель) СаО + С02 + нр = СаСОзЈ + смесь Ca3SiOs, з—тывние — за счет СО из воздуха Са 504, Са (A103)2 ИФ. Стекло: Na2C03 + Si02 + СаСОз t0 C, схватывание — за счет гидратации сплавление, обычное оконное стекло Са SiO + Н О = Ca2Si04 + На-О • СаО • 6502 Ca2Si04 + О = Ca2Si04 • 4H20 замена части СаО на РЬО — хрустальное + 6H20 = • зало |
|
сравнительно инертен, реагирует преимущественно с сильными окислителями или восстановителями, как правило, требуется высокая температура: как восстановитель: Si + 2F = SiF4T (при комнатной температуре) Si + 02 = Si02 Si + 202 = SiCl4 400+6000С Si + 2NaOH + Н О = NaaSi03 + 2Н2Т при нагревании С + Si = SiC (карборунд, очень тверд) 2N + 3Si = Si3N4 (>10000C) как окислитель: 2Са + Si = CaaSi силицид кальция во многих металлах Si заметно растворяется без химического взаимодействия |
Получение: 1 восс Si02 + С Si + 200 SiH 2Mg + Si02 = 2Mgo + Si |
А!2Оз • xSi02 • уН2О глины и мн. р.
[Ar13dS4s1 3d5 В природе:
|
|
|
||||||||||||
в земной коре 8 10 -3 масс. % Cr
Важнейшие минералы:хромит FeCG04
устойчивость полузаполненной мангохромит d- подоболочки
|
Получение: 1) Электролиз растворов солей 2) Алюминотермия: CG03 + 2Al - — A1203 |
Физические свойства: голубовато- серебристый металл, плотность 7,2 г/см з , t 1890 0С, хрупкий. На воздухе устойчив. |
Химические свойства:
металл средней активности, в электрохимическом ряду — ...и Сг ре... Н покрыт плотной защитной пленкой CG03 и поэтому довольно инертен с простыми веществами: со сложными веществами:
При обычных условиях реагирует только со F . Cr реагирует с кислотами — неокислителями
При нагревании — с Cla, Bra, S, 02 и др.: Сг + 2на = crC12 + н2
2Cr + 3Cl = 2CrC13 красное каление Ст + Н 2 SOЧра%.) = CrS04 + Н2 с конц. и разб. НМ)з, царской водкой — не реагирует (пассивация)
(У + 6СО = (образование карбонила)
Соединения малоустойчивы, легко окисляются
Получение: СЮ — основной оксид. сг + = crS04 + нат — основание средней силы:
Сг + 2на crC12 + н2 crC12 + 2NaOH = + 2NaCl (желт. осадок) В растворах быстро окисляются до Cr(+3): Соединения Cr(+2) — сильные восстановители 2CrC12 + 2на = 2CrC13 + на
|
Оксид Cra03 CG03 + ЗН SO = + ЗН О Окислительно-восстанови- |
|
|
— тугоплавкие темно-зеленые сплавление: CG03 + 2NaOH = тельная двойственность |
|
|
кристаллы, практически не рас- 2NaCr02 + Н О |
|
|
творимые в воде, кислотах, |
раствор: (У2Оз + 6NaOH + ЗН О = окислитель: |
|
растворах щелочей. |
2CrC13 + zn + = 2crCl2 + |
|
Получение: |
СЬОз, прокаленный при высоких + znS04 + 2на |
|
сжигание Cr в 02 , |
температурах, не реагирует ни с |
|
нагревание CrO • |
кислотами, ни с основаниями. восстановитель: |
|
4Cr03 = + 302, |
Гидроксид амфотерен: 2NaCr02 + 3Bra + 8NaOH = |
|
разложение (NH4)2Cr20; |
+ зна = crC13 + ЗН О 2Na cr04 + 6NaBr + 4-420 |
|
(NH4)2CrP7 = N2T + 4-4 ОТ + сг О |
+ 3NaOH = В воде хромит-ионы зеленого цвета. |
|
Полученный при невысоких |
Ионы СР+ гидролизуются: |
|
температурах (У2Оз амфотерен |
|
|
+6 Оксид Cr03 |
Равновесие Сильные окислители |
|
кислотный оксид |
хромат е» дихромат определяется РН |
|
легкоплавкие темно-красные |
kzcr207 + ина = жа + |
|
кристаллы. Легко растворя- |
2k2cro, + ана = + жа + нр 2CrC13 + за Т + ин о |
|
ются в воде с образованием |
желтый хромат оранпвый дихромат калия алия 2Cr03 + ЗН S = СЪОЗ + |
|
существующих только в |
kzcr207 + ЖОН = + нао ЗН О + 3S |
|
растворе кислот: |
хроматы канцерогенны! + S = сгрз + k2S0, |
|
Cr03 + Н О = Н Cr04 — |
Получение CrO • |
|
хромовая к-та |
К СГ О + 2Н $О4(конц. избыток) = Качественная реакция |
|
2Cr03 + нр = Н cr207 |
2cr03J + 2kHS04 + нр СГО 2 - + ва 2 + = BaCrO |
|
дихромовая к-та |
желтого цвета |
ПРЕДЕЛЬНЫЕ
п 2п+2
СН4 — метан С Н — пентан
5 12 сане — этан С Н14 — гексан
СзН8 — пропан С7Н16 — гептан
С4Н10 --бутан С8Н18 — октан
Возможна изомерия углеродного скелета:
Изомеры — соиинэния, одинаковье по составу и мотекулярной массе, но —с—с—с—с— —с—с—с— различающиеся по строению или расположению атомов в пространстве (по свойствам).
соединения, состоящие из С и Н, в которых все связи атомов С, не затраченные на образование одинарных связей С—С, насыщены атомами Н
Номенклатура: сначала выбирают самую сн длинную цепь. Название:
5 6 N' . заместителя— нзс-сн-с-сн-сна-снз заместитель—цепь.
снэ снэ Например, 2,3,3,триметил-4-этилгексан С 1 ,С6 — первичные, (У — вторичный, (У С4 — третичные, сз — четвертичный атомы углерода
н- бутан
2-метилпропан
(изобутан)
Физические свойства: СН4 — бесцветный газ, = -162 0 С. С -С4 — газы; Cs-C 15 — жидкости
(при обычных условиях), далее — тв. вещества. t предельных углеводородов с неразветвлен-
кип
ной цепью выше, чем у соответствующих углеводородов с разветвленной цепью.

Химические свойства: связи С—С и С—Н прочные, характеризуются низкой поляризуемостью, поэтому свободнорадикальный механизм реакций: СН :Н СН
Реакции свободнорадикального замещения (свет, нагрев):
hv
СН4 + Cl2 -» CH3Cl + НС!
хлористый метил
о со СНзС| + C12 —» CH2C12 + НС!
1 хлористый метилен о хлороформ СНС|з четыреххлористый углерод CCl
Механизм: С! • + Cl • сн4 + а, снз. + на
СН • + C12 -» СН СЛ + С! • и т.д. до обрыва:
а, + снз• снза или а, + а, эа2 ____.v СНзСНВгСНз 9096
для гомологов снзСН2СН2Вг 1096 третичный > вторичный > первичный Нитрование (реакция М.Н. Коновалова):
С 6 Н 14 + HNO —» C6H13NO + Н2О (т-ра выше 4000С) Дегидрирование:
С4Н,о —» С4Н8 + Н 2 (ГМ-катализатор, 360 0 0)
Получение (природный газ, нефть):
Без изменения числа атомов С:
1. сна=сн + н снз-снз 2. сн + -» сна
з 4 или с увеличением числа атомов С:
З. Реакция Вюрца сане П + 2Na + + 2Nal
С уменьшением числа атомов СГ
о
![]()
ONa
5. Синтез из СО и Н : СО + Н 2 -» смесь углеводор. + Н О 6. Электролиз растворов солей карбоновых кислот (Кольбз)
2СНзсоо- -22 2С02 + СНЗ-СН
![]()
|
окисление |
С—С-связь |
|
1. Горение СН + 20 2 - |
Крекинг |
|
СО2 + 2Н2О |
От англ. to crack — расщеплять — нагревание нефти и нефтепро- |
|
смеси с воздухом |
дуктов без доступа воздуха, |
|
взрывоопасны |
приводящее разрыву связей |
|
2. Каталитическое |
С—С и образованию продуктов с меньшей молекулярной массой. |
|
окисление (промыш- |
1500ос |
|
ленность) сн |
2 сн нс=сн + н 1 зооо с 2 |
|
Гомологи — с разрывом С-С |
04 Н 10 С2 н 6 + Сан 4 |
|
связи: |
смесь продуктов — разветвленные, непре- |
|
снзсн снаснз -» 2СНзсоон + |
дельные. |
Н 20 соед Мп получение уксусной кислоты
Циклопарафины: углеводороды, в которых атомы спнап С образуют цепь (цикл), связи
насыщены атомами Н
Названия: цикло + алкан
снэ сн
з
метилциклобутан транс- 1 , 2-диметилциклопропан
Изомерия: углеводородного скелета + пространственная Химические свойства: подобны парафинам. Характерно свободнорадикальное замещение. Следует отметить:
1 . Для циклогексанов — легкая дегидрогенизация снэ снз
2. Легкое разрушение 3-4-членных циклов:
2
ВГ-СН -СН -СН2Вг
|
НЕПРЕДЕЛЬНЫЕ (АЛЕНЫ, ОЛЕФИНЫ)
спнап Номенклатура: системемчесхая (ИЮПАК) 2 группу
СНа=СНИзомерия: углеродного скелета, положения
винилциклогексан Строение: *-гмбридизация, к: 1200 . 2р-электрона соседних атомов С образуют х-связь вне линии о связи С С. Поэтому нет вращения вокруг связи С=С. легкость электрофильного с со э с присоединения с П-СВЯЗЬ более реакционноспособна, чем о-связь |
Горение:
сан, + 302 -» 2002 + 2H о слабо коптящее пламя
Реакции присоединения по связи С=С 1. СН + ВГ2 -» ВсСН2СН ВГ 1 , 2-дибромэтан протекает легко — обесцвечивается бромная вода
2. СН =СН-СН + HBr -» снгсн-снз
Н Вт
Правило Марковникова: атом Н из ННа| присоединяется к атому С с наибольшим числом атомов Н Причины:
О сдвиг электронов в несимметричной молекуле к С=Ссвязи, т.к. электроотрицательностъ С > С 2 С з
СН -»СН=СН2 место атаки H—Br
Ф) большая устойчивость промежуточного карбокатиона
снз-сн=сн
О
[снз-снг-»снг] первичный < вторичный < третичный
З. Полимеризация (соединение молекул руг с другом): псн2=СН2 -» (-снгснг)п — полиэтилен
п — степень полимеризации
4. Гиратация СНа=СН + Н О СНз—СН —ОН
оос, н so,
5. Окисление протекает легко:
ЗСНГ=СН + ТИПОГ + 4-420 -» ЗСН -СН + 20H- + ТИПО
он он
обесиречивание р—ра — качественная реакция на двойную связь
6. Гидрирование
СНг=СНГ + на -» СНз-СНз
(ги№огенизация) М или Pt
Реакции соседней с С=С связью группы Активация С=С связью соседнего радикала. Энергия связи С—Н в пределах —380—420 кДж/моль, а у соседней с С=С =320 кДж/моль Возможно:
5000C о снэсн= + НС!
О , кат. о
сн сн= СНГ С Н —С • + Н 20
Получение:
О при крекинге нефтепродуктов:
c,sH32 + снзсн=СН2 + сн2=сн2
этилен содержится в газе, выделяющемся при коксовании каменного угля
Э дегидрогенирование предельных углеводородов:
С2Н6 + Н2 О из спиртов — дегидратация:
|
Н ОН |
150- поо с н с=с- + нао Н 2SO
Э из моногалогенных производных:
кон Н Н
З 2 спирт с=с + + Н 20
Н Н
Отщепление Н происходит прежде всего от наименее гидрогенизированного атома С (правило Зайцева). М.б. использовано для перемещения С=С связи по цепи.
О из дигалогенпроизводных:
Zn пыль
сна-сн2 СН2=СН2 +
непредельные углеводороды, содержащие 2 двойные связи С=С

![]() секс=сн-снгснз
Наибольшее практическое значение имеют 1,3диены с сопряженными С=С связями
(группами
секс=сн-снгснз
Наибольшее практическое значение имеют 1,3диены с сопряженными С=С связями
(группами
ПОЛИМЕРЫ: Высокомолекулярные соединения, молекулы которых состоят из большого
числа повторяющихся группировок
(мономерных звеньев) ![]() + снгсн-сн=сн2
+ снгсн-сн=сн2![]()
злементарное звено мономер полимер —дивиниловый каучук степень
1930-1931, С В. Лебедев полимеризации
Полимеризация: Процесс синтеза полимера путем последовательного присоединения молекул низкомолекулярного вещества (мономера) к активному центру, находящемуся на конце растущей цепи.
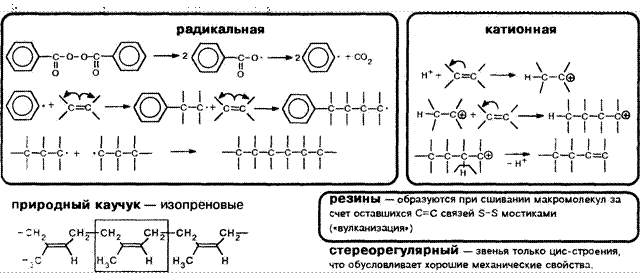 стереорегулярный — звенья только
цис-строения,
стереорегулярный — звенья только
цис-строения,
|
|
Для искусственного получения — специальные катализаторы |
|
промышленные каучуки (сополимеры) |
(к.Циглер, Д. Напа) |
|
стирол |
кат |
|
СН=СН2 бензо-маслостойкий |
снз. |
|
|
CN |
сн-снгснз
|
|
|
акрилонитрил |
СН кат сир |
|
![]() сн=СН2 A1203.
сн=СН2 A1203.
автомобильные шины
резиновые изделия снзснаснгснзкат ![]() + 2Н2 сив
+ 2Н2 сив
снз
непредельные углеводороды, содержащие тройную связь СЕС
 Систематическая (WOt1Ak) Иногда используют рациональную
Систематическая (WOt1Ak) Иногда используют рациональную
|
Строение: |
Для атома С в алкинах характерна Z 180 0 . Группа —СЕС— имеет линейное строение. Длина связи СЕС 1,20 А, что короче, чем связь С—С (1 ,54А) или С=С (1 ,ЗЗ А). Л-СВЯЗИ образуют компактное облако, поэтому в некоторых реакциях присоединения СЕС связь мало реакционноспособна. |
Горение: ацетилен С2Н2 горит коптящим
пламенем (много углерода). При вдувании 02 — ослепительно белое пламя (до 2500 00). Смесь С2Н2 и 02 взрывоопасна.
протекает ступенчато ВГ
ВГ
Вг-во№ AlC13 ВГ ВГ
н-с=с-н + на нгс=сне: + нс! нзсасна2
ПВХ — пластмасса по правилу
э н-с=с-н + нр 2» ур=снонј спирт -» С утсусный Н 3 —С Н Марковникова
2+
но виниловый альдегид
Реакцию Кучерова используют в промышленности
Присоединение НР, НС! и др. происходит по правилу
Марковникова: Н СНЗ-С•Ч + ;-ЧО 2+ снз-с=СН2 СНЗ-С-СНЗ
но
он о енол ацетон
О Н-С=С-Н + на -ћН2С=СН2 + на НЗС-СНз
О полимеризация
1 осс
а) тримеризация —» акт. уголь бензол
|
димеризация —» присоединение HCl по тройной связи (пр. Марковникова) |
|
-сн=сн |
б)
п
хлоропрен хлоропреновый каучук 2-хлорбутадиен-1 ,З
О окисление
о
|
сан |
о |
|
|
кмп04 сгон |
он |
2 |
р—р о обесцвечивание Р—ра щавелевая муравьиная перманганата к—та к-та (качеств. реакция)
Реакция С—Н связи, соседней с группой СЕС Сильное влияние СЕС связи на свойстеа связанного с ней атома Н. Т.к.
углерод сильно ненасыщен, электроотрицательность С > С 2 > С з, наблюдается сдвиг электронов СЕС—Н. Поляризация связи С—Н приводит к появлению кислотных свойств. При пропускании НС=СН через аммиачный раствор солей Си+ и Ag+ обра-
зуется осадок: несн + + ТЫН + М = Си+, Ag+ и др. Ацетилениды М С после высушивания взрываются
Получение:
25000С
карбид кальция
саса + 7-420 = + НС=СНТ
1 воо ос
20-44 нс=сн + зн2
О из дигалогенпроизводных:
—НС1,
хлористый винил NaOH нс=сн или
спиртовой р-р
clH2c-cH2a + жон НС=СН
+ жа + 2H о
ор: соединения, в состав КОТОРЫХ входит одно или нисколько Оензольных ядер
бензол нафталин антрацен
|
Изомерия: заместителей и их положения снэ снэ снэ снэ снэ сн з этилбензол орто-ксилол мета- ксилол пара- ксилол |
бензольные кольца сконденсированы
Строение: $ 2 -гибридизация, каждый атом С образует З б-СВЯЗИ, Z 120 0 , плоская молекула. б л-электронов образуют единую лэлектронную систему. Длина связи 1.39А В результате при образовании молекулы СЕН 6 выделяется теплоты на 150 кДж/моль больше, чем ее выделилось бы при наличии в СБНБ трех С=С связей. Ароматическая система характеризуется высокой устойчивостью.
Горение: бензол и его аналоги (толуол и др.)
горят сильно коптящим пламенем
Реакции замещения происходят в присутствии катализаторов (АС|з, FeBG), которые вызывают поляризацию молекул:
2 FeBr3
сн
З
снЗ + СНз-сн=сн2 82 S04 сн
сн з
нитрование
+ H0•.NO нао
Реакции присоединения
+ ЗН2
н
УФ-свет
Н
Протекают в жестких условиях, т.к. происходит разрушение устойчивой ароматической системы Получение:
1 . Содержатся в некоторых нефтях
2. Дегидрирование зооос
З. Тримеризация ацетилена
акт. уголь
|
Реакции заместителей, связанных с кольцом снаснз о кип ячение он р—р КМпО4 бензойная к—та з терефталевая к—та снэ сну снвъ |
![]() 1: ОДО-
нгчоз, 100'С
1: ОДО-
нгчоз, 100'С
З N02 02
орто-, пара-ориентация
о орто-, пара-ориентанты: ОН, РЫН 2, R, На|, 0R
02N мета-ориентанты: NO 2, S03H, СНО. СООН Толуол легче, чем бензол, замещает Н на На: в кольце в присутствии катализатора. СНз-группа легче, чем СНО бромируется на свету и может быть окислена кипячением толуола с КМпО4
|
|
Некоторые спирты имеют исторические названия: C2HsOH — винный, глицерин бутанол-2 |
Номенклатура систематическая (номенклатура ИЮПАК) название углеводорода + ол (с указанием № атома С), диол, триол и т.д. снз-сн-с»-снз СНа-СН2-СН2 он он он пропандиол-1 (вторичный нормальныи бутиловый спирт) |
|
Физические свойства: спирты с числом атомов С < 15 — жидкости, далее — твердые вещества. В спиртах наблюдается значительная ассоциация молекул за счет образования водородных связей |
спирты органические соединения, содержащие одну или несколько функциональных гидроксогрупп ОН для предельных одноатомных спиртов общая формула С п Н 2n+1ОН
![]()
Реакции с участием ОН-группы и Н-атома
|
Реакции с у•астием водородного атома группы ОН Т.к. О-н связь поляризована — некоторая кислотность О 2ROH + 2Na = 2RONa + нат алкоголяты — тв. кристаллич. вещества мрол из Ф Н 50 На + Н 20— + НаОН т.к. +420 — более сильная кислота, чем смрт алкоголяты нельзя получить действием раствора щелочи на спирт снз Кислотность: увеличивается с увеличением снес —»он « СЕзеСеОН поляризации ОН- групп снз трет. -бутанэл мрфтэртрет . -бутанол реакция тарификации (с кислотами) 82S04 о образ. снзсоон + носнЗ гидролиз сложный эфир КОН
неорганические кислоты ВОН + HOS020H— + Н 20 кислый серной «слоты ВОН + H—OS020H + НОВ R-O-SOa-O-R + 2H20 средний диалкялсульфат |
Отщепление ОН-группы — соседнего или ближайшего
Н*04 влияние -ОН группы: повышение подвижности и
ROH + + Н2О реакционной способности Н с-с-»он
отдельные члены гомологического ряда О окисление спиртов (отщепление 2-х Н и окисл. их в Метанол СНз0Н — особенность — деги№атация с не, увелич. % 0) КМпО„ каСГ207 + Н кат. си, Pt образованием таетилового эфира СНз—О—СН н он
0Полванио в промышленности: СО + 2Н Е$•СН ОН + (О] О
СН3
Этанол сан,он — растворитель, сырье для бутадиена н н ан
Получение: ферментативное брожение сахаристых в—в: альдегид сепаичцый -» альдегид
С Н О +
6 12 6 н
м№атация этилена: СН =СН2 + Н О СН ОН он О
Этиленгликоль, глицерин — многоатомные спирты. Взаимное влияние ОН-групп. Как следствие, увеличение подвижности з з ацетон З атомов Н — растворяют свежеосажд. Си(0Н)2 щпи.уцый кетон
тех..ц.чцы.в — окисляются с трудом — разрыв связи С—С с получением синеФ раствора глицерата меди.
Аналогично с этиленгликолем дегидратация — нагрев + H2SO4 (кощ.}' A1203
Получение: из галогенпроизводных Н СН2=СН2 + Н2О 1400 С
Н ОН
2 нас! +H20 Н2ОН + СНз—СН Т 1400С
сна снас: -2HCl нон избыток сгмрта
1 ,2-дихлорзтан вторичные — отщепление Н от атома с min Н (правило Зайцева), но простые эфиры также образуются
Получение: СН3 Н—СН3 + Н2О
бутен-2
NaOH ОН Н
С Н С п Н 20+1ОН hv п 2n+1 Н О
сна=сн2 + н20 третичные — в основном непредельные углеводороды, т.к.
H2S04 образование эфира затруднено стерическими причинами
Производные ароматических углеводородов, у которых функциональная группа ОН присоединена непосредственно к углеродному атому бензольного кольца
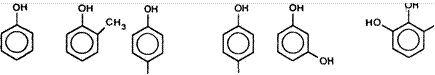 он
он
снз он
![]() фенол о- крезол п-крезол гирохинон
резорцин пирогаллол одноатомные фенолы двухатомные фенолы трехатомный фенол
фенол о- крезол п-крезол гирохинон
резорцин пирогаллол одноатомные фенолы двухатомные фенолы трехатомный фенол
Физические свойства: простейший представитель — фенол. Бесцветное кристаллическое вещество (тпл = 42'С) с характерным запахом (карболовая кислота), Темнеет, окисляясь на воздухе. При комнатной температуре — малорастворим в НР. При 60'С — растворим в любых соотношениях. Ядовит.
Строение: ОН-группа связана с ароматическим радикалом (фенилом).
п-Электроны бензольного ядра вовлекают неподеленные электроны
атома кислорода ОН-группы в свою систему
Реакции с участием ОН-группы
Возрастает полярность связи ОН и
подвижность атома Н (т.е. кислотность) Фенол — более слабая кислота, чем Н2СОз пли Н S (не окрашивает лакмус в красный цвет), но более сильная, чем одноатомные спирты
он ОГЧа
о 20 + 2N—20 + Н2
фенолят На
Ф он она
необходим
![]() + NaOH + н О избыток гиполиз щелочи
твердый растворяется
+ NaOH + н О избыток гиполиз щелочи
твердый растворяется
Феноляты разлагаются слабыми кислотами:
ONa он О О + NaHC03
Э образуют простые и сложные эфиры
Получение:
О кумольный способ (наряду с ацетоном) оон снз—сн-снз снэ с-снз
650С
H2S0a
кумол гироперекись кумола снз-с-снз
О
Реакции с участием бензольного кольца
т.к. возрастает электронная плотность в кольце — облегчается атака кольца частицами, испытывающими недостаток электронной плотности — электрофилами — реакции электрофильного замещения:
|
О он |
ВГ |
он |
он |
|
О |
|
О |
1 ) |
( водн.)
трибромфенол (тв. в=во)
он он
02N НО2
+ 3HNO О тринитрофенол з разбавл.
H2S04
N02
Э фенол + формалиегид (поликонденсация)
он он
5О О
смесь орто- и пара- изомеров он он он он О О о 20 + Н 20
|
ОН |
он |
он |
он |
|
|
О |
сн О н «щелочное плавление“ о S—ONa |
ONa |
|
СН20н |
|
|
о + 2NaOH |
+ Na2S03 + н о |
||
ГЧа-соль бензолсульфокислоты
41
|
АЛЬДЕГИДЫ И КЕТОНЫ |
Номенклатура: исторически сложившиеся |
систематическая номенкла |
||
|
спнапо |
органические соединения, имеющие в |
|
названия |
тура ИЮПАК |
|
альдегид в переводе на русский — |
своем составе карбонильную функци- |
альдегиды о |
от соотв. кислот |
углеводород + «аль» |
|
спирт, лишенный водорода |
ональную группу (карбонил) |
снз—с• |
уксусный альдегид |
этаналь |
|
сна „ о альдегиды |
изомерные соединения, также возможна |
кетоны |
названия радикалов |
углеводород + «ОН» |
|
кетоны |
изомерия углеводородного радикала |
о |
+ кетон |
|
|
|
|
снз—с' сна-снз |
метилэтилкетон |
бутанон-2 |
Строение: характерные химические свойства определяются наличием поляризованной двойной связи . для альдегидов характерны реакции
о о
” прочность связи С=О присоединения к группе С=О молекул воды, спиртов и др.
сн
|
Окисление для альдегидов характерна реакция с=о «серебряного зеркала»: с=0+ с=о + нао + зннз + 2АоЈ 4 муравьиный альдегид окисляется до СО • нок С = О Н 20 + СО 2 Т + 2Аој реакция с гидроксидом меди: снэк с=о + сиаоЈ + 2Н20 красн. осадок кетоны окисляются только сильными окислителями (k2Cr О + Н S04), причем происходит разрыв С-С связей: сн с=о + .3(01 снзсоон + нсоон соа + н о с4з |
Реакции с участием ос-Н-атома
Присоединение по с=о НЗС-С —С ' - увелтение подвижности а-атома Н
1 Восстановление на
о о
снэк сн н СНз—С' + +
2 мораль
химически очень активен
ацетон пропанол-2 кетон ——.вторичный спирт альдегид —ыервичныЙ спирт Получение:
2. Присоединение спиртов (Н + - кат.) 1. Окисление спиртов (02 над Си, k2CG07,
он КМпО4): о кат. Н СНз—СНа-он снз—съ альдегиды легко
С = О + : О—С2Н5 Н С —С— н + окисляются до кислот
этанол этаналь
+5 кетон осаН5 полуацеталь(полукеталь) 2. Реакция Кучерова в присутствии солей Hg2+:
+ Н 20
З осаН5 о о
ацеталь + снз—с•
З. Полимеризация (только альдегиды): 4. Поликонденсация (с фенолом) — образуется З. Гидролиз дигалогенпроизводных: фенолформальдегидная смола
Н он о с=0 + + . —с—о—
п он параформ первичные альдегиды
вторичные -» кетоны
КАРБОНОВЫЕ КИСЛОТЫ Номенклатура исторические
С Н 2 02 органические соединения, содержащие одну или тривиальные несколько карбоксильных групп: карбонил + гидроксил названия предельные одно- о основные кислоты —с снзснасоон пропионовая основность = число карбоксильных групп -СООН он СНзСН СН СООН масляная систематическая ИЮПАК
углеводород + к-та пропановая бутановая
|
|
|
||
|
Структура: Взаимное влияние карбонпла и гирокспла: Химические свойства смещение электронов в С=О группе определяются вызывает смещение электронов в он и поляризует связь -0-Н В результате Замещение Н- в с-положении снзсоон + сц снрсоон + на —Ю активация хлоруксусная Н ОН о снзснасоон + снзСНВгСООН + HBr с а- бромпропиоиовая увелиение кислотности ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ О Муравьиная (метановая) кислота — бесцветная жидкость с острым сильная кислота, т.к. нет СН -. группы особенность — со•-етание .о маз карбоксильной группы с • + АО2О но —с • ною атомом Н как альдргид сноон нр + сот утольная H2S04 р, получение: СО + NaOH HCOONa Ф Уксусная (этановая) кислота — безводная — кристаллич. в=ао (ледяная любых соотношениях. Получение: 1. НС=СН + нао снз-сно снз-соон 2. гснзсн снаснз + 502 4снз-соон + анго З. Уксуснокислое брожение (пищевой уксус) Э Пальмитиновая с,уз соон, стеариновая С 17 Н 35СООН — тв. в-ва, |
1. увеличењяе кислотности О н R—OH ОН он сильнее угольной кислоты лакмус — красное окрашивание 2. Увеличение прочности С=О — связи. Отсутствуют реакции присоединения. Увеличение прочности С-ОН — невозможно заместить ННа| |
||
|
карбо о 0R1 |
|||
|
запахом, хорошо растворима а НР, довольно со? + н2о ОН к-та), t = 17ос, смешивается С ВОДОЙ В нерастворимые в Н О. Смесь — стеарин. Входят |
|||
|
он |
|
|
в состав жиров. |
|
|
способна присоединять На, Вт2 и др. |
|
|
|
О Олеиновая |
||||
|
Получение: |
1 |
|
|
|
соон |
|
1. окисление спиртов, алщегидов 2. окисление предельных углеводородов (80— |
л |
соон |
ооон |
-нао |
соон сосн малеиновый о ангидрит |
|
КОН, МпС|2 — катализатор, крекинг) |
|
НООС изомеры |
спон |
легко |
соон соон ноос сн2=сн-соон |
|
|
|
фумаровая |
малеиновая |
о-фталевая м-фталевая терефталевая |
|
Превращения карбоксильной группы
1. как кислоты функциональные произаодиые
2R-COOH + МО = + нат
R-COOH + NaOH RCOONa + нр О соли
т.к. более сильные кислоты, чем Насо новых
2R-COOH + сасоз = (RCOO)2Ca + нр + сод ом
2. О
О О
*c-R о ангидрид
20
о
о РС|5 о
З. морон нао (NaOH) а ангиоиды
о о о
он 0NH4.:-Н2О амид
5. этерокация (каталиэируется кислотами)
О О сложный
+ н 20 эфир
он механизм
5—
о он
взаимодействие
R-C+ протонов с б— он он
+ он
-нао
он
О
акриловая
(изофталевая) (-та
О
4 функциональные производные карбоновых кислот — продукты замещения ОН-групп кислоты на остаток спирта ОТ. Брутто- 0—Rl формула СпНапОа такая же, как и у карбоновых кислот!
о
Физические свойства: летучие Жидкости Номенклатура: снз—с' (отсутствие водородных связей), мало оснз растворимы в воде, обладают приятным О кислота + спирт уксуснометиловый + эфир эфир запахом спирт + кислотный метилацетат остаток
Химические свойства: наличие поляризованного атома кислорода активирует связь C—O—R, и она легко разрывается даже под действием воды. Расщепление сложных эфиров под действием воды называется гидролизом или омылением. Эта реакция обратна реакции этерификации. Реакция катализируется протонами Н * и гидроксид-ионами ОН-. В присутствии щелочи реакция необратима (происходит омыление — образование соли карбоновой кислоты).
о гидролиз о снз + нон снз—с• 2Н5 ![]() осаН5 этерификация он
осаН5 этерификация он
СН +
NaOH СН 2Н5 ![]() осаН5 ОТа+
осаН5 ОТа+
Полуаение: 1) реакция этерификации — кислота + спирт (преимущественно первичный).
Реакция обратима, поэтому требуется избыток одного из реагентов или отгонка эфира о
2) ангидрид орг. кислоты + спирт: снзс: о
О + СН3ОН С н + СН3СООН снзс оснз
о
![]()
|
Жиры: смесь этих эфиров сн-о-с' Животые .иры: твердые. Образованы преимущественно предельными кислотами
С нз СООН — пальмитиновой и С17Н35СООН — стеариновой общая формула жиров Растительные ..иры или масла: жидкие, образованы преимущественно непредельными кислотами: С17НззСООН — олеиновой и С ТН з СООН — линолевой Если остаток глицерида связан с З остатками кислот, то образуется триацилглицерин — тристеарин. Физические свойства: животные жиры — тв. в-ва без определенной т—ры плавления, растительные — жидкие. Плотность большинства жиров меньше плотности воды. Жиры нерастворимы в воде, они выступают как поверхностноактивные вещества (ПАВ), образуя стойкие эмульсии (молоко). |
Мыла: соли высокомолекулярных карбоновых кислот (обычно стеариновой или пальмитиновой) Na — твердые, например, С17Н COONa К — жидкие, например, СООК. Моющие свойства связаны со строением молекул, с наличием неполярных и ионных групп. Мыла не пенятся в жесткой воде, т.к. нерастворимы соли Са: ПСОО- + са
2 + -» Детергенты — синтетические моющие средства (СМС) |
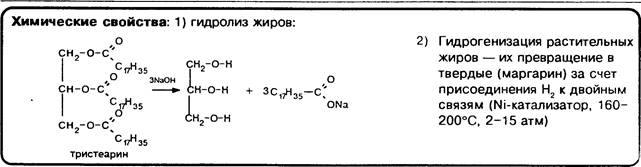
АМИНЫ
Номенклатура:
производные ГЧНз, в котором атомы водорода частично или полностью замещены углеводородными радикалами (жирного, ароматического рядов или смешанные)
R—NH2 первичный вторичный третичный
Физические свойства: метиламин, диметиламин, триметиламин — газы с резким запахом, остальные амины жирного ряда — жидкости, растворимые в Нао
Химические свойства обусловлены наличием неподеленной электронной пары у атома азота:
(C6H5)3N < (СбН5)2М-Ч < C6H5NH2 < М-43
Изменение
основности
NH3 < СНзГЧН2 < (СНз)2НН > (CH3)3N
Химические свойства — напоминают свойства Р•4Нз. Амины реагируют:
1. С кислотами — образуют соли — нелетучие тв. ионные вещества
сл
Маан н (болев сильное основание)
2. С алкилгалогенидами
+ (СН3)2НН + Н:
смесь торичмьи и третичных аминов
Из третичных аминов м.б. получены четвертичные аммониевые соли:
(CH3)3N + [(CH3)4Nl+l-
З. С органическими кислотами и ангидридами о
СНЗСООН + СНзНН2 [СНзСООј-[СНзГЧНзј+ -» снз—с О
З
4. В водных растворах аминов щелочная среда:
радикалы + амин H3C-N-C2H5
метил-этиламин (по алфавиту первых букв названия радикалов)
|
|
СНз |
|
по номенклатуре ИЮПАК: |
нзс-с-С2Н5 2-метил-2-бутиламин |
|
АНИЛИН — ароматический амин. на воздухе желтеет из-за окисления, 5- 5+ Основность мала. В NH 2 плотность в орто- и ХИМИЧЕСКИЕ -NH2 с кислотами: СбН5-Г•4Н2 + на -» [свН5-гчнзЈ+ а- солянокислый антин или гирохлорид анилина с алкилгалогенидами: Б— 6 3 Ъз |
Жидкость, т„п. = 18400, бесцветный, плохо растворим в НР молекуле увеличена электронная пара-полохениях (как в феноле) СВОЙСТВА с бромной водой: мча NH2 -нвг белый осадок триброманилина с формальдегидом — образуется анилинформальдегидная смола |
|
Получение: Н.Н. Зинин, 1842 г. — восстановлением нитробензола с использованием (NH4)2S или H2S: В настоящее время: каталитическое и электрохимическое восстановление нитробензола или его восстановление в кислой среде (Ре, И, |
|
NH2
органические дифункциональные соединения, в состав которых входят две функциональные о
Физические свойства: белые кристаллические вещества, хорошо растворимы в воде, при нагревании не плавятся, выше 200—300 0 С — разлагаются
Строение: 2 функциональные группы, их
взаимное влияние, новые специфические свойства
|
|
|
|
|
|
Полу•ение: из карбоновых кислот
С12 гчнз снзснрон снзрнсоон снз9НСООНН4 сн янсоон
NH2
образуют «внутренние» соли ионный
NH2CH2COOH МН +СН2С00- тип связи
биполярные или цвипер. ионы
Реакции функциональных групп друг с другом
Для карбоновых кислот характерно образование амидов о
R-C' R1 вместо N м б. остаток аминокислоты
аминокислота + аминокислота -» дипетид о о
ГЧН2-СНг-С'
|
он |
он 2
о
ГЧНг-СН2-С о
N-CHa-C'
он о
-» трипептид полипептид
Реакция обратима — в присутствии
кислот и оснований — гидролиз пептидная связь
Капроновое волокно: г-аминокапроновая кислота поликонденсация
о о
-с он -0- 1)H20 капроновая смола нити
|
входят в состав кожи. роговых покровов, Белок — полипептид О Последовательность аминокислот — первичная структура образование водородных связей между и гчн — спираль — вторичная структура Э взаимодействие NHa, ОН, СООН групп, не принимающих участия в образовании пептидной связи — третичная структура |
|
нагрев до высокой температуры, радиоактивное облучение, соли тяжелых металлов — вызывают разрушение вторичной и третичной структур — денатурацию |
Белки: важнейшая составная часть живых организмов, мышечной и нервной ткани Высокомолекулярные соединения, молекулярная масса — до нескольких миллионов
Состав: определен через гидролиз (разбавл кислоты, ферменты)
Почти исключительно — ос-аминокислоты (ФО), связанные пептидными связями.
Качественная реакция : желтое окрашивание о с НГЧОз; нитрование
CH2CH-C' фенилаланина
он
NH2
НА КАТИОНЫ
|
|
|
НА АНИОНЫ
|
Анион |
Реактив |
Наблюдаемая реакция |
|
|
|
Выпадение белого осадка, нерастворимого в кислотах: S042- + ва 2 + = BaS04J |
|
N03- |
1) добавить конц. H2S04 и Си, нагреть 2) смесь H2S04 + FeS04 |
Образование голубого раствора, содержащего ионы си 2 + выделение газа бурого цвета (N02) Возникновение окраски сульфата
нитрозожелеза (ll) |
|
|
ионы Ag |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + рог- = А93РО4Ј |
|
cr042- |
ионы ва2 + |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в на: ва 2 + + cr042 - ВаСгО4Ј |
|
|
ионы Pb 2+ |
Выпадение черного осадка: рь2+ + $2- |
|
с 032— |
ионы са 2 + |
выпадение белого осадка, растворимого в кислотах: са2+ + СОВ- = СаСО3Ј |
|
C02 |
известковая вода Са(ОН)2 |
СаСОз +
C02 + НЮ Выпадение белого осадка и его растворение при пропускании СО2 |
|
S 032— |
ионы Н + |
Появление характерного запаха SOa: 2н+ + s03 2- н2о + 602 Т |
|
|
ионы са2 + |
Выпадение белого осадка са2+ + 26 = CaF2J |
|
сг |
ионы Ag |
Выпадение белого осадка, не растворимого в HN03, но растворимого в конц. ГЧНз • НЮ: Ag+ + СГ = AgClJ Aga + 2(NH3 • НЮ) |
|
|
ионы Ag |
Выпадение светло-желтого осадка, не растворимого в НГЧОз: Ag+ + Вг- = AgBrJ осадок темнеет на свету |
|
|
ионы Ag |
Выпадение желтого осадка, не растворимого в HN03 и NH3 конц.: Ag+ + ' - = AglJ осадок темнеет на свету |
|
ОН — (ще- лонная среда) |
индикаторы: лакмус фенолфталеин |
синее окрашивание малиновое окрашивание |
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
Соединение |
Реактив |
Наблюдаемая реакция |
|
Алканы |
Пламя |
Обычно определяют путем исключения Низшие алканы горят голубоватым пламенем |
|
Алкены с=с |
1) Бромная вода 2) р-р КМП04 З) Горение |
Обесцвечивание раствора Обесцвечивание раствора, выпадение бурого осадка МпО2 Горят слегка желтоватым пламенем (частицы углерода) |
|
Бензол |
Горение |
Обычно определяют гшем исключения Горит коптящим пламенем |
|
фенол |
1) Бромная вода 2) р-р ГЧа2СО3 |
Обесцвечивание, выпадение белого осадка трибромфенола Выделение углекислого газа Фиолетовое окрашивание |
|
Спирты |
2) Горение З) Черная горячая прокаленная Си-проволока |
Выделение водорода Горят светлым голубоватым пламенем Восстановление красной окраски у прокаленной горячей медной проволоки |
|
Многоатомные спирты |
ИОН |
Синее окрашивание — образование глицератов и др. |
|
Амины |
1) Лакмус 2) ННа| |
В водном растворе — синее окрашивание Образуют соли с галогеноводородами — после выпаривания твердый осадок |
|
Анилин |
1) Бромная вода 2) ННа| |
Обесцвечивание бромной воды, выпадение осадка триброманилина После упаривания твердый осадок — соль гидрогалогенида анилина |
|
Альдегиды |
|
Реакция серебряного зеркала выпадение красного осадка Сид |
|
Карбоновые кислоты |
Лакмус |
Красное окрашивание ! Муравьиная — реакция серебряного зеркала ! Олеиновая — обесцвечивание бромной воды |
|
Крахмал |
Раствор l2 в Ю или спиртовой раствор иода |
Синее окрашивание |
|
Белки |
конц. HN03 |
Желтое окрашивание, при добавлении щелочного раствора — оранжевое |
|
Обозначение |
Наименование величины |
Размерность |
|
тв, т(СН4), Т сна |
Масса вещества |
кг, г и произодные |
|
та |
Абсолютная атомная масса атома Масса атома, выраженная в единицах массы |
кг, г и производные; а.е.м. |
|
1 Примечание: атомная единица массы (а.е.м.) — масса части атома нуклида 12 углерода 12 С 1 а.е.м. = 1.667 • 10-27 кг |
||
|
|
Относительная атомная масса атома данного нуклида — масса атома, отнесенная к 1/12 массы атома углерода 12 0. |
Величина безразмерная |
|
Ar(Cl) |
Относительная атомная масса элемента — средняя масса атома элемента при его природном изотопном составе, отнесенная к 1/12 массы атома 12 0. |
Величина безразмерная |
|
мг, мдсна) |
Относительная молекулярная масса — отношение средней массы молекулы вещества к 1/12 массы атома 12 0. Равна сумме относительных атомных масс атомов, составляющих молекулу. |
Величина безразмерная |
|
|
Количество вещества 1 моль — такое количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов и др.), сколько атомов содержится в 12 г нуклида 12 С (6.02 • 10 23 ) |
моль |
|
|
Молярная масса — отношение массы вещества тв к количеству веществ Пв
|
кг/моль (г/моль) и производ- |
|
|
Постоянная Авогадро Число частиц в одном моле: NA = 6.02 • 10 23 Значение находится экспериментально. |
моль- 1 |
|
|
Число частиц (молекул, атомов, ионов) равно количеству вещества (числу молей), умноженному на постоянную Авогадро:
|
частицы |
|
|
Объем, занимаемый веществом В |
мз (в химии также литр, л
|
|
|
Молярный объем Объем, который занимает 1 моль вещества. Равен отношению объема, занимаемого веществом, к количеству вещества:
При нормальных условиях объем, который занимает 1 моль идеального газа, равен 22,4 л |
м3/моль л/моль и производ- (см 3/моль и др.) |
|
Обозначение |
Наименование величины |
Размерность |
|
|
Плотность вещества. Отношение массы вещества к занимаемому им объему
|
кг/м з и производные (г/см з и др.) |
|
|
Относительная плотность газа показывает, во сколько раз объем одного газа легче (тяжелее) такого же объема другого, т.е. во сколько раз плотность одного газа больше (меньше) плотности другого. Из закона Авогадро (в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул) следует: - №12/22.4 - |
Величина безразмерная |
|
|
Массовая доля вещества В в смеси. Отношение массы вещества В к массе всей смеси. Для смеси из трех веществ А, В и С: тв т А + ТВ + ТС Для раствора:
Массовую долю часто выражают в процентах |
Величина безразмерная |
|
|
Мольная доля вещества В в смеси, Отношение количества вещества В (числа его молей) к суммарному количеству (числу молей) всех веществ в смеси. Для смеси трех веществ: п в х
|
Величина безразмерная |
|
(Рв |
Объемная доля вещества В в смеси. Отношение объема, занимаемого веществом В, к объему всей смеси:
|
Величина безразмерная |
|
|
Молярная концентрация Отношение числа молей вещества В содержащихся в растворе объемом V, к объему раствора (в дм з или литрах):
|
моль/л |
Перед тем, как приступить к решению задачи, после внимательного прочтения условия следует:
1. Все физические величины, о которых говорится в условии, выразить в одинаковых единицах (например, массы всех реагентов — в килограммах или граммах, объемы всех газов — в литрах или миллилитрах и т.д.).
2. Если в условии задачи имеются данные
об объемах газов, отнесенных к условиям, не соответствующим нормальным (10 5
Па, ОС), то, используя уравнение ![]() 2V2 следует пересчитать объем газа на
нормальные условия.
2V2 следует пересчитать объем газа на
нормальные условия.
З. Во многих случаях целесообразно найти количества реагирующих веществ и продуктов реакции (в молях).
4. Если при решении задачи необходимо учесть уравнение протекающей реакции, то при его составлении необходимо найти коэффициенты перед формулами веществ, входящих в уравнение реакции.
5. Если в условии задачи нет указаний о численном значении величины, характеризующей исходную систему, то часто целесообразно допустить, что взято 100 г раствора, 1 л газовой смеси и т.д.
6. Удобно неизвестное, о котором речь идет в условии задачи, выразить через х. Далее на основании химического уравнения составляют алгебраическое уравнение и, решая его, находят х. Если неизвестных два, то их обозначают через х и у, записывают систему из двух алгебраических уравнений. Решение системы уравнений позволяет найти х и у.
7. При решении задач атомные массы всех химических элементов, кроме А (Cl), округляют до целого значения. для А (О) принимают значение 35,5.
![]()
1. Определение относительной молекулярной массы Mr
Условие: Какова относительная молекулярная масса Мг нитробензола C6H5N02? Какова
молекулярная масса этого вещества в а.е.м.? Решение:
Мг = 6Ar(C) + 5Ar(H) + Ar(N) + 2Ar(O) = 6 х 12 +
5х1 + 14 + 2х16= 123
Для нахождения массы молекулы нитробензола в а.е.м. надо найденное значение умножить на 1 а.е.м.. Получаем 123 а.е.м. Ответ: 123; 123 а.е.м.
2. Определение массы атома в граммах
Условие: Какова масса в граммах 1 атома 131![]()
131
Решение: Обозначим массу 1 атома через
131
х. Составим запись: 1 моль атомов содержит 6,02 • 102[1] атомов, их масса 131 г/моль 1
131
атом имеет массу х г.
Составив пропорцию и решив ее, находим:
![]()
6,02 • 1023
-22
Ответ: 2, 18 • 10![]()
З. Определение числа молекул в порции вещества
Условие: Сколько молекул воды содержится в 1 капле воды массой 0,03 г? Решение: Обозначим число молекул воды в 1 капле через х. Составляем запись:
23 1 моль воды, масса 18 г, содержит 6.02 • 10 молекул, масса 0.03 г — х молекул
Составив пропорцию и решив ее, находим:
23
![]() 18
18
0,03 18 = 1021 молекул
Ответ: 10 21 молекул
4. Определение массовой доли элемента в соединении
Условие: Какова массовая доля фосфора в
![]()
(Р) ![]()
2-31
Ответ: w = 0.2 или 2096
5. Определение молярной массы М
Уствие: Какова молярная масса вещества, если масса 2.5 моль этого вещества равна 250 г? Решение: Из условия следует, что п = 2.5 моль, а т = 250 г.
т 250
мв п 2.5 = 100 г/моль
Ответ: 100 г/моль
6. Определение массового отношения элементов в соединении
Условие: Каково массовое отношение углерода, водорода и кислорода в глюкозе СбН12О6? Решение: Отношение масс элементов в этом соединении равно:
![]() = 6 Ar(C) : 12 Ar(H) : 6 АО) = 6 • 12 :
= 6 Ar(C) : 12 Ar(H) : 6 АО) = 6 • 12 :
=6:1 :8
7. Определение объема, который занимает порция газа при нормальных условиях
Уствие: Какой объем (н.у.) занимают 66 г
СОВ
Решение: Обозначим объем, который занимает 66 г СО2, через х. Составим запись:
1 моль СО2 масса 44 г — объем 22.4 л масса 66 г — объем х л
Решение пропорции позволяет найти х:
22.4 66
Ответ: 33.6 л.
8. Определение теплового эффекта реакции
Условие: Молярная теплота сгорания угля на воздухе 393.5 кДж/моль. Сколько теплоты выделится при полном сгорании 1 кг угля? Решение: Из условия следует, что масса сгоревшего угля 1 кг, т.е. 1000 г. Обозначим количество теплоты, выделяющееся при сгорании 1000 г угля через х, и составляем запись: При сгорании 1 моль угля, масса 12 г, выделяется 393.5 кДж теплоты
При сгорании 1000 г угля, выделяется х ![]() теплоты
теплоты
Решение пропорции позволяет найти х:
1000 • 393 5
• = 32800 кдж или 32.8 мдж
12
Ответ: 32.8 МДж
9. Определение максимального выхода продукта реакции
Условие: Сколько максимально литров (н.у.) водорода можно получить, используя 45.5 г цинка и избыток соляной кислоты? Решение: Запишем уравнение протекающей реакции. Внизу, под формулами соответствующих веществ, записываем их молярную массу (под знаком Zn) и молярный объем (под формулой Н2). Сверху записываем массы прореагировавшего цинка и объем выделившегося водорода (обозначим его через х):
zn + 2'-ча = znC12 + НД
65 г/моль 22.4 л/моль
Из пропорции:
45,5 х
![]()
65 22,4
находим, что х = 15.7 л. Ответ: 15.7 л.
10. Определение реального выхода продукта реакции
Условие: При прокаливании 15,8 г перманганата калия КМпО4 получено 0,896 л (н.у.) кислорода. Каков выход кислорода в данном случае? Решение: Записываем уравнение реакции
ЖМП04 = К2Мп04 + мп02 + 02
2 • 158 г/моль 22,4 л/моль
При максимальном (10096-ном) выходе объем выделившегося кислорода V можно найти из пропорции:
![]()
Так как, в соответствии с данными условия, получено 0,896 л кислорода, то, следовательно, выход кислорода равен:
0.896
= 0.8 или 8096
1.12
Ответ: 8096.
11. Определение выхода продукта по стехиометрическим соотношениям
Уствие: Сколько граммов азотной кислоты
HN03 максимально можно получить из 44.8 л (н.у.) азота?
Решение: С учетом того, что в одной молекуле HN03 содержится 1 атом азота, составляем
запись:
44,8 х
N2 ![]() 2НГЧОз
2НГЧОз
22,4 2х63
Обозначив массу образующейся при 10096-ном выходе азотной кислоты через х, записываем пропорцию:
![]()
22,4 л/моль 2 • 63 г/моль
Из нее находим, что
![]()
22.4
Ответ: 252 г.
12. Определение содержания основного компонента (или содержания примеси) в исходном веществе
Условие: Каково содержание (в процентах) СаСОз в образце известняка, при длительном прокаливании 400 г которого получено 78,4 л СО2 (н.у.)?
Решение: Запишем уравнение реакции:
78,4 л сасоз = СаО + со2
100 г[моль 22,4 л/моль Обозначим через х г массу СаСОз, разложение которой приводит к получению 78,4 л СО2. Из соответствующей пропорции находим, что
78.4• 100
= 350 г
22.4
Таким образом, содержание СаСОз в исходном образце составляет:
350
= 0.875 или 87.596 400
Примесей в исходном образце 100 — 87,5 =
12,596
Ответ: 87,596
13. Определение выхода реакции, когда одно из исходных веществ взято в избытке.
Условие: Сколько граммов поваренной соли NaCl можно получить, если смешать два раствора, один из которых содержит 29,2 г на, а другой 44 г NaOH?
Решение: Записываем уравнение протекающей
реакции:
29,2 44 на + ГЧаОН = Naa + НЮ 36,5 40 г/моль г/моль
Нахсщим,
что в случае на отношение![]() = 0.8
= 0.8
44
моль меньше, чем в случае NaOH 40 = 1,1 моль.
Так как в данной реакции вещества реагируют в равномолярных количествах (на 1 моль на расходуется 1 моль КОН), то в данном случае ГЧаОН взят в избытке. Поэтому расчет массы образовавшегося NaCl ведем по массе израсходованного полностью на: 29,2 на + мОН = нас: + нао
36,5 г[моль 58,5 г/моль Находим, что:
29.2 • 58 5
• = 46,8 г
36.5
Массу образующегося NaCl можно найти также, учитывая, что израсходовано 0,8 моль на и, следовательно, образуется также 0,8 моль NaC1. Тогда масса NaCl равна:
![]() NaCl = 46,8 г Ответ:
46,8 г.
NaCl = 46,8 г Ответ:
46,8 г.
14. Определение состава газовой смеси (в объемных процентах)
Условие: 20 л (н.у.) аммиака пропустили через нагретую до 350 0 C трубку с железным катализатором. Объем полученной газовой смеси (н.у.) равен 25 л. Каков состав полученной пазовой смеси (в объемных процентах)?
Решение: При пропускании аммиака над нагретым катализатором протекает реакция:
2NH3 = N2 + ЗН2
![]() 1 л З л
1 л З л
Прирост объема при разложении 2 л аммиака равен 1 + З - 2 = 2 л. Обозначив объем разложившегося аммиака через х л, и учтя, что увеличение объема составило 25 — 20 = 5 л,
можно записать:
Разложение 2 л аммиака приводит к возрастанию объема на 2 л
Разложение х л аммиака приводит к возрастанию объема на 5 л Из пропорции
2 2 5-2 х 5 находим,
чтох= 2![]()
Таким образом, в смеси осталось 20 — 5 л аммиака. Учитывая уравнение реакции, находим объем образовавшегося при разложении
5л аммиака водорода Ь и азота а:
![]() а
а
2NH3 = + ЗН2
1 -5 3-5
![]() = 2.5 л =
7.5 л
= 2.5 л =
7.5 л
2 2
В смеси объемное содержание аммиака 15/25
= 0,6 или 6096, объемное содержание азота 2.5/25 = О, 1 или 1096, объемное содержание водорода 7,5/25 = 0,3 или 3096.
Ответ: N2 1096, на 3096, ГЧНЗ 600/0.
15. Определение объема газа, расходуемого на проведение реакции с другими газами
Условие: Какой минимальный объем кислорода, содержащего 10 объемн. % озона, необходим для полного сжигания 4 л пропана СзН8? Решение: Составляем уравнение реакции горения пропана в атмосфере кислорода:
сзН8 + 502 = 3С02 + 4H20
для полного сжигания 4 л пропана требуется х
![]() = 20 л 02. При взаимодействии озона с
пропаном также образуется СО? и Аода. Поэтому можно принять, что в реакцию с
пропаном вступает смесь, каждый литр которой содержит 0,9 л 02 и 0,1 л Оз. При
превращении в кислород 02 озона объем увеличивается в 1,5 раза:
= 20 л 02. При взаимодействии озона с
пропаном также образуется СО? и Аода. Поэтому можно принять, что в реакцию с
пропаном вступает смесь, каждый литр которой содержит 0,9 л 02 и 0,1 л Оз. При
превращении в кислород 02 озона объем увеличивается в 1,5 раза:
203 = 302
При этом из 0,1 л 03 образуется 0,15 л 02. Таким образом, 1 л исходной смеси кислорода
и озона эквивалентен 0,9 + 0,15 = 1,05 л 02.
Поэтому для полного сгорания 4 л пропана
20
необходимо V = = 19,05 л кислорода,
1.05
содержащего 10 объемн. % озона. Ответ: 19,05 л.
16. Определение молекулярной формулы вещества по относительной плотности его паров
Условие: Относительная плотность паров углеводорода по воздуху 2,69. Массовая доля водорода в соединении 7,6996. Какова молекулярная формула углеводорода?
Решение: Обозначим относительную молекулярную массу углеводорода как Мг. Из соотношений мг
![]() - —3- = 2.69
- —3- = 2.69
м
«воздух) находим, что Мг = 29 • 2,69 = 78. Так как масса молекулы в а.е.м. численно равна относительной молекулярной массе, то молекулярная масса углеводорода 78 а.е.м.
На водород в углеводороде приходится
78 • 0,0769 = 6 а.е.м. Следовательно, в составе
6
молекулы атомов водорода: — 1 = 6. На углерод приходится 78 — 6 = 72 а.е.м. Число атомов С в молекуле равно: К- = 6. Таким образом, формула углеводорода СбН6 (бензол). Ответ: СбН6.
17. Определение состава газовой смеси
Условие: Относительная плотность 30 л смеси метана СН4 и азота ГЧ2 по гелию равна 5. Сколько литров метана и азота взято для приготовления смеси?
Решение: Сначала находим среднюю относи-
тельную молекулярную массу смеси М ![]()
![]()
Пусть метана взято х л, тогда азота взято (30 —
х) л. Масса 1 л метана 16/22,4 г, а масса 1 л азота — 28/22,4 г. Масса х л метана (16/22,4) • х г, а масса (20 — х) л азота равна (28/22,4) • (30 — х) г. Масса 1 л смеси равна
20/22,4 г, а масса ЗО л смеси— (20/22,4) • ЗО г.
Очевидно, что
16х 28(30-х) 20 • зо
![]()
22.4 22.4 22.4
Решая уравнение относительно х, находим, что х = 20. Таким образом, для приготовления смеси было взято 20 л метана и 30 — 20 = 10 л азота. Ответ: 20 л метана и 10 л азота.
18. Определение состава солей в растворе
Условие: В растворе смешали 9,8 г H2S04 и
6,5 г NaOH. Какие соли и в каких количествах образовались?
Решение: Примем, что смешивание проходило так, что раствор NaOH медленно вливали в раствор серной кислоты. Первоначально в кислой среде протекала реакция:
ГЧаОН + = NaHS04 + НЮ В исходном растворе было = 0,1 моль серной кислоты. Когда в раствор ввели 4,0 г
NaOH (т.е. 0,1 моль NaOH), то серная кислота прореагировала полностью (как видно из уравнения реакции, при реакции молярное отношение реагентов 1:1 В результате образовалось 0,1 моль кислой соли NaHS04. При последующем добавлении в раствор оставшихся 6,5 - 4 = 2,5 г NaOH, т.е. 0,0625 моль, протекает реакция образования из кислой соли средней:
NaHS04 + ГЧаОН = NaaS04 + нао
С 0,0625 моль NaOH прореагирует 0,0625 моль NaHS04 и образуется 0,0625 моль средней соли Na2S04. В результате в растворе будет находиться 0,0625 моль NaS04 и 0,1 - 0,0625 = 0,0375 моль NaHS04.
Отвел 0,0625 моль NaS04 и 0,0375 моль NaHS04
19 —22. Приготовление раствора с заданной массовой долей растворенного вещества
а) Уствие: Сколько граммов сахарозы надо растворить в 250 г воды, чтобы получить раствор с массовой долей сахарозы 0,3 (3096)? Решение: Обозначим массу использованной сахарозы через х г. Масса раствора равна (250+х) г и, следовательно
![]()
250 + х
Решая это уравнение, находим, что х = 107 г. Ответ: 107 г.
б) Уствие: Сколько граммов медного купороса CuS04 • 5Н2О надо добавить к 300 г 296-го раствора сульфата меди, чтобы получить 596ный раствор?
Решение: Отметим, что в ЗОО г 296-го раствора содержание CuS04 равно 0,02
• ЗОО = 6 г. Обозначим теперь массу добавляемого в раствор CuS04 • 5Н2О через
х. Так как молярная масса CuS04 • 5Н2О равна 250, а молярная масса CuS04 -—
160, то массовая доля ![]() водного CuS04 в CuS04 • 5Н2О равна 250
водного CuS04 в CuS04 • 5Н2О равна 250 ![]() 0,64.
Следовательно, в х г медного купороса содержание безводного CuS04 составляет
0,64х. С учетом этого можно составить уравнение:
0,64.
Следовательно, в х г медного купороса содержание безводного CuS04 составляет
0,64х. С учетом этого можно составить уравнение:
6 + 0.64х ![]() = 0.05 зоо + х
= 0.05 зоо + х
Решение этого уравнения позволяет найти, что х = 15,25 г.
Ответ: 15,25 г.
в) Условие: Сколько миллилитров воды нужно добавить к 100 мл 3096-го раствора соляной кислоты с плотностью 1,15 г/мл, чтобы получить раствор с массовой долей НС] 5 0/0?
Решение: Учитывая, что плотность раствора
1 , 15 г/мл, находим массу исходного раствора: т = pv = 1,15, = 115 г
Исходный раствор 30 0/0-ный, следовательно, в нем содержится • 115 = 34.5 г на. Если массу добавляемой воды обозначить через х г, то можно записать уравнение:
34,5
![]() = 0,05
= 0,05
Отсюда х = 575 г.
Ответ: 575 г.
г) Условие: Сколько граммов Вао надо добавить к 100 г воды, чтобы получить 596-ный раствор? Решение: При внесении Вао в воду протекает реакция: х
ВаО + нао =![]()
153 171
Обозначим массу ВаО, который надо добавить, через х. Тогда массу
образующегося в воде ![]() у можно выразить как
у можно выразить как
![]()
153
С учетом того, что из х г Вао образуется
1,12х г ![]() можно записать уравнение:
можно записать уравнение:
![]() = 0.05
= 0.05
Решение уравнения дает х = 4,67 г. Ответ: 4,67 г.
23. Приготовление раствора с заданной молярной концентрацией
Условие: Сколько граммов сульфата натрия
NaS04 • 1 ОН2О необходимо для приготовления 0,5 л раствора с молярной концентрацией 0,02 моль/л?
Решение: Приготовляемый раствор должен содержать 0,5 • 0,02 = 0,01 моль
вещества, т.е. 0,01 моль Na2S04. 0,01 моль Na2S04 содержится в 0.01 моль Na2S04
10Н2О. Следовательно, для приготовления раствора нужно использовать т = 0,01 ![]() =
0,01 •322 = 3,22 г Ответ: 3,22 г.
=
0,01 •322 = 3,22 г Ответ: 3,22 г.
24. Определение формулы органического вещества по данным о массе продуктов реакции
Условие: При полном сгорании 6,0 г органического вещества получено 8,8 г СО2 и 3.6 г воды. Плотность паров органического вещества по водороду равна 30. Какова молекулярная формула вещества?
Решение: Сначала находим молекулярную массу вещества. Она равна Mr = 2 30 = 60. Порция вещества массой 6,0 г содержит
Водорода она содержит 3.6![]()
Mr(HP)
![]()
18
0,4 + 2,4 < 6,0 и, следовательно в состав вещества входит также кислород. Его в порции вещества массой 6,0 г то = 6,0 — 2,4 — 0,4
В молекуле вещества отношение чисел атомов С, Н и О равно:
![]()
Простейшая формула вещества СН2О. Значение Mr для такой формулы равно Mr = 12 + 2 • 1 + 16 = 30. Так как это значение в два раза меньше Mr вещества (60:30), то, следовательно, молярная формула вещества будет С2Н4О2. Такой формуле отвечает формула уксусной кислоты СНзСООН и метилового эфира муравьиной кислоты НСООСНз.
Ответ: формула вещества С2Н4О2.
25. Определение молекулярной формулы органического вещества по данным о продукте реакции
Условие: При обработке 14,8 г одноосновной карбоновой кислоты избытком цинка получено 2,24 л водорода. Какова молекулярная формула кислоты?
Решение: Получено
2,24:22,4 = 0,1 моль Н2. Так как кислота одноосновная и из каждой ее молекулы
металл вытесняет только 1 атом водорода, то, следовательно, кислоты
использовано 0,1 • 2 = 0,2 моль. Молярная масса кислоты равна ![]() 14682 г = 74
г/моль.
14682 г = 74
г/моль.
В общем виде формулу одноосновной кислоты можно записать как СпН2п+1СООН, и значение
![]() 12•П + (2П + 1 ) , 1 + 12 + 2 , 16 + 1.
ДЛЯ определения п составляем уравнение:
12•П + (2П + 1 ) , 1 + 12 + 2 , 16 + 1.
ДЛЯ определения п составляем уравнение:
![]() + (2п + +
12 +
+ (2п + +
12 + ![]() = 74 Решая. это уравнение, находим, что п
= 2, и молекулярная формула кислоты С2Н5СООН (пропионовая кислота).
= 74 Решая. это уравнение, находим, что п
= 2, и молекулярная формула кислоты С2Н5СООН (пропионовая кислота).
Ответ: С2Н5СООН автор задач СС. Бердоносов
ПРЕДИСЛОВИЕ......................... .![]()
ХИМИЧЕСКИЙ
ЭЛЕМЕНТ....... ![]() . 4
. 4
|
ХИМИЧЕСКАЯ СВЯЗЬ. |
|
|
|
ТИПЫ
ХИМИЧЕСКИХ РЕАКЦИЙ . |
|
|
|
СКОРОСТЬ
ХИМИЧЕСКИХ РЕАКЦИЙ . |
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ . |
10 |
|
|
РАСТВОРЫ . |
1 1 |
|
|
ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ . |
12 |
|
|
ЭЛЕКТРОЛИЗ
|
1 3 |
|
|
ОКСИДЫ . |
14 |
|
|
ОСНОВАН И Я . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . |
15 |
|
|
кислоты . |
16 |
|
|
сол и . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . |
17 |
|
|
ГИДРОЛИЗ
СОЛЕЙ . |
18 |
|
|
ПОДГРУППА
К,ЩЕЛОЧНЫЕ МЕТАЛЛЫ И, на, К, Rb, cs |
19 |
|
|
ПОДГРУППА
Па И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ са, sr, Ва |
20 |
|
|
ПОДГРУППА
ша. АЛЮМИНИЙ А . . |
|
21 |
|
ПОДГРУППА
V1116. ЖЕЛЕЗО Ре |
|
22 |
|
ВОДОРОД Н |
|
23 |
|
ПОДГРУППА
Ша. ГАЛОГЕНЫ р, а, Br, |
|
24 |
|
ПОДГРУППА
Vlla. ХЛОР а |
|
25 |
|
ПОДГРУППА
Ша,О, S, se, Те . |
|
26 |
|
ПОДГРУППА
Ша. КИСЛОРОД О . |
|
27 |
|
ВОДЯ
(ОКСИД ВОДОРОДА) НЮ... |
|
28 |
|
ПОДГРУППА
V.A30T н . . . |
|
29 |
|
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА. . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. |
||
|
ПОДГРУППА
К. ГЫ, Р, As, Sb, З. ФОСФОР Р . . |
31 |
|
|
ПОДГРУППА
Ма.УГЛЕРОД С . . . |
32 |
|
|
ПОДГРУППА
ма.с, Si, Ge, s n , рь. КРЕМНИЙ Si . |
33 |
|
|
ПОДГРУППА
Ш6,ХРОМ Cr . |
||
|
ПРЕДЕЛЬНЫЕ
УГЛЕВОДОРОДЫ (АЖАНЫ, ПАРАФИНЫ) . |
||
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛЕНЫ, ОЛЕФИНЫ).![]() 36
36
|
СПИРТЫ.. |
|
40 |
|
ФЕНОЛЫ.. |
|
41 |
|
АЛЬДЕГИДЫ И КЕТОНЫ . |
|
42 |
|
КАРБОНОВЫЕ КИСЛОТЫ. |
|
43 |
|
СЛОЖНЫЕ КЕТОНЫ. |
|
44 |
![]()
![]()
![]() ДИЕНОВЫЕ
УГЛЕВОДОРОДЫ..
ДИЕНОВЫЕ
УГЛЕВОДОРОДЫ..![]() 37
37
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛИНЫ) .![]() 38 АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ (АРЕНЫ) .
38 АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ (АРЕНЫ) .![]() 39
39
45
46
КАЧЕСТВЕННЫЕ
РЕАКЦИИ НА КАТИОНЫ.![]() 47
47 ![]() *ЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ .
*ЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ .![]() 48
48
« д - ЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ![]() 49
49
: : : ,'ЧЕСКИЕ ВЕЛИЧИНЫ В ХИМИИ![]() 50
50
25 ТИПОВЫХ РАСЧЕТНЫХ ЗАДАЧ52
|
|
|
|
|
3 n E M E H TO B |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
a |
6 |
||||||
|
|
|
|
|
|
|
|
|
|
|
ı.OOTS42T •onopon |
2 |
|
|||||
|
4,00260222 Isa 2 |
no |
ATO*" e R 92 2 21 32 2 ıncHTpoxo• an e N rponoa |
|
||||||||||||||
|
2 , |
3 |
|
|
5 |
6 |
|
|
2 |
ıncnopon 2 |
9 orop |
Ne 2 |
|
|||||
|
|
II 22.0DST7t1 |
|
12 2 2 |
13 |
4 2 |
|
oocoop |
|
s |
17 3S Z 3D5 B |
18 8 |
|
|||||
|
4 |
K 19 2 |
|
Ca 2 unsun a |
21 a |
2 2 |
|
2 |
V |
2 |
25 Mn |
26 14 |
|
28 Ni |
||||
|
29 Cu
|
|
Zn 85,1922 3d'04.a |
G a 31 rınnıi 2 |
Ge 32 2 |
|
As 1UUbR1 |
2 |
Se 3 |
452425 2 |
2 |
|
||||||
|
5 |
|
|
|
|
4d25*Z 2 |
|
2 |
|
2 nonısatK |
|
2 |
|
nınnının |
||||
|
2 |
|
|
|
2 |
|
|
552503 |
|
2 |
ssz 2 |
|
||||||
|
|
CS 55 |
|
|
57 e % 1 69 2 |
a 72 Hf 32 |
|
32 |
Ta YANTAn |
74 w 32 2 ıonbopız |
Re 2 |
2 76 14 32 |
32 |
17 32 |
nnnvıın |
|||
|
|
32 |
200,5123 |
81 32 6sZ6pl vınnmî |
Pb 82 32 cgııtu |
|
21480421 |
83 a |
PO B 32 8526" nanom |
|
86 18 32 18 2 |
|
||||||
|
7 |
32 2 |
|
18 22'02şa 18 pınıi 2 |
227,0278 2 |
104 Db 32 6aZ7.Z |
|
2 |
|
106 Hf 32 2 |
Bh 32 2 |
32 108 H n 32 18 2 |
18 2 |
110 32 |
||||
|
|
|
|
|
||||||||||||||
|
|||||||||||||||||

[1] •40+ 2(31 + 4 • 16)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.