
Обратимые и необратимые процессы
Обратимым
термодинамическим процессом называется термодинамический процесс, допускающий
возможность возвращения системы в первоначальное состояние без того, чтобы в
окружающей среде остались какие-либо изменения.
Необходимым и достаточным условием обратимости термодинамического
процесса является его равновесность.
Необратимым термодинамическим процессом называется
термодинамический процесс, не допускающий возможности возвращения системы в
первоначальное состояние без того, чтобы в окружающей среде остались какие-либо
изменения.
Все реальные процессы протекают с конечной скоростью. Они
сопровождаются трением, диффузией и теплообменом при конечной разности между
температурами системы и внешней среды. Следовательно, все они неравновесны и
необратимы.
Всякий необратимый процесс в одном направлений (прямом) протекает
самопроизвольно, а для осуществления его в обратном направлении так, чтобы
система вернулась в первоначальное состояние, требуется компенсирующий процесс
во внешних телах, в результате которого состояния этих тел оказываются
отличными от первоначальных.
Например, процесс выравнивания температур двух соприкасающихся различно нагретых тел идет самопроизвольно, т. е. не связан с необходимостью одновременного существования каких-либо процессов в других (внешних), телах. Однако для осуществления обратного процесса увеличения разности температур тел до первоначальной нужны компенсирующие процессы во внешних телах, обусловливающие, например, работу холодильной машины.
Энтропия.
Большинство процессов в природе необратимы и связаны с рассеянием энергии.
Мера необратимого рассеяния энергии – энтропия S.
Энтропия — это мера беспорядка. Как определить беспорядок? Один из способов – приписать каждому состоянию число вариантов, которыми это состояние можно реализовать. И чем больше таких способов реализации, тем больше значение энтропии. Чем больше организованно вещество (его структура), тем ниже его неопределённость (хаотичность).

Изменение энтропии показывает, какое количество энергии беспорядочно рассеивается в окружающую среду в виде теплоты (при определенной температуре).
Второй закон термодинамики
Второе начало (закон) термодинамики позволяет выделить фактически возможные процессы в термодинамической системе, установить направление протекания самопроизвольных процессов, найти предельное (наибольшее или наименьшее) значение энергии, которое может быть полезным образом использовано.
Существует несколько формулировок второго закона термодинамики.
Рудольф Клаузиус, немецкий физик, механик и математик:
«Теплота сама собой не может переходить от тела холодного к телу горячему».
Это утверждение, которое Клазиус назвал «тепловой аксиомой», было сформулировано в 1850 г. в работе «О движущей силе теплоты и о законах, которые можно отсюда получить для теории теплоты». «Само собой теплота передаётся лишь от тела с более высокой температурой к телу с меньшей температурой. В обратном направлении самопроизвольная передача теплоты невозможна».
Уильям Томсон (Кельвин), британский физик и механик:
«Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара».
То есть, нельзя создать циклически работающий двигатель, в результате действия которого производилась бы положительная работа за счет его взаимодействия лишь с одним источником теплоты. Ведь если бы это было возможно, тепловой двигатель мог бы работать, используя, например, энергию Мирового океана и полностью превращая её в механическую работу. В результате этого происходило бы охлаждение океана за счёт уменьшения энергии. Но как только его температура оказалась бы ниже температуры окружающей среды, должен был бы происходить процесс самопроизвольной передачи тепла от более холодного тела к более горячему. А такой процесс невозможен. Следовательно, для работы теплового двигателя необходимо хотя бы два источника теплоты, имеющих разную температуру.
Вечный двигатель второго рода
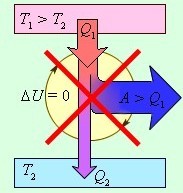
В тепловых двигателях теплота превращается в полезную работу только при переходе от нагретого тела к холодному. Чтобы такой двигатель функционировал, в нём создаётся разность температур между теплоотдатчиком (нагревателем) и теплоприёмником (холодильником). Нагреватель передаёт теплоту рабочему телу (например, газу). Рабочее тело расширяется и совершает работу. При этом не вся теплота превращается в работу. Часть её передаётся холодильнику, а часть, например, просто уходит в атмосферу. Затем, чтобы вернуть параметры рабочего тела к первоначальным значениям и начать цикл сначала, рабочее тело требуется нагреть, то есть от холодильника необходимо отнять теплоту и передать её нагревателю. Это означает, что нужно передать теплоту от холодного тела к более тёплому. И если бы этот процесс можно было осуществить без подвода энергии извне, мы получили бы вечный двигатель второго рода. Но так как, согласно второму закону термодинамики, сделать это невозможно, то невозможно и создать вечный двигатель второго рода, который полностью превращал бы теплоту в работу.
Эквивалентные формулировки второго закона термодинамики:
1. Невозможен процесс, единственным результатом которого является превращение в работу всего количества теплоты, полученного системой.
2. Невозможно создать вечный двигатель второго рода.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.