
|
Предмет: Физика |
ФИО учителя: |
|||||||
|
Дата: |
Класс: 10 |
Количество учащихся: |
||||||
|
Раздел долгосрочного плана |
Газовые законы
|
|||||||
|
Тема урока |
Изопроцессы. Графики изопроцессов.
|
|||||||
|
Предварительные знания |
8 класс: структуры твердых тел, жидкостей и газов; броуновское движение; давление газа; p = F/A; передача тепловой энергии; передача тепла от горячего к холодному; тепловое равновесие; простая молекулярно-кинетическая модель. 9 класс: законы механики Ньютона и сохранение момента импульса |
|||||||
|
Цели обучения, которые достигаются на данном уроке |
10.3.2.2 - исследовать зависимость давления от объема газа при постоянной температуре (закон Бойля-Мариотта); 10.3.2.3 - исследовать зависимость объема газа от температуры при постоянном давлении (закон Гей-Люссака); 10.3.2.4 - исследовать зависимость давления от температуры газа при постоянном объеме (закон Шарля); 10.3.2.5 - применять газовые законы при решении расчетных и графических задач; |
|||||||
|
Цели урока |
Учащиеся будут: знать газовые законы; уметь объяснять законы с молекулярной точки зрения; изображать графики процессов; уметь решать графические и аналитические задачи, используя уравнение состояния и газовые законы; уметь анализировать, выделять общие и отличительные свойства, выявлять закономерности; |
|||||||
|
Критерии успеха |
Учащиеся знают газовые законы; Решают задачи с использованием газовых законов; Объясняют газовые законы на основе МКТ |
|||||||
|
Языковые цели |
Учащиеся могут: -описывать письменно и устно изопроцессы и графики изопроцессов. Специальная предметная лексика и терминология: микроскопический; макроскопический; идеальный газ; объем газа; давление газа; температура газа; изотермический процесс; изобарный процесс; изохорный процесс; изотерма; изобара; изохора. |
|||||||
|
Привитие ценностей |
Развивать самостоятельность, выработать необходимые навыки для обучения на протяжении всей жизни. Ключевые элементы глобального гражданства: умение вести диалог, конструктивно взаимодействовать с другими людьми. |
|||||||
|
Межпредметные связи |
Предмет |
Этап |
||||||
|
химия, биология и математика |
Решение задач. |
|||||||
|
Дифферен циация |
-в подборе заданий: разно уровневые вопросы для учащихся; -в подборе учебного материала и ресурсов с учетом индивидуальных способностей учащихся. -выдача домашнего задания |
|||||||
|
Навыки использования ИКТ |
поиск информации на сайтах http://fizmat.
|
|||||||
|
Ход урока |
||||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке |
Ресурсы |
||||||
|
Начало урока 3 мин |
Вместе с учащимися определяются · Тема и цели урока
|
Презентация к уроку |
||||||
|
Середина урока 6 мин
|
Актуализация знаний. Фронтальный опрос:
|
Презентация к уроку
|
||||||
|
15 мин |
(W, Е) Учащиеся проводят виртуальные эксперименты в группах. Изучают предложенный им теоретический материал для описания изопроцессов. Готовят презентации. Готовят вопросы для других групп. Оценивание в группах.
|
http://www.marklv.narod.ru/mkt/str7.htm Приложение 1 Теоретический материал к уроку Анимация изопроцессов http://fizicus.ucoz.ru/index/fizika_v_animacijakh/0-16
|
||||||
|
15 мин |
(I/f) Решение задач. Учащиеся решают графические задачи и аналитические задачи на изопроцессы индивидуально. Выявление сложных вопросов. Дифференцированная работа. Оказание поддержки учащимся, у которых возникли сложности при решении.
|
Раздаточный материал к уроку |
||||||
|
3 мин |
Взаимооценивание в парах. |
|
||||||
|
Конец урока 2 мин
|
Рефлексия.
|
|
||||||
|
1 мин |
Выдача дифференцированного домашнего задания (уровневые задачи ) Учащиеся по желанию могут подготовить сообщения и рефераты на применение газовых законов в быту и технике. |
http://www.marklv.narod.ru/mkt/str7.htm |
||||||
Приложение 1. Теоретический материал к уроку
Уравнение состояния идеального газа связывает между собой три макроскопических параметра: р, Т и V. Но при любых ли процессах все эти параметры изменяются?
Изопроцесс – процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными.
Изотермический процесс. Закон Бойля-Мариотта.
Первый газовый закон был открыт английским ученым Бойлем в 1662 году. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал давление газа в зависимости от объёма при постоянной температуре. Данный процесс называется изотермическим.
Имя французского аббата Эдма Мариотта в названии закона появилось в 1676 году благодаря его работе “Речь о природе воздуха”, в которой были описаны опыты, аналогичные экспериментам Бойля. Поэтому закон получил название закона Бойля-Мариотта.

Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно.
Затем рисуется график, даётся его название - изотерма. При построении графиков проводится аналогия с соответствующим разделом из математики.
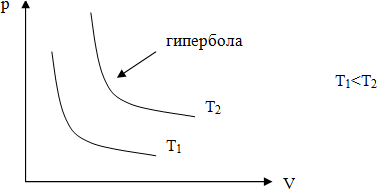
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине.
Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и вследствие образовавшегося перепада давлений происходит вдох. Другими словами воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выравниваются.
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
Изобарный процесс. Закон Гей-Люссака.
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. Первооткрыватель - Жозеф Луи Гей-Люссак (1802 год).

Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.
Рисуется график, даётся его название и отмечается, что зависимость (V/T) представляет собой tg угла наклона прямой к оси T.
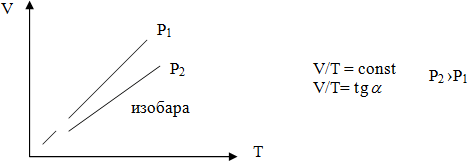
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Изохорный процесс. Закон Гей-Люссака.
В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.

Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Рисуется график, даётся его название.
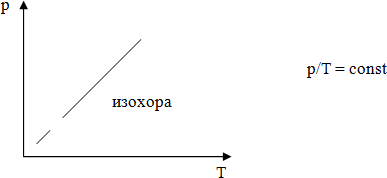
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.