
Предмет химии
Химия изучает состав, свойства и превращения веществ, а также явления, которые сопровождают эти превращения.
Одно из первых определений химии как науки дал великий русский ученый М.В. Ломоносов: «химическая наука рассматривает свойства и изменения тел…состав тел…объясняет причину того, что с веществами при химических превращениях происходит».
Атомно-молекулярное учение развил и впервые применил в химии русский ученый М.В. Ломоносов в 1741году.
Положения Атомно-молекулярное учение
1.все в-ва состоят из молекул
2.молекулы состоят из атомов
3.молекулы и атомы находятся в непрерывном движении, между ними существуют силы притяжения и отталкивания.
Свое оригинальное и очень точное определение химии дал другой великий русский химик Д.И. Менделеев в знаменитой книге «Основы химии». По Менделееву, химия – это учение об элементах и их соединениях.
Химия относится к естественным наукам, которые изучают окружающий нас мир. Она тесно связана с другими естественными науками: физикой, биологией, геологией. Многие разделы современной науки возникли на стыке этих наук: физическая химия, геохимия, биохимия. Химия тесно связана также с другими отраслями науки и техники. В ней широко применяются математические методы, используются расчеты и моделирование процессов на электронно-вычислительных машинах.
В современной химии выделилось много самостоятельных разделов, наиболее важные из которых, кроме отмеченных выше, неорганическая химия, органическая химия, химия полимеров, аналитическая химия, электрохимия, коллоидная химия и другие.
Объектом изучения химии являются вещества.
Обычно их подразделяют на смеси и чистые вещества.
Среди последних выделяют простые и сложные.
Общая химия рассматривает основные химические понятия, а также важнейшие закономерности, связанные с химическими превращениями.
Неорганическая химия изучает свойства и превращения неорганических (минеральных) веществ.
Органическая химия изучает свойства и превращения органических веществ.
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Химия – наука о свойствах вещества и его превращениях, она включает в себя законы и принципы, описывающие эти превращения, а также представления и теории, позволяющие дать им объяснение. (записать)
Вещество – вид материи, которая обладает массой покоя.
Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Такие вещества принято подразделять на простые и сложные (хим. соединения).
Простые вещества образованы атомами одного хим. элемента и потому являются формой его существования в свободном состоянии, напр. Сера, железо, озон, алмаз.
Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды).
Молекула - наименьшая частица данного вещества, обладающая его химическими свойствами.
Атом – электронетральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Различным элементам соответствуют различные атомы, обозначаемые символом данного элемента (Ag, Fe, Mg).
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.В настоящее время известно 118 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называют катионами (от греч. kation, буквально – идущий вниз), отрицательные – анионами (от греч. anion, буквально идущий вверх). В свободном состоянии существуют в газовой фазе (в плазме).
Валентность – определяется числом химических связей, которыми данный атом соединен с другим.
Степень — окисления- это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
Все что нас окружает – это вещества. А что такое вещества?
Вещества – это совокупность атомов химически связанных друг с другом.
Химические вещества подразделяются на простые и сложные.
Простые вещества- молекулы, состоят из атомов одного и того же элемента (например, простое вещество уголь (С) образовано атомами элемента углерода, железо (Fe) – атомами элемента железа, азот (N2) – атомами элемента азота, кислород (O2) – атомами элемента кислорода и т.д.).
И химический элемент, и простое вещество, как правило, имеют одно название. Как их отличить?
Рассмотрим два примера:
1) В состав молекулы воды (Н2О) входит кислород – это элемент (обозначение – О).
2) Воздух каким Мы дышим, содержит кислород – это вещество (обозначение - О2).
Все металлы и некоторые неметаллы имеют одинаковое обозначение, например, железо (Fe) и элемент, и вещество.
Сложные вещества - молекулы, состоят из атомов различных химических элементов.
Смеси состоят из нескольких веществ, каждое из которых сохраняет свои индивидуальные свойства и может быть выделено в чистом виде.
Смеси могут быть гомогенными (однородными) и гетерогенными (неоднородными). Примером гомогенной смеси могут служить растворы, гетерогенной – бетон, смесь сахара и соли и т.д.
Так, оксид меди (II) (CuO) образован атомами элементов меди (Cu) и кислорода (О), вода (Н2О) – атомами элементов водорода (Н) и кислорода (О). Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурами плавления и кипения и т.п. Эти свойства относятся к совокупности атомов, и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером), степенью окисления, изотопным составом и т.д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода – озон).
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества – аллотропными видоизменениями или модификациями (изотопы).
Так, элемент кислород образует две аллотропные модификации – кислород и озон; элемент углерод – три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле (например, кислород О2 и озон О3)
2) образованием различных кристаллических форм (например, алмаз, графит и карбин).
Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами, называются изотопами.
Каждый изотоп
характеризуется двумя величинами: массовым числом (проставляется вверху
слева от химического знака) и порядковым номером (проставляется внизу
слева от химического знака) и обозначается символом соответствующего элемента.
Так, кислород имеет изотопы с массовыми числами 16, 17, 18: ![]()
Водород имеет три изотопа: протий ![]() , дейтерий
, дейтерий ![]() ,
тритий
,
тритий ![]() .
.
Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом их распространенности.
Все химические элементы имеют не менее двух изотопов – явление изотопии.
Элементы принято обозначать химическими знаками (символами). Состав сложных веществ изображается при помощи химических формул.
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Для выражения состава вещества используется молекулярная формула – отображающая число атомов элементов в молекуле.
Например,
1) формула СО2 показывает, что это углекислый газ; 1 моль его образован из 1 моль атома углерода и 2 моль атомов кислорода, соотношение 1 : 2 (СО2);
2) формула Н2О2 показывает, что это перекись водорода; 1 моль его образован из 2 моль атомов водорода и 2 моль атомов кислорода, соотношение 1 : 1 (НО);
3) формула С6Н6 показывает, что это бензольное кольцо; 1 моль его образовано из 6 моль атомов углерода и 6 моль атомов водорода, соотношение 1: 1 (СН);
4) формула H2SO4 показывает, что это серная кислота; 1 моль ее образован из 2 моль атомов водорода, 1 моль атомов серы и 4 моль атомов кислорода, соотношение 2:1:4.
Структурная формула – указывает порядок (последовательность) соединения атомов в молекуле и число связей между атомами.
Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, и при этом не происходит изменения состава ядер атомов, называются химическими.
Окисление на воздухе, горение, получение металлов из руд, ржавление железа – все это химические явления. Иначе их называют химическими превращениями, химическими реакциями или химическими взаимодействиями.
Следует различать химические и физические явления.
При физических явлениях изменяется форма или физическое состояние веществ или образуются новые вещества за счет изменения состава ядер атомов.
Например, при взаимодействии газообразного аммиака с жидким азотом аммиак переходит вначале в жидкое, а затем в твердое состояние. Это не химическое, а физическое явление, так как состав веществ (и азота, и аммиака) не меняется.
Химические явления всегда сопровождаются физическими. Например, при сгорании магния выделяются теплота и свет, в гальваническом элементе в результате химических реакций возникает электрический ток.
Химическая реакция - это превращение веществ, сопровождающаяся изменением их состава и (или) строения (бывает изменяется состав, бывает изменяется строение, а иногда бывает, что изменяется и состав, и строение). Например, реакция нейтрализации – сопровождается и изменением состава, и изменением строения.
Схема реакции – это запись химической реакции с помощью формул исходных веществ и продуктов реакции.
NaOH + H2SO4 → Na2SO4 + H2O
Химические уравнения реакций записывают с помощью химических формул и знаков. Они служат для изображения химических реакций и отражают закон сохранения массы веществ. В каждом уравнении имеется две части, соединенные знаком равенства. В левой части записывают формулы веществ, вступающих в реакцию, в правой – формулы веществ, образующихся в результате реакции. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Относительной атомной массой (Ar) химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12С или
Относительная атомная масса (Ar) – это величина показывающая, во сколько раз атомная масса данного элемента больше, чем а.е.м.
Атомная масса (А) – это число, показывающее, во сколько раз масса данного атома больше 1/12 массы атома самого легкого изотопа углерода (г, кг, т).
Например:
Ar(H) = ![]() Ar(O) =
Ar(O) = ![]() .
.
Относительная атомная масса – одна из основных характеристик химического элемента. Современные значения атомных масс приведены а периодической системе элементов Д.И. Менделеева.
Относительная молекулярная масса (Mr) – показывает во сколько раз молекулярная масса вещества больше, чем атомная единица массы (а.е.м.).
Молекулярная масса (М) – это масса одной молекулы.
Относительная молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества.
Например, Mr(Н2О) слагается из
2Ar(H) = 2*1,00797 = 2,01594
Ar(O) = 1*15,9994 = 15,9994
Mr(Н2О) = 18,01534
Значит, относительная молекулярная масса воды равна 18,01534 или, округленно, 18.
Моль – это количества вещества (ɣ или n), содержащее столько структурных единиц (молекул, атомов, ионов, электронов и других), сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Зная массу одного атома углерода (1,993*10-26кг),
можно вычислить число атомов NA в 0,012 кг углерода: NA = ![]()
Это число называется постоянной Авогадро (обозначение NA, размерность 1/моль), показывает число структурных единиц в 1 моль любого вещества.
Молярная масса – это величина, равная отношению массы вещества к количеству вещества (кг/моль, г/моль).
Численно молярная масса вещества равна относительной молекулярной массе.
Так, если масса молекулы воды равна 2,99*10-26 кг, то молярная масса Mr(Н2О) = 2,99*10-26кг *6,02*10231/моль = 0,018кг/моль, или 18г/моль.
Количество вещества ɣ(n) = ![]() ; M = m/ ɣ; m = M* ɣ
; M = m/ ɣ; m = M* ɣ
Масса и количество вещества – понятия разные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
Существуют 4 типа уравнений реакций.
Основные законы химии
1.Закон сохранения массы вещества (М.В.Ломоносов,1748; французский ученый Антуан Лоран Лавуазье,1789): масса всех веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции (продуктов реакции). Этот закон является частным случаем общего закона сохранения энергии. В механических и ядерных процессах соблюдается только в том случае, если энергия не рассеивается.
С точки зрения атомно- молекулярного учения закон сохранения массы объясняется так: в результате химической реакции атомы не исчезают и не возникают из ничего, а происходит лишь их перегруппировка. А так как число атомов до реакции и после реакции остается неизменным, то и их общая масса также не изменяется.
Каждое химическое уравнение символизирует закон сохранения массы вещества и закон сохранения энергии:
∑mпродуктов = ∑m реагентов
Например: H2SO4 + 2NaOH = Na2SO4 + 2H2O + 115 kДж
98 г + 80г = 142г + 36г
178 = 178
2. Закон постоянства состава (французский ученый Жак Пруст; 1808)
Современная формулировка закона: всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Ограниченность закона состоит в том, что он справедлив только для жидких и газообразных соединений с молекулярной структурой (например, SO2, SO3, NH3 ,CH4,H2O и др.).
Например, углерод и кислород соединяются только в соотношении С:О =12:16, т.е.3 : 4 (СО – угарный газ) и С:О = 12:32, т.е. 3:8 (СО2 – углекислый газ) Ни в каких других соотношениях они не соединяются.
Состав воды независимо от способа получения (синтезом, нейтрализацией, конденсацией и т. д.) имеет качественный и количественный состав: водорода Н – 11,19% и кислорода 88, 81%. Однако, нужно учитывать и изотопный состав. В тяжелой воде водорода ( 2Н – дейтерия) – 20%.
3. Закон кратных отношений (английский ученый Джон Дальтон, 1803) :
Если два элемента образуют несколько соединений, то массы одного из элементов в разных соединениях относятся между собой как целые числа. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях.
4. Закон объёмных отношений. Этот закон в качестве обобщения вывел французский ученый Гей-Люссак (второе название закона – «химический»). Объёмы вступающих в реакцию газов при одинаковых условиях ( температуре, давлении)относятся друг к другу как простые целые числа. Так, например, при взаимодействии 2 объёмов водорода и 1 объёма кислорода, образуются 2 объёма водяного пара.
5. Закон Авогадро.(1811) В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает три следствия:
1. Один моль вещества в любом состоянии содержит одинаковое число молекул (или атомов)
NA= 6,022 ∙ 1023(число Авогадро)
2. Один моль любого газа при нормальных условиях занимает объем, равный 22,4 л.
Этот объем называют молярным объемом газа (Vm): Vm = 22,4 л
3. Массы различных газов, занимающих одинаковый объем, относятся между собой как их молярные массы
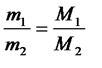 приV1 = V2
приV1 = V2
Относительная плотность газа – D; ![]()
Обычно плотность газа определяют по отношению к водороду (DH ) или воздуху (Dвозд.).
М газа = 2DH ;М газа = 29Dвозд
На основании газовых законов Р. Бойля – Э. Мариотта, 1662 г. (pV =const при изотермических условиях), Ж. Шарля – Ж. Гей-Люссака, 1802 г. (вскрывает зависимость объема газа от его температуры при постоянном давлении – при изобарных условиях):
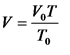
и закона А. Авогадро выводится объединенный закон газового состояния, выражением которого является уравнение состояния идеального газа*:
![]()
Это уравнение легко преобразовать в уравнение Клапейрона – Менделеева, 1874 г.
![]()
гдеR – универсальная газовая постоянная. Её численное значение зависит от единиц измерения объема и давления, например: R = 8,314 Дж/моль∙К = 62360 мм рт. ст.∙мл / моль∙К.
* Идеальный газ – это газ, поведение которого «идеально»: его молекулы не имеют объема, не взаимодействуют друг с другом, движутся быстро, прямолинейно и не теряют энергию при столкновениях. Многие реальные газы ведут себя подобным образом при условии, если молекулы газа малы и расположены далеко друг от друга.
6. Закон эквивалентов. Отношение масс (или объёмов)
взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным
массам (объёмам).
Математически это можно записать следующим образом: ![]()
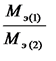
Из последнего соотношения следует:
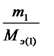
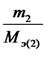 ,
,
т.е. число моль эквивалентов вступающих в реакцию или образующихся в результате реакции веществ равны между собой:
nэ 1 = nэ 2
Количественным выражением закона эквивалентов для реакций, протекающих в растворах, является соотношение:
![]() ,
,
где сн – нормальная концентрация вещества (молярная концентрация эквивалента).
Раствор, содержащий в одном литре один моль эквивалентов растворенного вещества, называется однонормальным (1,0 н.), 0,1 моль эквивалентов - децинормальным (0,1 н.), 0,01 моль эквивалентов – сантинормальным (0,01 н.)
Приближенное значение мольной массы атомов элемента позволяет определить правило Дюлонга и Пти: Атомная теплоёмкость большинства простых веществ в твёрдом состоянии лежит в пределах 22-29 Дж/(моль*К) [в среднем около 26 Дж/(моль*К)]. Отсюда следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определить приближённое значение мольной массы атомов соответствующего элемента.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.