
Инструктивная карта по теме «Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики».
Цель обучения:
- знать формулировку второго закона термодинамики;
- объяснять смысл второго закона термодинамики;
- применять второй закон термодинамики при анализе термодинамических процессов.
(W) Задание 1.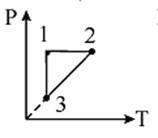 Обсуждение
структурной задачи.
Обсуждение
структурной задачи.
На графике представлен процесс перехода идеального газа постоянной массы из состояния 1 -2-3-1. В первом состоянии газ находится под давлением 0,8*105 Па, занимая объем 5 м3. Находясь в 3 состоянии он занимает объем в два раза больше чем в первом и имеет температуру 800 К.
(I) Определить количество вещества данного газа
(II) Определить температуру газа и объем во втором состоянии.
(III) Определить объем газа в состоянии 3.
(IV) Какую работу совершил газ во время изобарного расширения?
(G) Задание 2.Решите задание в парах
Предположим, что чашка кофе температурой 80 0С охлаждаясь в комнате температурой 20 0С, теряет 1000 Дж тепла Q.А) Определите изменение энтропии ΔS чашки кофе.
В) Определите изменение энтропии ΔS воздуха в комнате.
С) Определитеполную энтропию системы.
(G) Задание 3.Решите тестовое задания в парах:
1.Необратимый процесс - это
a) процесс, который может происходить как в прямом, так и в обратном направлении
b) процесс, обратный которому самопроизвольно не происходит
c) процесс, происходящий без воздействия внешних тел
2. Выберите формулировку, не относящуюся ко второму закону термодинамики
a) Количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы.
b) Теплота сама по себе не может перейти от более холодного тела к более теплому
c) В природе невозможен процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара
d) Невозможно сконструировать машину, которая будет только переносить теплоту с более холодного тела на более теплое
3. Второе начало термодинамики отражает...
a) направленность термодинамических процессов в замкнутых системах
b) сохранение энергии в термодинамических процессах
c) превращение энергии из одного вида в другой в термодинамике
d) способность внутренней энергии самопроизвольно преобразовываться в работу
(I) Задание 4.Проверь себя! Решите задачи самостоятельно.
1. Определите изменение энтропии при плавлении 63,5 г меди, если теплота плавления меди равна 12980 Дж/моль, а температура плавления меди 1083 °С.
2. Используя справочные данные, рассчитайте изменение энтропии при протекании реакции при стандартных условиях H2SO4 + 3H2S = 4S + 4H2O.
(G) Задание 5.Обсудите совместно и решите задания в парах и сверьте свои ответы с ответами соседней пары, докажите правильность и ложность утверждений
Определите, какие утверждения являются истинными, а какие - ложными.
1. Газу сообщили теплоту 200 Дж, и он совершил работу 700 Дж. Внутренняя энергия газа увеличивается на 500 Дж.
2. Газ получил количество тепла 1300 Дж, изменение его внутренней энергии составляет 600 Дж. В этом случае газ совершил работу 700 Дж.
3. Над газом внешние силы совершали работу 500 Дж, в то же время он отдал окружающим телам 300 Джтепла. Внутренняя энергия увеличилась на 0,2 кДж.
4. Газ получил 600 Д тепла в процесс теплопередачи, совершив работу 0,05 кДж. Внутренняя энергия газа увеличилась на 550 Дж.
5. В результате адиабатического расширения внутренняя энергия газа уменьшилась на 0,8 МДж, газ совершил работу 800 кДж.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.