
Карбоновые кислоты
Карбоновые кислоты — производные углеводородов, в молекулах которых содержатся карбоксильные группы
![]()
Дополнительная информация
Что такое карбоксил?
Что такое карбоксил?
Карбоксильная группа (карбоксил) — сложная функциональная группа, состоящая из карбонила и гидроксила:
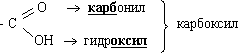
Классификация карбоновых кислот R(COOH)n
|
По природе R |
По числу групп —COOH |
|
Предельные |
Одноосновные |
|
CH3–CH2–COOH пропановая (пропионовая) CH3–CH2–CH2–COOH бутановая (масляная) |
HCOOH
метановая CH3COOH
этановая |
|
Непредельные |
Двухосновные |
|
CH2=CH–COOH пропеновая (акриловая) |
HOOC–COOH этандиовая (щавелевая) HOOC–CH2–COOH пропандиовая (малоновая) |
|
Ароматические |
Другие многоосновные |
|
|
Общая формула одноосновных
карбоновых кислот: 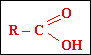
Общая формула предельных одноосновных карбоновых кислот:CnH2n+1COOH (n ≥ 0)
Первые три члена этого гомологического ряда не имеют изомеров внутри класса, для других возможна изомерия углеродной цепи:
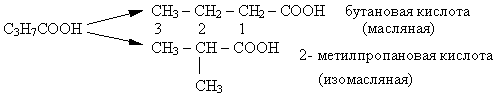
Обратите внимание на то, что:
· международные названия кислот составляют добавлением к названию соответствующего алкана окончания –овая и слова кислота;
· тривиальные названия карбоновых кислот и соответствующих альдегидов подобны (НСНО — муравьиный альдегид, НСООН — муравьиная кислота; СН3СНО — уксусный альдегид, СН3СООН — уксусная кислота).
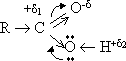
Электронное строение карбоновых кислот обусловлено наличием и влиянием друг на друга двух функциональных групп:
гидроксильной O—H и карбонильной C=O.
Результатом взаимного влияния двух функциональных групп (карбонильной C=O и гидроксильной O—H) является:
Ансамбль "не в коня корм"
·
увеличение
полярности связи O![]() H и подвижности
атома водорода по сравнению со спиртами;
H и подвижности
атома водорода по сравнению со спиртами;
· уменьшение полярности связи C=O и увеличение ее прочности по сравнению с альдегидами.
Дополнительная информация
Электронное строение и кислотные свойства
Электронное строение и кислотные свойства
Карбоксильная группа содержит
сильнополяризованную карбонильную группу ![]()
Атом С с частичным положительным зарядом притягивает к себе неподеленную пару электронов от атома кислорода группы OH. Электронная плотность на атоме кислорода понижается, вместе с тем увеличивается полярность связи O ← H и водород легче отщепляется в виде протона.
![]()
Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы.
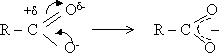
Делокализация стабилизирует карбоксилат-ион.
Это интересно!
Щавелевая кислота HOOC — COOH содержится в лиственных растениях, например в ревене, шпинате, щавеле в виде калиевой соли, а кальциевая соль — составная часть некоторых почечных камней.
Это интересно!
Янтарная кислота HOOC—CH2—CH2—COOH присутствует в свободном виде как в растениях, так и в животных, а также содержится в окаменевшей смоле — янтаре.

Янтарь
Это интересно!
Бензойная кислота C6H5COOH встречается в свободном виде в некоторых смолах, особенно в бензойной смоле и в «драконовой крови».
Заметное количество бензойной кислоты содержится в клюкве, бруснике, морошке. Бензойная кислота — прекрасный природный консервант, поэтому эти ягоды можно хранить без особых ухищрений почти целый год.
В виде бензилового эфира она входит в состав перуанского бальзама.

Брусника и клюква
Это интересно!
Муравьиную кислоту содержит жалящая жидкость медуз, крапивы, муравьев.

Физические свойства

В твердом, жидком (а иногда газообразном) состоянии молекулы карбоновых кислот образуют димеры, соединяясь попарно двумя водородными связями:
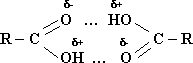
Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот выше температур кипения соответствующих спиртов.
Образованием водородных связей с водой объясняется и растворимость низших карбоновых кислот.
Это интересно!
В малых количествах пропионовая кислота обнаружена в молоке, масле, сырах, древесной смоле.
Химические свойства
Карбоновые кислоты — слабые электролиты
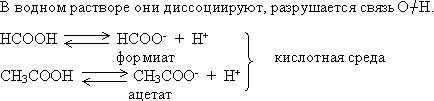
Кислотная среда водного раствора уксусной кислоты обнаруживается с помощью индикаторов: универсального, лакмуса, метилоранжа.
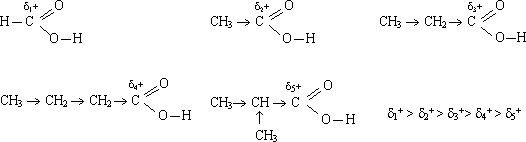
С увеличением R сила карбоновых кислот уменьшается.
Дополнительная информация
Сила карбоновых кислот
Сила карбоновых кислот
Кислотные свойства спиртов выражаются только в одной реакции — взаимодействии с очень активными металлами, например с натрием.
Алкильные радикалы, начиная с метильного в уксусной кислоте, отталкивая электроны С—С связи, уменьшают положительный заряд на атоме углерода карбоксильной группы, это в свою очередь уменьшает полярность связи O—H. Поэтому кислотные свойства в представленном ниже ряду ослабляются:
Карбоновые кислоты, как и неорганические, взаимодействуют с:
· металлами до H2 (в электрохимическом ряду напряжений)
![]() ;
;
· основными оксидами
![]() ;
;
· основаниями (и амфотерными гидроксидами)
![]() ;
;
· солями более слабых кислот
![]() .
.
NaHCO3 — гидрокарбонат натрия (питьевая сода). Уравнение реакции отражает известный в быту процесс — «гашение» соды.
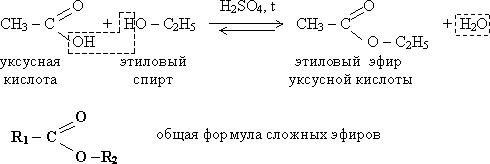
Этерификация
Реакция
этерификации —
это межмолекулярная дегидратация при взаимодействии кислот и спиртов с
образованием сложных эфиров (разрушается связь С![]() O).
O).
Галогенирование (замещение атомов H в радикале)
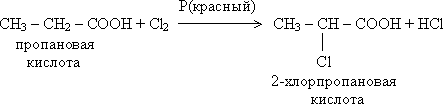
Особенно легко замещение происходит в углеводородном звене, ближайшем к карбоксилу.
Подведем итоги
Выделим реакционные центры в молекулах карбоновых кислот и укажем, какие свойства с ними связаны:
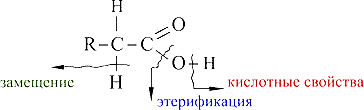
Реакции присоединения с участием карбонильной группы не характерны, т. к. двойная связь по сравнению с альдегидами более прочная.
Дополнительная информация
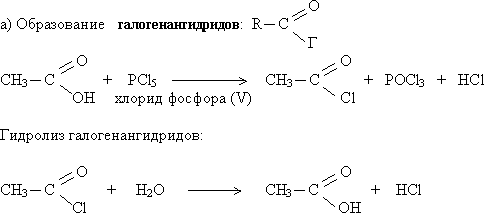
Реакции образования функциональных производных карбоновых кислот
Реакции образования функциональных производных карбоновых кислот
Функциональные производные карбоновых кислот — это соединения, в которых гидроксильная группа замещена на какую-либо иную группу или атом:
![]()
Общим свойством всех функциональных производных карбоновых кислот является то, что они гидролизуются с образованием исходной кислоты.
Сложные эфиры тоже функциональные производные кислот, однако реакция этерификации ввиду ее важности рассматривалась отдельно.
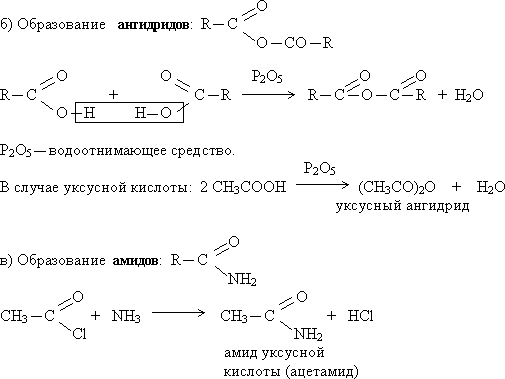
Это интересно!
Капроновая кислота CH3—(CH2)4—COOH входит в состав козьего жира (латинское caper — «коза»).
Это интересно!
Валериановая кислота CH3—(CH2)3—COOH есть в растении под названием «валериана».

Валериана
Это интересно!
С помощью бактерий, выделяющих пропионовую кислоту, можно уберечь силос от гниения.
Это интересно!
Масляная кислота CH3—CH2—CH2—COOH является низшей кислотой, содержащейся в виде сложного эфира с глицерином в масле. А в свободном виде она обнаружена в грибах и в потовых выделениях, имеет отвратительный запах. Латинское butyrum — «масло» — дало название масляной кислоте.
Отдельные представители карбоновых кислот
Муравьиная кислота HCOOH
|
|
·
Самая
сильная из одноосновных |
· Вещество с двойственной функцией:
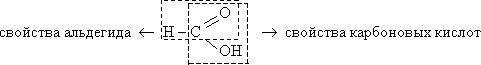
Легко окисляется аммиачным раствором оксида серебра:
![]()
· Применяется как консервант фруктовых и овощных полуфабрикатов, дезинфицирующее средство, сырье для получения сложных эфиров.
Уксусная кислота CH3COOH
· 3 — 9% раствор — уксус, 70 — 80% раствор — уксусная эссенция, применяется как консервант в пищевой промышленности.
· Растворитель многих органических веществ.
· Сырье в производстве красителей, лекарств, душистых веществ, гербицидов и др.
Высшие предельные карбоновые кислоты
C15H31COOH — пальмитиновая кислота.
C17H35COOH — стеариновая кислота.
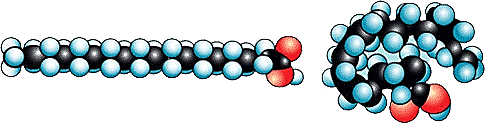
Модель стеариновой кислоты
Натриевые и калиевые соли этих кислот (пальмитаты C15H31COONa, C15H31COOK; стеараты C17H35COONa, C17H35COOK) хорошо растворимы в воде, обладают моющим действием и являются основой твердого и жидкого мыла соответственно.
Олеиновая кислота C17H33COOH
Олеиновая кислота — вещество с двойственной функцией (непредельная карбоновая кислота).
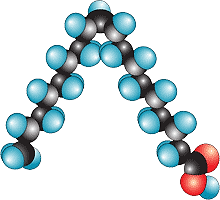
Это жидкость, в отличие от стеариновой кислоты, с более слабым межмолекулярным взаимодействием, что обусловлено строением ее молекул, которые имеют цис-форму:
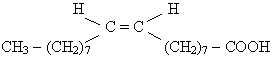
Высшие предельные и непредельные карбоновые кислоты входят в состав природных жиров, поэтому их называют жирными.
Это интересно!
Чем только в старину не лечились! Человека, страдающего радикулитом, сажали на потревоженный муравейник. Разъяренные муравьи (вернее, муравьиная кислота) быстро приводили его в движение. Говорят, эффект был стойким.
Это интересно!
Мы часто в прямом и переносном смысле употребляем фразу «нюх как у собаки». Она не лишена основания: собака улавливает запахи в концентрации, недоступной не только обонянию человека, но и современным приборам. Например, она может уловить запах масляной кислоты, если в 1 см3 воздуха содержится всего 9000 молекул этого вещества, т. е. всего 9000 / 6 · 1023 = 1,5 · 10-20 моль вещества!
Это интересно!
Мировое производство уксусной кислоты (только для непищевых целей) составляет около 4 млн т/год!
Общие способы получения
Каталитическое окисление кислородом воздуха:

Напомним, что в схемах реакций часто используют символ [O], он означает условную запись окислителя.
В лабораторных условиях окислителем альдегидов, как вы знаете, могут быть аммиачный раствор оксида серебра Ag2O и свeжеприготовленный гидроксид меди (II) Cu(OH)2.
Напишите уравнения реакций получения уксусной кислоты окислением алкана, спирта, альдегида.
Ответ
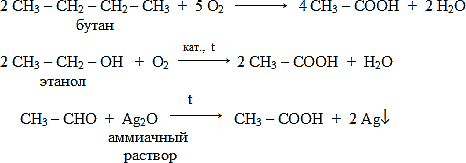
Другие способы получения карбоновых кислот

Это интересно!
Еще в XVI веке было обнаружено, что выделяющийся из муравейников «кислый пар» изменяет синий цвет растительных красителей на красный. Неудивительно, что Дж. Рей, впервые получив новую кислоту перегонкой … муравьев, назвал ее муравьиной.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.