
4-Mavzu. Kationlarning uchunchi, toʻrtinchi va beshinchi analitik guruhining nazariy asoslari. Reja:
Kationlarning uchinchi analitik guruhiga umumiy tavsif va birikmalarining biologik ahamiyati.
Guruh reagentining ta’siri va shaxsiy reaksiyalari.
Tuzlarning gidrolizi, sifat tahlildagi roli va qoʻllanilishi.
 Asoslarning
amfoterligidan, oksidlanish-qaytirilish reaksiyalaridan va qoʻsh, kompleks
tuzlarining hosil boʻlishidan tahlil jarayonida foydalanish. Kationlarning
toʻrtinchi analitik guruhiga umumiy tavsif, guruh reagenti va shaxsiy
reagentining ta’siri.
Asoslarning
amfoterligidan, oksidlanish-qaytirilish reaksiyalaridan va qoʻsh, kompleks
tuzlarining hosil boʻlishidan tahlil jarayonida foydalanish. Kationlarning
toʻrtinchi analitik guruhiga umumiy tavsif, guruh reagenti va shaxsiy
reagentining ta’siri.
Tio- va sulfo- birikmalarining hosil boʻlishi, ularning xossalari va qishloq xo’jaligidagi ahamiyati.
III gruppa kationlariga Al3+, Cr3+,Fe3+, Fe2+,Ni2+, Co2+, Mn2+, Zn2+ ionlari kiradi.
Ularning ko`pchiligi, birinchi va ikkinchi guruh kationlaridan farqli ravishda suvdagi eritmalarda rangli bo`ladi. Shuningdek, uchinchi guruh kationlarining sulfidlari suvda erimaydi, ammo kuchli kislotalarning suyultirilgan eritmalarida eriydi.
(NH4)2S tuzi uchun guruh kationlari uchun guruh reaktivi sifatida ishlatiladi. Al3+va Cr3+ ionlarining sulfidlari Al2S3 va Cr2S3 gidrolizlanib, Al(OH)3va Cr(OH)3 gidroksidlar holida cho`kmaga tushadi.Qolgan barcha ionlar esa reagenti ta`sirida sulfidlar holida cho`kmaga tushadi.
 Uchinchi
guruh kationlarini ikki guruhchaga ajratilishining asosiy sababi kationlarning
NH4Cl li muhitda NH4OH bilan o`zaro ta`sirlashuviga
asoslangan. Ionlar konsentrasiyasining ko`paytmasi Al(OH)3, Cr(OH)3
va Fe(OH)3 gidroksidlarning eruvchanlik ko`paytmasi qiymatidan
ortadi va uchala gidroksid oq iviqlar ko`rinishida cho`kmaga tushadi.Shu
sababli birinchi guruhchaga Al3+ , Cr3+ , Fe3+ ionlari
kiradi,ular NH4OH bilan ammoniy tuzlar ishtirokida cho`kmaga
tushiriladi(lekin Fe3+ ionlari NH4Cl ishtirokida (NH4)2S
bilan qaytarilib Fe2+ ionlariga aylanadi), ikkinchi guruhchaga Fe2+,
Mn2+, Zn2+, Co2+, Ni2+ ionlari
kiradi,ular kuchsiz ishqoriy muhitda (NH4)2S ta`sirida
sulfidlar holida cho`kmaga tushadi:
Uchinchi
guruh kationlarini ikki guruhchaga ajratilishining asosiy sababi kationlarning
NH4Cl li muhitda NH4OH bilan o`zaro ta`sirlashuviga
asoslangan. Ionlar konsentrasiyasining ko`paytmasi Al(OH)3, Cr(OH)3
va Fe(OH)3 gidroksidlarning eruvchanlik ko`paytmasi qiymatidan
ortadi va uchala gidroksid oq iviqlar ko`rinishida cho`kmaga tushadi.Shu
sababli birinchi guruhchaga Al3+ , Cr3+ , Fe3+ ionlari
kiradi,ular NH4OH bilan ammoniy tuzlar ishtirokida cho`kmaga
tushiriladi(lekin Fe3+ ionlari NH4Cl ishtirokida (NH4)2S
bilan qaytarilib Fe2+ ionlariga aylanadi), ikkinchi guruhchaga Fe2+,
Mn2+, Zn2+, Co2+, Ni2+ ionlari
kiradi,ular kuchsiz ishqoriy muhitda (NH4)2S ta`sirida
sulfidlar holida cho`kmaga tushadi:
Me2+ +(NH4)2S= MeS+2NH4+
 Ular makro va
mikroelementlar sifatida biologik jarayonlarda ishtirok etadi, shu sababli ular
hosil qilgan tuzlar veterinariyada, qishloq xo‘jaligining turli sohalarida
ishlatiladi. Ularning ko‘pchiligi, birinchi va ikkinchi guruh kationlaridan
farqli ravishda suvdagi eritmalarda rangli bo‘ladi.
Ular makro va
mikroelementlar sifatida biologik jarayonlarda ishtirok etadi, shu sababli ular
hosil qilgan tuzlar veterinariyada, qishloq xo‘jaligining turli sohalarida
ishlatiladi. Ularning ko‘pchiligi, birinchi va ikkinchi guruh kationlaridan
farqli ravishda suvdagi eritmalarda rangli bo‘ladi.
Alyuminiy (Al3+) biologik tizimlarda muhim element emas va yuqori konsentratsiyalarda zaharli hisoblanadi. U fosfatlar va oqsillar bilan bog‘lanib, ularning funksiyalarini buzadi. Alyuminiy kationi tuproqni kislotaliligini oshiradi, o‘simliklalar ildizini zaharlaydi.
Cr3+ ionlari organizmda uglevodlar va lipidlar almashinuvi uchun juda oz miqdorda talab qilinadi. Qondagi glyukoza foizini me’yorda saqlab qolish uchun muhim bo‘lgan insulin ta’sirini yaxshilaydi. Tuproq tarkibidagi Cr³⁺ ionlari Al3+ singari o‘simliklar uchun zararli.
 Fe3+
va Fe2+ ko‘plab biologik jarayonlar, jumladan kislorodni tashish (gemoglobin va
miyoglobinning bir qismi sifatida), ferment funksiyasi va DNK sintezi uchun
muhimdir. Fe2+ ioni osonlik bilan Fe3+ ga aylanadi va organizmdagi
oksidlanish-qaytarilish jarayonlarida ishtirok etadi.Temir fotosintez va nafas
olishda ishtirok etgani uchun o‘simliklar o‘sishi uchun zarurdir. Temir
tanqisligi o‘simliklarda xloroz (barglarning sarg‘ayishi) kasalligini
rivojlantiradi.
Fe3+
va Fe2+ ko‘plab biologik jarayonlar, jumladan kislorodni tashish (gemoglobin va
miyoglobinning bir qismi sifatida), ferment funksiyasi va DNK sintezi uchun
muhimdir. Fe2+ ioni osonlik bilan Fe3+ ga aylanadi va organizmdagi
oksidlanish-qaytarilish jarayonlarida ishtirok etadi.Temir fotosintez va nafas
olishda ishtirok etgani uchun o‘simliklar o‘sishi uchun zarurdir. Temir
tanqisligi o‘simliklarda xloroz (barglarning sarg‘ayishi) kasalligini
rivojlantiradi.
Temir ionlari hayvon va o‘simlik to‘qimalarida mavjud. Fe2+ kationi qon gemoglobinida uchraydi, agar u yetishmasa kamqonlik kasalligiga olib keladi (rasm).
Qonning normal va kamkonlik holati
 Marganes
Mn2+ kationi uglevodlar, lipidlar va aminokislotalar almashinuvida
ishtirok etadigan ko‘plab fermentlar uchun kofaktordir. Bundan tashqari,
antioksidant himoya qilish uchun ham muhimdir. Shuningdek, marganes
o‘simliklarda fotosintez, xlorofill sintezi va azot almashinuvi uchun muhim
ahamiyatga ega. Marganesning yetishmasligi xlorozga va o‘simliklarning
o‘sishini susaytiradi. Hayvon organizmida Mn2+ (mikroelement)
yetishmasa skelet suyaklar egiluvchan (deformatsiyalanadigan) bo‘lib qoladi.
Marganes
Mn2+ kationi uglevodlar, lipidlar va aminokislotalar almashinuvida
ishtirok etadigan ko‘plab fermentlar uchun kofaktordir. Bundan tashqari,
antioksidant himoya qilish uchun ham muhimdir. Shuningdek, marganes
o‘simliklarda fotosintez, xlorofill sintezi va azot almashinuvi uchun muhim
ahamiyatga ega. Marganesning yetishmasligi xlorozga va o‘simliklarning
o‘sishini susaytiradi. Hayvon organizmida Mn2+ (mikroelement)
yetishmasa skelet suyaklar egiluvchan (deformatsiyalanadigan) bo‘lib qoladi.
Zn2+ kationi oqsil, DNK va RNK sintezida ishtirok etuvchi 300 dan ortiq fermentlar, shuningdek, antioksidant himoya va immun funksiyasi uchun zarur mikroelement. Rux o‘simliklarning o‘sishi va rivojlanishi uchun zarur, auksinlar (o‘sish gormonlari) sintezida va uglevod almashinuvida ishtirok etadi. Tarkibida ZnO bo‘lgan malhamlar veterinariyada teri kasalliklarini davolashda ishlatiladi.
ZnSO4 eritmasidan ko‘z kasalliklarini davolashda foydalaniladi.
Ni2+ azot almashinuvida ishtirok etuvchi ureaza fermenti uchun zarur, oltingugurt saqlovchi aminokislotalar sintezida ishtiok etadi. Nikel o‘simliklarda ureaza va azot almashinuvida rol o‘ynaydi. Nikel yetishmovchiligi o‘simliklarda karbamidning zaharlovchi miqdorini to‘plashiga olib kelishi mumkin.
 Kobalt kationi qon
va DNK sintezida va asab tizimining normal ishlashi uchun zarur bo‘lgan B12
vitamini (kobalamin) tarkibiga kiradi. Co2+ ionlarining
tuproqda yetishmasligi bug‘doy, qand lavlagi, beda va kanop kabi
o‘simliklarning rivojlanishiga salbiy ta’sir ko‘rsatadi. Hayvonlar ozuqasiga
CoSO4 tuzini qo‘shislishi ular qonidagi gemoglobin miqdorini
oshiradi.
Kobalt kationi qon
va DNK sintezida va asab tizimining normal ishlashi uchun zarur bo‘lgan B12
vitamini (kobalamin) tarkibiga kiradi. Co2+ ionlarining
tuproqda yetishmasligi bug‘doy, qand lavlagi, beda va kanop kabi
o‘simliklarning rivojlanishiga salbiy ta’sir ko‘rsatadi. Hayvonlar ozuqasiga
CoSO4 tuzini qo‘shislishi ular qonidagi gemoglobin miqdorini
oshiradi.
Bakteriyalarda azot fiksatsiyasi uchun ham Co2+ ionlari zarur. Dukkakli o‘simliklarda azotni biriktirish uchun bu ionlar muhim, agar ular yetishmasa ekinlar hosilini kamayishiga olib keladi.
Uchinchi guruh kationlarining kuchli kislota anionlari bilan hosil qilgan tuzlari suvli eritmalarda kislotali muhitga ega bo`ladi. Alyuminiy, xrom va rux gidroksidlari amfoterlik xossasini namoyon qiladi.
 Alyuminiy va rux
kationlari doimiy oksidlanish darajasiga ega, uchinchi guruhning boshqa
kationlari o`zgaruvchan oksidlanish darajasini namoyon qiladi va ular
oksidlovchi-qaytaruvchi xossalarga ega. O`rganilayotgan guruh kationlarini
saqlovchi tuzlar muhim biologik ahamiyatga ega. Kuchsiz kislotali muhitli bo`z
tuproqlar tarkibida Al3+ kationlari saqlanadi. Ko`pgina madaniy
o`simliklar ana shunday tuproqda sust o`sadi.
Alyuminiy va rux
kationlari doimiy oksidlanish darajasiga ega, uchinchi guruhning boshqa
kationlari o`zgaruvchan oksidlanish darajasini namoyon qiladi va ular
oksidlovchi-qaytaruvchi xossalarga ega. O`rganilayotgan guruh kationlarini
saqlovchi tuzlar muhim biologik ahamiyatga ega. Kuchsiz kislotali muhitli bo`z
tuproqlar tarkibida Al3+ kationlari saqlanadi. Ko`pgina madaniy
o`simliklar ana shunday tuproqda sust o`sadi.
Al2(SO4)3 tuzini suvga ozgina Ca(OH)2 bilan aralashtirilib qo`shilsa Al(OH)3 hosil bo`ladi va u cho`kayotib suvda suzib yurgan komponentlarni o`zi bilan olib ketadi. Bundan vodoprovod suvini tiniqlastirishda foydalaniladi.
.
 III guruxning
kationlariga (NH4)2S ta’sirettirlganda Al3+,
Cr3+ lar (OH) xolida cho‘kmaga tushadi. Kationlarning gidroksidlari
va sul’fidlari kuchli kislotalarda eriydi. Reaksiyasi quyidagicha bo‘ladi:
III guruxning
kationlariga (NH4)2S ta’sirettirlganda Al3+,
Cr3+ lar (OH) xolida cho‘kmaga tushadi. Kationlarning gidroksidlari
va sul’fidlari kuchli kislotalarda eriydi. Reaksiyasi quyidagicha bo‘ladi:
Fe3++3(NH4)2S ⟶Fe2S3+6MN4+
Fe2++(NH4)2S ⟶FeS+2NH4+
Mn2++(NH4)2S ⟶MnS+2NH4+
Zn2++(NH4)2S ⟶ZnS+2NH4+
N2++(NH4)2S ⟶NS+2NH4+
Co2++(NH4)2S⟶SoS+2NH4+ Al3++(NH4)2S+HOH⟶Al(OH)3+2NH4++H2S Cr3++(NH4)2S+HOH⟶Cr(OH)3+2NH4++ H2S.
FeS, Fe2S3, CoS, NiS – qora cho‘kma, MnS- sarg‘ish jigar rang, ZnS- oq cho‘kma, Al (OH)3oq cho‘kma,Cr(OH)3- kulrang-binafsha FeS,ZnS, MnS lar suyultirilgan HCl da eriydi.
FeS+2HCl⟶FeCl2+H2S
ZnS+2HCl⟶ZnCl2+H2S
MnS+2HCl⟶MnCl2+H2S
Fe2S3 xlorid kislota eriganida Fe3+ionii Fe2+ga qaytariladi.
Fe2S3+4HCl⟶2FeCl2+2H2S+S↓
III guruh kationlari (NH4OH+NH4Cl) amioniyli bufer eritma muhitida (pH≈9) (NH4)2S, bilan cho‘ktiriladi. Ana shundagina birinchi va ikkinchi gruppa kationlari eritmada qoladi.
III-guruh kationlariga xos shaxsiy reaksiyalar.
Al3+ kationlariga xos reaksiyalar,
 Quruq
usulda o‘tkazilgan reaksiyalar Al2(SO4)3 eritmasini
filtr qog‘ozga tomiziladi va Co(NO3)2 eritmasi ham
tomiziladi. Keyin filtr qog‘oz quritiladi va yondiriladi agar filtr qog‘ozda Al3+
bor bulsa, zangori rangli kul va zangori massa Co(AlO2)2-
“Tenar zangorisi “ qoladi.
Quruq
usulda o‘tkazilgan reaksiyalar Al2(SO4)3 eritmasini
filtr qog‘ozga tomiziladi va Co(NO3)2 eritmasi ham
tomiziladi. Keyin filtr qog‘oz quritiladi va yondiriladi agar filtr qog‘ozda Al3+
bor bulsa, zangori rangli kul va zangori massa Co(AlO2)2-
“Tenar zangorisi “ qoladi.
Al2(SO4)3+Co(NO3)2⟶Co(AlO2)2+3SO2+2NO2+2O2 Natriy gidrofosfat bilan reaksiyasi.
Al2(SO4)3 +4Na2HPO4⟶2AlPO4↓+2NaH2PO4+3Na2SO4
.
Cr3+ kationiga xos reaksiyalar.
Cr3+ni oksidlab Cr6+ga aylantirish.
2CrCl3+3H2O2+1ONaOH⟶2Na2CrO4+6NaCl+8H2O
Keyin esa eritmaga BaCl2 qo‘shiladi. CrO42-+Ba2+⟶BaCrO4↓ sariq cho‘kma tushadi.
Agar Cr6+ borligini aniqlash kerak bo‘lsa xam oksidlanadi.
Cr2O72- + 4H2O2+ 4H+⟶2H3CrO6 + 3H2O
peroksoxromat kislota
 Na2CrO4
eritmasiga H2SO4 yoki HNO3 qo‘shiladi,
keyin etil efiri 2-3 tomchi va 3%li H2O2 eritmasi qo‘shib
chayqatiladi.Peroksoxromat kislota efir qavatini zangori rangga
bo‘yaydi.
Na2CrO4
eritmasiga H2SO4 yoki HNO3 qo‘shiladi,
keyin etil efiri 2-3 tomchi va 3%li H2O2 eritmasi qo‘shib
chayqatiladi.Peroksoxromat kislota efir qavatini zangori rangga
bo‘yaydi.
Fe3+ kationiga xos reaksiyalar.
K4[Fe(CN)6] bilan reaksiyasi. “Berlin lazurini” hosil qiladi.
Fe3+ + K4[Fe(CN)6] ⟶↓Fe4[Fe(CN)6]3 + 4K+
Berlin lazuri to‘q ko‘k rang.
 Zn2+
bilan ham shunday reaksiya boradi, ammo oq cho‘kma hosil qiladi. CH3COONa
bilan reaksiyasi. Qizdirish bilan boradi.
Zn2+
bilan ham shunday reaksiya boradi, ammo oq cho‘kma hosil qiladi. CH3COONa
bilan reaksiyasi. Qizdirish bilan boradi.
FeCl3 + 3CH3COONa ⟶Fe(CH3COO)3 + 3NaCl
Fe(CH3COO)3 gidrolizga uchrab qo‘ng‘ir rangli cho‘kmani hosil qiladi.
Fe(CH3COO)3 + 2HOH⟶Fe(OH)2(CH3COO) + 2CH3COOH
qo‘ng‘ir rang.

Mn2+ kationiga xos reaksiya.
Mn2+ionini MnO4- ioniga oksidlash reaksiyasi.
2MnSO4+5(NH4)2S2O8+8H2O⟶2HMnO4+5(NH4)2SO4+7H2SO4
Ammoniy pushti persulfat tuzi
 Quruq
usul Pt sim qizdirilib Na2CO3 va KNO3 aralashmasiga
botirib olib g‘ovak massa hosil bo‘lguncha qizdiriladi keyin uni
tekshirilayotgan namunaga (masalan tarkibida MnSO4 yoki MnO(OH)2)
cho‘kmasiga tekkizilib qizdirish davom ettiriladi. Qizdirilgan massaga KClO3
kristallariga yuqtirilib, yana qizdirish davom etiriladi. Bunda yashil
dur(munchoq) hosil bo‘ladi. Bu jarayon tekish-yot modda tarkibida Mn borligini
bildiradi.
Quruq
usul Pt sim qizdirilib Na2CO3 va KNO3 aralashmasiga
botirib olib g‘ovak massa hosil bo‘lguncha qizdiriladi keyin uni
tekshirilayotgan namunaga (masalan tarkibida MnSO4 yoki MnO(OH)2)
cho‘kmasiga tekkizilib qizdirish davom ettiriladi. Qizdirilgan massaga KClO3
kristallariga yuqtirilib, yana qizdirish davom etiriladi. Bunda yashil
dur(munchoq) hosil bo‘ladi. Bu jarayon tekish-yot modda tarkibida Mn borligini
bildiradi.
3MnO(OH)2 + 3Na2CO3 + KClO3⟶3Na2MnO4 + KCl + 3H2O + 3CO2↑
yashil dur
.
Zn2+ kationiga xos reaksiya.
Kaliy (III) ferrotsianid bilan o‘tkazish reaksiya,
3ZnCl2 + 2K4[Fe(CN)6] ⟶Zn3K2[Fe(CN)6]2 + 6KCl
Oq cho‘kma
 Quruq
usulda o‘tkazilgan reaksiya. Filtr qog‘ozda Zn2+ tuzi
eritmasidan xo‘lanadi va Co(NO3)2 eritmasi tomiziladi.
Qog‘oz quritilib, yondirilganda yashil rangli kul “Riman yashili” hosil
bo‘ladi.
Quruq
usulda o‘tkazilgan reaksiya. Filtr qog‘ozda Zn2+ tuzi
eritmasidan xo‘lanadi va Co(NO3)2 eritmasi tomiziladi.
Qog‘oz quritilib, yondirilganda yashil rangli kul “Riman yashili” hosil
bo‘ladi.
Zn(NO3)+Co(NO3)2⟶CoZnO2+4NO2↑+O2↑
riman yashili
Co2+ kationiga xos reaksiya.
Amoniy rodanid bilan o‘tkazilgan reaksiya
CoCl2 + 4NH4CNS⟶(NH4)2[Co(CNS)4] + 2NH4Cl
zangori eritma
2)KCNS bilan reaksiyasi
CoCl2 + 4KCNS⟶K2[Co(CNS)4]↓ + 2KCl
yashil cho‘kma
Ni 2+ kationiga xos reaksiya.
Ammiak eritmasi bilan kamroq miqdorda qo‘shish kerak.
NiCl2 + NH4OH⟶Ni(OH)↓+ NH4Cl
yashil cho‘kma
 Agar
eritmaga NH3 qo‘shsak yashil cho‘kma ko‘k rangga o‘tadi. NiCl2
+ 2NH4OH + 4NH3⟶[Ni(NH3)6]Cl2↓
+ 2H2O ko‘k cho‘kma
Agar
eritmaga NH3 qo‘shsak yashil cho‘kma ko‘k rangga o‘tadi. NiCl2
+ 2NH4OH + 4NH3⟶[Ni(NH3)6]Cl2↓
+ 2H2O ko‘k cho‘kma

III gruppa kationlari Fe2+, Fe3+, Cr3+Al3+, M2+, Co2+ Mn2+, Fn2+ gidrolizga uchraydi.
III gruppa kationlari 2 ta guruxchaga ajratiladi.
(NH4)2S ta’sirida:
a) S2- lar holida cho‘kadigan kationlar
b) OH- lar holida cho‘kadigan kationlar (Al3+, Cr3+)
2AlCr3+3(NH4)2S+6HOH⟶2Al(OH)3+6NH4Cl+3H2S
 Ba’zan Al3+ yoki
Fe3+ ionlarini cho‘ktirish uchun CH3COONa eritmasi
ishlatiladi. Bunda gidroliz tufayli o‘rta tuz emas, balki asosli tuz hosil
bo‘ladi.
Ba’zan Al3+ yoki
Fe3+ ionlarini cho‘ktirish uchun CH3COONa eritmasi
ishlatiladi. Bunda gidroliz tufayli o‘rta tuz emas, balki asosli tuz hosil
bo‘ladi.
Masalan: FeCl3+3CH3COONa⟶Fe(CH3COO)3+3NaCl
Fe(CH3COO)3+HOH⟶Fe(OH)(CH3COO)2 + CH3COOH
Gidroliz protsessini xarakterlash uchun gidroliz konstantasi va gidroliz darajasi degan tushuncha kiritilgan. Gidroliz konstantasi va gidroliz darajasini izohlashda quyidagi formuladan foydalanamiz.

Ayrim kationlarning gidroksidlari xam kislota, xam asos xossasiga ega. Bular amofoter deyiladi. Ularning asosli xossalari kislotali muxitda, kislotani xossalari esa ishqoriy muxitda namoyon bo‘ladi. Amfoter gidroksidlar Al(OH)3, Cr(OH)3, Zu(OH)2Pb(OH)2,
Sn(OH)2
Al(OH)3 kislota va ishqorlar bilan kuyidagi tenglamaga muvofiq ta’sirlashadi.
Al(OH)3+3HCl⟶AlCl3+3H2O
Al(OH)3+NaOH⟶NaAlO2+2H2O
Al3+, Zn 2+,Cr3+ ionlarning amfoterlik xossalarining foydalanib, ularni III gruppa boshqa kationlarga ajiratish mumkin.
 KOH
qo‘shilganda III gruppa kationlarning hammasi cho‘kmaga tushadi, ammo ortiqcha
ishqor ta’sirida Al(OH)3, Cr(OH)3, Zu(OH)2,
lar erib ketadi va AlO2-, CrO2-,
ZnO22anionlari hosil bo‘ladi. Kationlar
gidroksidlariningamfoterlik xususiyati bilan 3-4-5 gruppa kationlari bilan
tanishganimizda batafsil tushuntiriladi.
KOH
qo‘shilganda III gruppa kationlarning hammasi cho‘kmaga tushadi, ammo ortiqcha
ishqor ta’sirida Al(OH)3, Cr(OH)3, Zu(OH)2,
lar erib ketadi va AlO2-, CrO2-,
ZnO22anionlari hosil bo‘ladi. Kationlar
gidroksidlariningamfoterlik xususiyati bilan 3-4-5 gruppa kationlari bilan
tanishganimizda batafsil tushuntiriladi.
3 gruppa kationlarida quyidagi oksidlanish qaytarilish protsesslari mavjud va muhim ahamiyatga ega
MnO4- + 8H+⟶Mn2++4H2O
Cr2O72-+14H⟶2Cr3++7H2O
[Fe(CN)6]3-⟶[Fe(CN)6]4Fe3+⟶Fe2+
III-gruppa kationlarining iborat aralashma analiz qiliniyotganda oksidlanish qaytarilish reaksiyasi Mn2+, Fe2+,Cr3+ kationlarini ajiratish va aniqlashda juda qo‘l keladi.
Masalan: Mn2+, Fe2+ ionlarini Zn2+, Al3+ ionlarining ajiratish uchun kationlar aralashmasi + iborat eritmaga H2O2 va Na OH qo‘shib kationlar oksidlanadi.
2FeCl2 + 4NaOH + H2O2⟶2Fe(OH)3↓ + 4NaCl
MnCl2 + 2NaOH + H2O2⟶MnO(OH)2↓ + 2NaCl + H2O
 Al3+,
Zn2+ kationlari esa AlO 2- alyuminat va ZnO22-
sinkat anionlariga aylanib eritmada qoladi. Ayrim oksidlanish qaytarilish
reaksiyalari ba’zi ionlarning eritmada mavjudligini bilib olish uchun
qo‘llaniladi. Masalan: Mn2+ kationini aniqlash jarayoni HNO3 muhitda
pbo2 bajarilish reaksiyasi orqali aniqlash mumkin.
Al3+,
Zn2+ kationlari esa AlO 2- alyuminat va ZnO22-
sinkat anionlariga aylanib eritmada qoladi. Ayrim oksidlanish qaytarilish
reaksiyalari ba’zi ionlarning eritmada mavjudligini bilib olish uchun
qo‘llaniladi. Masalan: Mn2+ kationini aniqlash jarayoni HNO3 muhitda
pbo2 bajarilish reaksiyasi orqali aniqlash mumkin.
2Mn(NO3)2 + 5 PbO2 + 6HNO3⟶ 2HnO4 + 5Pb(NO3)2 + 2H2O
4.Kompleks birikmalarning hosil bo‘lishi reaksiyalaridan analitik kimyoda ayrim ionlar uchun sezgir va xususiy reksiyalar sifatida foydalaniladi.
Masalan : Fe3+ ionini Fe4[Fe(CN)6]3 (berlin lazuri) ko‘rinishida Fe2+ionini Fe3[Fe(CN)6]2 kompleks tuzilishi ko‘rinishida trunbul ko’ki shaklida aniqlash mumkin. K+ ioni Na3[Cu(NO)6] ,bilan K2Na[Cu(NO2)6] hosil qildi.
Co2+ kationi (NH4)2[Co(SNC)4] va Co[Hg(SNC)4] kabi koordinatsion, birikmalar hosil bo‘lishi xarakterlidir. Analiz vaqtida kompleks ionlarning hosil bo‘lishiga foydalanib ionlarni bir-biridan ajiratishda foydalanish mumkin.
 Masalan:
Cu2+ va Pb2+ ionlari bo‘lgan eritmaga NH3 ta’sir
ettirilganda [Cu(NH3)4]2+ suvda eriydigan kompleksni
hosil qiladi Pb2+ esa Pb(OH)2 holida cho‘kmaga tushadi.
Analiz vaqtida halal beruvchi ionlarni bog‘lash yoki niqoblash uchun ham
kompleks ionlarni hosil bo‘lish reaksiyasiga foydalaniladi. Masalan: Fe3+ ionini
H3PO4 yordamida mustahkam kompleks ion [Fe(PO4)2]3-
tarzida bog‘lash mumkin,natijada u boshqa ionlarni topishga halal
bermaydi. Masalan (Cu2+, Ni2+),bundan tashqari Cd2+ni
aniqlashda Cu2+ halal bermaydi. Masalan: (Cu2+, Ni2+).
Bundan tashqari Cd2+ ni aniqlashda Cu2+halal beradi, Cu2+
ioni KCN yordamida kompleks ionga [Cu(CN)4]2- ga
o‘tkazilsa, Cd2+ ni H2S bilan aniqlash mumkin.
Masalan:
Cu2+ va Pb2+ ionlari bo‘lgan eritmaga NH3 ta’sir
ettirilganda [Cu(NH3)4]2+ suvda eriydigan kompleksni
hosil qiladi Pb2+ esa Pb(OH)2 holida cho‘kmaga tushadi.
Analiz vaqtida halal beruvchi ionlarni bog‘lash yoki niqoblash uchun ham
kompleks ionlarni hosil bo‘lish reaksiyasiga foydalaniladi. Masalan: Fe3+ ionini
H3PO4 yordamida mustahkam kompleks ion [Fe(PO4)2]3-
tarzida bog‘lash mumkin,natijada u boshqa ionlarni topishga halal
bermaydi. Masalan (Cu2+, Ni2+),bundan tashqari Cd2+ni
aniqlashda Cu2+ halal bermaydi. Masalan: (Cu2+, Ni2+).
Bundan tashqari Cd2+ ni aniqlashda Cu2+halal beradi, Cu2+
ioni KCN yordamida kompleks ionga [Cu(CN)4]2- ga
o‘tkazilsa, Cd2+ ni H2S bilan aniqlash mumkin.
Cu2+, Bi 3+, Pb2+, Cd2+ kationlari aralashmasi analiz qilish jarayonida eritmaga glitserin qo‘shilganda kationlarning kompleks birikmasi xosil bo‘ladi. Bu kompleks birikmalarga faqat Cd2+ hosil qilgani ishqorlar ta’sirida erimaydi.
vIV –guruh kationlariga quyidagi metallarning kationlari kiradi: Ag+,Hg+, Pb2+, Cu2+, Hg2+, Cd2+, Bi3+.
Ø Bu kationlarning sulfidlari: Ag2S, Hg2S, PbS, CuS, HgS, CdS, Bi2S3 suvda va kislota eritmalarida erimaydi, konsentrlangan HNO3 da eriydi. Bu guruh kationlariga umumiy reaktiv H2S.
vHCl ta’siriga qarab IV guruh kationlarini 2 ta guruhchaga bo‘lish mumkin.
 ØI
– guruhchaga Ag+, Hg+, Pb2+ ionlari kiradi,
ularning xloridlari AgCl, HgCl, PbCl2 suvda erimaydigan oq rangli
cho‘kmalardir. Shuning uchun kumush guruhchasiga alohida guruh reaktivi qilib
HCl qo‘llaniladi.
ØI
– guruhchaga Ag+, Hg+, Pb2+ ionlari kiradi,
ularning xloridlari AgCl, HgCl, PbCl2 suvda erimaydigan oq rangli
cho‘kmalardir. Shuning uchun kumush guruhchasiga alohida guruh reaktivi qilib
HCl qo‘llaniladi.
Ø II –guruhcha mis guruhchasi deyiladi. Uning tarkibiga Cu2+, Hg2+, Cd2+, Bi3+ kationlari kiradi.
Ø Bu kationlarning xloridlari CuCl2, HgCl2, CdCl2, BiCl3 suvda eriydi.
Ø  Kumush
guruhchasi cho‘kadi, mis guruhchasi eritmada qoladi. Filtrlash natijasida
ularni bir – biridan ajratiladi. Eritmada qolgan kationlarni cho‘ktirish uchun
H2S dan foydalaniladi.
Kumush
guruhchasi cho‘kadi, mis guruhchasi eritmada qoladi. Filtrlash natijasida
ularni bir – biridan ajratiladi. Eritmada qolgan kationlarni cho‘ktirish uchun
H2S dan foydalaniladi.
Ø IV guruh kationlarining ayrim birikmalari muhim biologik xususiyatga ega.
Ø Ag+ ioni bakterisid, lyapis sifatida AgNO3 tibbiyotda va veterinariyada qo‘llaniladi.
ØSimob metallining bug‘lari va Hg2+ ning tuzlari zaharli, asab tizimini zaharlaydi.
ØHgCl2 sulema sabzavot urug‘larini zamburug‘ va bakteriya sporalaridan saqlaydigan preparat.
ØHgJ2 teri kasalliklarini davolashda dorivor modda sifatida ishlatiladi.
ØSimob(I) xlorid Hg2Cl2 zaharsiz, vaterinariyada surgi dorisidir.
ØQorg‘oshin metali va uning barcha tuzlari zaharli.
 ØVismutning
Bi2O2(OH)NO3 tuzi me’daning ayrim
kasalliklarida antiseptik va yarani tuzatadigan dorilar tarkibiga kiradi.
ØVismutning
Bi2O2(OH)NO3 tuzi me’daning ayrim
kasalliklarida antiseptik va yarani tuzatadigan dorilar tarkibiga kiradi.
ØMis birikmalari ham zaharli, shu sababli mis idishlar qalay bilan qoplanadi.
ØCuSO4 veterinariyada antigelment preparati, o‘simliklardagi zamburug‘li (bug‘doydagi qorakuya) kasalliklarga qarshi kurashda qo‘llaniladi.
ØCu2+ ioni mikroelement holida o‘simliklar uchun juda zarur, u uglevodlar almashinuviga ta’sir ko‘rsatadi, o‘simliklarni zamburug‘ kasalliklariga chidamliligini oshiradi.
 ØTuproq
tarkibida mis ionlari miqdorini kamayishi ekin hosildorligini kamayishiga olib
keladi. Ozuqa tarkibida Cu2+ ionlarini yetishmasligi hayvonlarda
kasalliklarni ko‘payishiga sabab bo‘ladi.
ØTuproq
tarkibida mis ionlari miqdorini kamayishi ekin hosildorligini kamayishiga olib
keladi. Ozuqa tarkibida Cu2+ ionlarini yetishmasligi hayvonlarda
kasalliklarni ko‘payishiga sabab bo‘ladi.

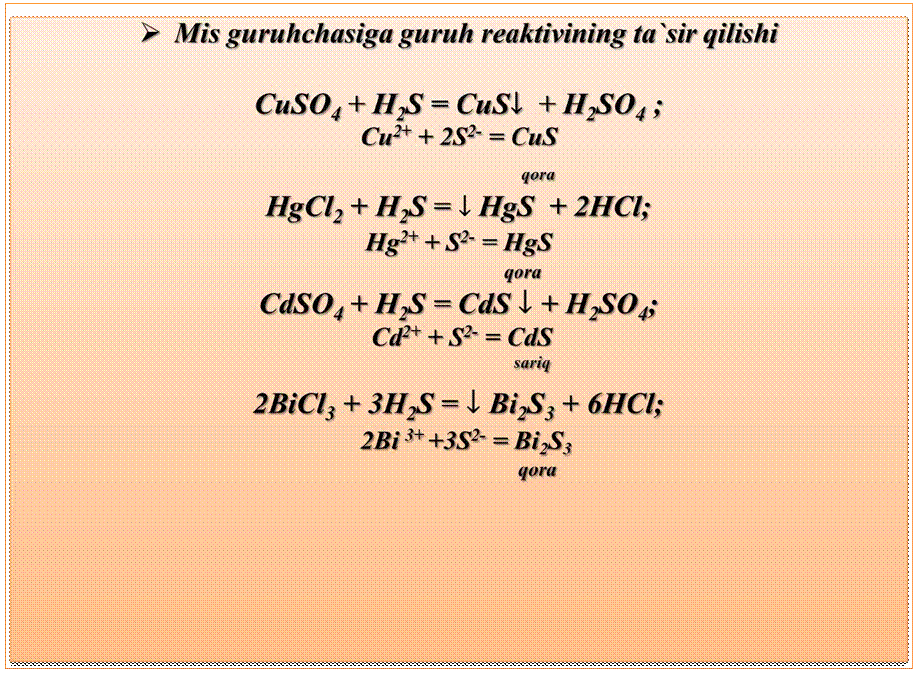
Ø HCl va uning eruvchаn tuzlari kumush ionlari bilan kumush хlоridning oq cho‘kmasini hosil qiladi:
 Ø AgCl
cho‘kmasi yorug‘da pаrchalаnib, kumush mеtali аjralib chiqishi sаbаbli qorayadi.
Kumush хlоrid suyultirilgаn kislotalarda erimаydi, lеkin аmmоniy gidroksidda
eriydi va kоmplеks tuz hosil qiladi:
Ø AgCl
cho‘kmasi yorug‘da pаrchalаnib, kumush mеtali аjralib chiqishi sаbаbli qorayadi.
Kumush хlоrid suyultirilgаn kislotalarda erimаydi, lеkin аmmоniy gidroksidda
eriydi va kоmplеks tuz hosil qiladi:
Diamin kumush (I) xlorid
Ø Оzroq nitrаt kislota quyilgаnda kоmplеks tuz pаrchalаnаdi va yanа qaytadan kumush хlоrid cho‘kmasi tushаdi:
v Ag+ kationiga xos reaksiya
Ø KJ bilan o‘tkaziladigan reaksiyalar KBr bilan ham sariq cho‘kma hosil qiladi.
Sariq
 Ø Na2HPO4
bilan reksiyasi sariq cho‘kma – Ag3PO4 hosil
bo‘ladi. 3AgNO3 + 2Na2HPO4 → Ag3PO4
↓+ 3NaNO3 + NaH2PO4
Ø Na2HPO4
bilan reksiyasi sariq cho‘kma – Ag3PO4 hosil
bo‘ladi. 3AgNO3 + 2Na2HPO4 → Ag3PO4
↓+ 3NaNO3 + NaH2PO4
v Hg22+ kationiga xos reaksiya
Ø Ishqorlar bilan reaksiyasi. Qora cho‘kma – Hg2O hosil bo‘ladi.
Qora
Ø KJ bilan o‘tkaziladigan reaksiyalar. Kamroq miqdorda qo‘shish kerak.
Hg2(NO3)2+2KJ→2 KNO3 + Hg2J↓ (loyqa yashil cho‘kma)
v Ag+ kationiga xos reaksiya
Ø KJ bilan o‘tkaziladigan reaksiyalar KBr bilan ham sariq cho‘kma hosil qiladi.
Sariq
 Ø Na2HPO4
bilan reksiyasi sariq cho‘kma – Ag3PO4 hosil
bo‘ladi. 3AgNO3 + 2Na2HPO4 → Ag3PO4
↓+ 3NaNO3 + NaH2PO4
Ø Na2HPO4
bilan reksiyasi sariq cho‘kma – Ag3PO4 hosil
bo‘ladi. 3AgNO3 + 2Na2HPO4 → Ag3PO4
↓+ 3NaNO3 + NaH2PO4
v Hg22+ kationiga xos reaksiya
Ø Ishqorlar bilan reaksiyasi. Qora cho‘kma – Hg2O hosil bo‘ladi.
Qora
Ø KJ bilan o‘tkaziladigan reaksiyalar. Kamroq miqdorda qo‘shish kerak.
Hg2(NO3)2+2KJ→2 KNO3 + Hg2J↓ (loyqa yashil cho‘kma)
vPb2+ kationiga xos reaksiya
 ØKJ
bilan o‘tkaziladigan reaksiya. Tilla rang sariq cho‘kma tushadi. Ortiqcha
miqdordagi reaktivda eriydi. Ag+ bilan ham xuddi shunday reaksiya
boradi. Ammo u reaktivning ya’ni KJning ortiqcha miqdori erimaydi.
ØKJ
bilan o‘tkaziladigan reaksiya. Tilla rang sariq cho‘kma tushadi. Ortiqcha
miqdordagi reaktivda eriydi. Ag+ bilan ham xuddi shunday reaksiya
boradi. Ammo u reaktivning ya’ni KJning ortiqcha miqdori erimaydi.
Pb(NO3)2+ 2KJ→PbJ2 ↓+ 2KNO3
Tilla rang sariq
PbJ2 + 2KJ → K2[PbJ4]
Kaliy tetra yodid qo’rg’oshin
hosil bo‘ladi.
v Cu2+ kationiga xos reaksiya
ØKJ bilan reaksiyasi. Avval oq cho‘kma hosil bo‘ladi, shu zahoti J2 bilan qoplanib qo‘ng‘ir rangga o‘tadi.
2CuSO4 + 4KJ → Cu2J2↓ + J2 + 2K2SO4
Oq cho‘kma
 ØNaCNS
– natriy rodanid bilan reaksiyasi avval qora cho‘kma – Cu(CNS)2 hosil
bo‘ladi. Keyin oq cho‘kmaga CuCNS ga aylanadi.
ØNaCNS
– natriy rodanid bilan reaksiyasi avval qora cho‘kma – Cu(CNS)2 hosil
bo‘ladi. Keyin oq cho‘kmaga CuCNS ga aylanadi.
2CuCl2 + 2NaCNS → Cu(SCN)2↓+2NaCl;
qora
2 Cu(SCN)2+HOH→2CuSCN↓+ HCNS + HOSCN
Oq

v Hg2+ kationiga xos reaksiyalar
 Ø KJ
bilan reaksiyasi. Avval to‘q qizil – sariq (zarg‘aldoq) rang cho‘kma - HgJ2
hosil bo‘ladi, keyin ortiqcha reaktiv qo‘shilsa rangsiz kompleks birikma
– K2[HgJ4] hosil bo‘ladi.
Ø KJ
bilan reaksiyasi. Avval to‘q qizil – sariq (zarg‘aldoq) rang cho‘kma - HgJ2
hosil bo‘ladi, keyin ortiqcha reaktiv qo‘shilsa rangsiz kompleks birikma
– K2[HgJ4] hosil bo‘ladi.
rangsiz eritma
Zarg‘aldoq
Ø Ishqorlar bilan reaksiyasi. Sariq cho‘kma – HgO hosil bo‘ladi.
sariq
Ø Mikrokristalloskopik usul. Hg2+ ioni ammoniy tetrarodanokobalt(II) (NH4)2[Co(CNS)4] tuzi bilan tiniq ko‘k rangli prizma, uchburchak, ignasimon shakldagi kristallarni hosil qiladi.
Hg(NO3)2 + (NH4)2[Co(CNS)4] → Hg[Co(CNS)4] + 2NH4NO3
tiniq ko‘k kristallar
vCd2+ kationiga xos reaksiyalar
 ØFerro
dipiridil yodid – Fe[a,a’-D3]J2 bilan reaksiyasi. Bunda
avval filtr qog‘ozga KJ va Cd(NO3)2 eritmaga
shimdiriladi. Keyin esa ferro dipiridil yodid tomiziladi qizil-binafsha dog‘lar
hosil bo‘ladi.
ØFerro
dipiridil yodid – Fe[a,a’-D3]J2 bilan reaksiyasi. Bunda
avval filtr qog‘ozga KJ va Cd(NO3)2 eritmaga
shimdiriladi. Keyin esa ferro dipiridil yodid tomiziladi qizil-binafsha dog‘lar
hosil bo‘ladi.
Cd(NO3)2+4KJ→ K2[CdJ4]+2KNO3
K2[CdJ4]+ Fe[a,a’-D3]J2 → Fe[a,a’-D3] [CdJ4]↓+2 KJ




vAs3+ kationiga xos reaksiya
2Na3AsO3+6HCl+3H2S → As2S3↓+ 6NaCl +6H2O Sariq
 ØKumush
nitrat bilan o‘tkaziladigan reaksiya. Sariq rangli cho‘kma – Ag3AsO3
hosil bo‘ladi. Na3AsO3+3AgNO3→ Ag3AsO3↓+3NaNO3
ØKumush
nitrat bilan o‘tkaziladigan reaksiya. Sariq rangli cho‘kma – Ag3AsO3
hosil bo‘ladi. Na3AsO3+3AgNO3→ Ag3AsO3↓+3NaNO3
sariq
ØYodli suv bilan o‘tkaziladigan reaksiya
AsO33-+J2+H2O→ AsO43-+2H++2J-
v As5+ ioniga xos reaksiya
Ø Kumush nitrat bilan reaksiyasi. Shokolad rang cho‘kma hosil bo‘ladi.
Shokolad rang
Ø Magnezili aralashma bilan o‘tkaziladigan reaksiya
Na3AsO4+MgCl2+NH4OH→NH4MgAsO4↓+2NaCl+NaOH
Oq kristall cho‘kma
Ø  Molibden
suyuqligi bilan o‘tkaziladigan reaksiya. (NH4)2MoO4ammoniy
molibdatning HNO3 dagi eritmasi ishlatiladi. Na3AsO4+12(NH4)2MoO4+24HNO3→
Molibden
suyuqligi bilan o‘tkaziladigan reaksiya. (NH4)2MoO4ammoniy
molibdatning HNO3 dagi eritmasi ishlatiladi. Na3AsO4+12(NH4)2MoO4+24HNO3→
Sariq kristall
vSurma ionlariga xos reaksiyalar
 ØSurma
o‘z birikmalaridla Sb3+ kationi H3[SbCl6], Sb5+
ioni H[SbCl6] singari xloridli komplekslar holida bo‘ladi.
ØSurma
o‘z birikmalaridla Sb3+ kationi H3[SbCl6], Sb5+
ioni H[SbCl6] singari xloridli komplekslar holida bo‘ladi.
vSb3+ ioniga xos reaksiyalar
ØH2S bilan reaksiyasi. Zarg‘aldoq rangli cho‘kma hosil bo‘ladi.
H3[SbCl6]+3H2S→Sb2S3↓+12HCl
ØIshqorlar bilan o‘tkaziladigan reaksiyasi
Sb3++3OH-→HSbO2↓+H2O oq cho‘kma
ØMetaantimonit kislotasining oq cho‘kmasi hosil bo‘ladi.

v Qalay ionlariga xos reaksiyalar
 Sn2+
ayrim hollarda SnO22- holda, Sn4+ esa H2[SnCl6]
holida bo‘ladi.
Sn2+
ayrim hollarda SnO22- holda, Sn4+ esa H2[SnCl6]
holida bo‘ladi.
v Sn2+ ioniga xos reaksiya
H2S bilan o‘tkaziladigan reaksiya. To‘q qo‘ng‘ir cho‘kma hosil bo‘ladi.
Ø Sulema bilan o‘tkaziladigan reaksiya. Sulema SnCl2 ni Sn4+ ga qadar oksidlaydi.
Oq cho‘kma
Ø Simob (I) xlorid oq cho‘kmasidan Hg metali ajralib chiqishi natijasida qorayadi.
Qora

Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.