
Муниципальное общеобразовательное учреждение
средняя общеобразовательная школа № 10 г. Сердобска
«Первый
закон термодинамики и его применение к изопроцессам. Адиабатный процесс».
/Урок физики в 10 классе/
Забродина Любовь Михайловна,
учитель физики МОУ СОШ №10 г. Сердобска
высшей квалификационной категории
Сердобский
район
2022
Эпиграф урока:
«За основу тут мы берём положение такое:
Из ничего не творится ничего»
Лукреций Кар, «О природе вещей»
Цель урока:
Формирование научного мировоззрения и познавательного интереса школьников в процессе «открытия» нового знания по теме урока.
Задачи урока:
Обучающие:
1.Обобщить и систематизировать знания учащихся о первом законе термодинамики (формулировка, математическая запись, физический смысл).
2.Исследовать особенности использования первого закона термодинамики для описания газовых процессов.
3. Обобщить и систематизировать знания учащихся об адиабатном процессе.Рассмотреть примеры адиабатного процесса в технике и природе.
4. Ввести понятие «вечный двигатель первого рода» и доказать невозможность его создания.
5. Сформировать умения применять знания на практике, в том числе при решении задач.
Развивающие:
Развивать умения учащихся видеть целостность окружаюшего мира, анализировать применение первого закона термодинамики для изопроцессов и адиабатного процесса; умения объяснять проявление и применение адиабатного процесса в природе и технике.
Воспитывающие:
Продолжить формирование научного мировоззрения, культуры общения.
Планируемые результаты:
Личностные:
· осознавать свои возможности в учебной деятельности;
· формирование устойчивой мотивации к приобретению новых знаний и их использованию;
· формирование навыков самоанализа и самоконтроля.
Метапредметные:
Регулятивные:
· формирование умений выполнять задания в соответствии с поставленной целью;
· умение формулировать и анализировать учебную проблему
· адекватно воспринимать оценку своей работы учителем, товарищами.
Познавательные:
Коммуникативные:
Предметные:
Обучающийся научится:
· обобщать и систематизировать знания о первом законе термодинамики
(формулировка, математическая запись, физический смысл),
· применять первый закон термодинамики для описания газовых процессов,
· доказывать невозможность создания вечного двигателя,
Обучающийся получит возможность научиться:
научиться представлять результаты в виде графиков, таблиц, схем.
Интеграционные связи:
Внутрипредметные: изопроцессы, законы термодинамики, физика атмосферы.
Межпредметные: география, технология
Необходимые ресурсы: компьютер, мультимедийный проектор, экран, подготовленные задачи для решения.
Ход урока:
Этап 1. Организационный
Дидактическая задача: мобилизация учащихся на урок.
Деятельность педагога: проследить за готовностью учеников к началу урока.
Деятельность учащихся: подготовить необходимое к уроку (учебник, тетрадь, дневник, письменные принадлежности).
Показатель результатов: готовность учеников к уроку.
Этап 2. Актуализация опорных знаний
Дидактическая задача: настроить учащихся на работу на уроке, вспомнить ранее изученный материал, необходимый к уроку.
Метод: проблемный
Форма организации: фронтальная.
Работа в тетрадях: Учащиеся готовят таблицу с названием изопроцессов (по образцу).
Обратить внимание на то, что таблица пока не имеет названия. Мы ещё будем возвращаться к ней в течение урока. Просто надо оставить место для заголовка.
Задание 1: Установите соответствие названия изопроцесса, названия закона, записи уравнения и графика, соответствующего данному изопроцессу.
|
Название процесса |
Постоянный параметр |
Название закона |
Уравнение, описывающее данный закон |
График процесса |
|
|
Изотермический
|
|
|
|
|
|
|
Изобарный
|
|
|
|
|
|
|
Изохорный
|
|
|
|
|
|
Контрольная таблица (после заполнения демонстрируется на слайде)
|
Название процесса |
Постоянный параметр |
Название закона |
Уравнение, описывающее данный закон |
График процесса |
|
Изотермический
|
T=const |
Закон Бойля - Мариотта |
|
|
|
Изобарный
|
|
Закон Гей - Люссака |
|
|
|
Изохорный
|
V=const |
Закон Шарля |
|
|
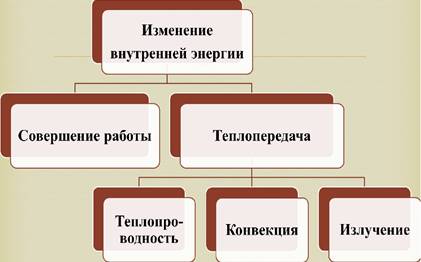
Задание 2:На прошлом уроке мы говорили о внутренней энергии тела. Сейчас я попрошу вас вспомнить материал о внутренней энергии, способах изменения внутренней энергии и формулы расчета количества теплоты. Систематизировать материал в тетрадях в виде схемы, ответив на вопросы:
a. Что называем внутренней энергий?
b. Какими способами можно изменить внутреннюю энергию?
c. Чему равна работа в термодинамике?
d. Что называем количеством теплоты?
e. Назовите процессы, сопровождающиеся выделением и поглощением тепла.
Контрольная схема (после заполнения демонстрируется на слайде)
U = (WK + W П ) N.
A = p*![]() V
V
Этап 3 Изучение нового материала.
Итак, мы вспомнили основные понятия термодинамики. А теперь обратимся к эпиграфу урока и попробуем с помощью его сформулировать тему сегодняшнего урока.
«Из ничего не творится ничего»…
Как можно эту цитату сказать на языке физики?
Учащиеся предполагают, что темой урока будет закон сохранения энергии в термодинамике.
Слово учителя.
Совершенно верно.Закон сохранения и превращения энергии, распространённый на тепловые явления, носит название первого закона термодинамики.
Учащиеся записывают тему урока:
«Первый закон термодинамики и его применение к изопроцессам. Адиабатный процесс»
В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется одновременно как за счёт совершения работы, так и за счёт передачи теплоты.
Презентация нового материала.
Первый закон термодинамики был открыт в середине 19 века немецким учёным врачом Майером (1814-1878), английским учёным Д. Джоулем(1818 – 1889) и получил наиболее точную формулировку в трудах немецкого учёного Г Гельмгольца (1821-1894).

Поразительная особенность: в этой группе ученых – два врача, Майер и Гельмгольлц.
Один, задумался о природе теплоты, когда наблюдал в тропиках цвет крови людей, другой, изучая физические основы зрения и слуха человека. Именно ему принадлежит честь, опираясь на выводы Майера и Джоуля, облечь в конечную форму закон сохранения и превращения энергии:
«Энергия в природе не возникает из ничего и не исчезает: количество энергии вечно и неизменно. Она только переходит из одной формы в другую»
(Падает, например, молот на кусок свинца, и свинец нагревается – потенциальная энергия молота переходит в кинетическую, затем механическая энергия превратилась во внутреннюю энергия тела).
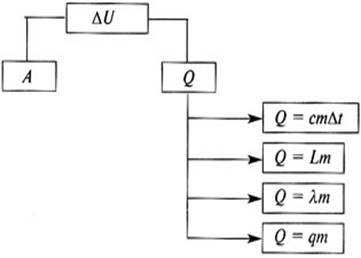
Формулировка и математическая запись закона:
1. Изменение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе
ΔU = Q + A'
Так как работа внешних сил над газом A' равна работе самого газа А, но взятого с обратным знаком (A' = - А), то
∆U = Q – A, или
2. В термодинамической системе количество теплоты, сообщенное системе, идет на изменение внутренней энергии и на работу системы над внешними телами.
Q=A + ∆ U
Это и есть: Первый закон термодинамики
Правило знаков: Q > 0 , если теплота передается системе (газу)
A > 0 , если работу совершает система (объем газа увеличивается)
Q=∆ U, если система не совершает работу (A = 0 )
Q=0, то A = - ∆ U, значит работа совершается над системой внешними силам
Теперь исследуем особенности применения первого закона термодинамики для газовых процессов, вернёмся к таблице, которую начали заполнять в начале урока.
Метод: эвристическая беседа
|
Деятельность педагога |
Деятельность учащихся |
|
Вам будут представлены утверждения. Ваша задача – оценить их справедливость.
Внутренняя энергия газа зависит от температуры газа.
Газ может совершать работу при любых происходящих с ним процессах.
При изобарном расширении газ совершает большую работу, чем при изотермическом.
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и совершение работы самой системы над внешними телами.
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
Повторение формул
1)
2)
3)
4) k = 1,38*10-23Дж/К
5) R = 8,31 Дж/(моль*К) |
1. 2. 3. 4. Да. 5. 6. Нет, при изохорном процессе газ работу не совершает. 7. 8. Да, это можно объяснить с помощью графика.
Да,
Да,
это первый закон термодинамики.
1) Уравнение Менделеева Клапейрона 2) Изменение внутренней энергии
3) Работа газа в термодинамике 4) Постоянная Больцмана
5) Универсальная газовая постоянная |
Показатель результатов: внимание, активность, ответы учеников
Этап 4. Обобщение и систематизация знаний по первому закону термодинамики
4.1 Тестирование по ранее изученному материалу
Дидактическая задача: обобщить ранее изученный материал, необходимый к уроку.
Метод: тестирование (устно)
Форма организации: самостоятельная работа
Вопросы тестирования
1. Как называется процесс изменения состояния газа при постоянной температуре?
А) изотермический;
Б) Изохорный;
В) Изобарный;
2. Какому процессу соответствует график, изображенный на рисунке?
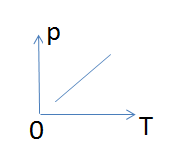
А) Изобарному;
Б) Изохорному;
В) Изотермическому.
3. Как изменится внутренняя энергия идеального газа при изохорном нагревании?
А) ![]()
Б) ![]()
В) ![]()
Г) ![]()
Д) ![]()
4. Газ получил количество теплоты 300 Дж, его внутренняя энергия увеличилась на 200 Дж. Чему равна работа, совершенная газом?
А) 0
Б) 100 Дж
В) 200 Дж
Г) 300 Дж
Д) 500 Дж
5. Какую работу совершил газ при давлении 300 Па, если первоначальный объем был 1 м3, а конечный 3 м3?
А) 0
Б) 300 Дж
В) 600 Дж
Г) 900 Дж
Д) 500 Дж
Показатель результатов: ответы с самопроверкой
1) А; 2) Б; 3) А; 4) Б; 5) В
4.2. Применение первого закона термодинамики к изопроцессам.
Дидактическая задача: проанализировать как изменяется внутренняя энергия и работа в различных процессах, применить к процессам первый закон термодинамики.
Метод: исследовательский.
Форма организации: фронтальная, групповая.
|
Деятельность педагога |
Деятельность учащихся |
|
С помощью первого закона термодинамики можно делать заключения о характере протекания различных процессов. Мы знаем три изопроцесса. Назовите их.
Для того чтобы сказать, как применяется закон к конкретному изопроцессу, надо проанализировать как изменяется внутренняя энергия при этом процессе, какая работа при этом совершается. Сейчас каждая группа попробует применить первый закон термодинамики к одному из процессов. Заполните последний столбец таблицы и дайте ей название. Давайте посмотрим, как справились с заданием. |
Ответы: изотермический, изобарный, изохорный
Работа с таблицей Работа в группах. Отвечает ученик от группы, остальные поправляют, дополняют, заполняют свою таблицу, дают ей название «Применение первого закона термодинамики к газовым процессам». |
Показатель результатов: работа в группах, ответы учеников, заполнение таблицы.
4.3. Адиабатный процесс.
Дидактическая задача: изучить адиабатный процесс, применение адиабатного процесса в технике и наблюдение адиабатного процесса в природе
Метод: поисковый
Форма организации: фронтальная
|
Деятельность педагога |
Деятельность учащихся |
|
Рассмотрим процесс, который идет без теплообмена с окружающей средой. Такой процесс называется адиабатным.
Первый закон термодинамики для адиабатного процесса
Встречается ли адиабатный процесс в природе? Посмотрите, какие разные облака изображены на картинах Левитана. Рассмотрим процесс образования облака.
Почему воздух поднимается вверх?
Физика образования облаков сложная, какое это будет облако зависит и от температуры, и от влажности воздуха, от рельефа местности и т.д.
Какие вы знаете облака?
А вы знаете, что бывают серебристые облака?
Мы с вами обладаем возможностью увидеть самые высокие облака – серебристые. Эти облака наблюдаются только летом и только на средних широтах на высоте 80 км над землей. Эти облака светятся под лучами солнца, опустившегося за горизонт или ещё не поднявшегося из-за горизонта.
|
В реальных процессах полной теплоизоляции достичь очень трудно, но в ряде случаев можно считать процессы близкими к адиабатным. Если процесс происходит очень быстро, то система не успевает обменяться теплом с окружающей средой.
Такой процесс происходит в двигателях внутреннего сгорания (мы будем говорить подрбно на следующих уроках). Из первого закона термодинамики для адиабатного процесса вытекает невозможность создания вечного двигателя - устройства, способного совершать неограниченное количество работы без затрат топлива или каких-либо других материалов. Если к системе не поступает тепло (Q=0), то работа A´ может быть совершена только за счет убыли внутренней энергии. После того как запас энергии окажется исчерпанным, двигатель перестанет работать (сообщение ученика)
Да, с адиабатным процессом связано образование облаков. ·
· Масса достаточно влажного воздуха поднимается вверх. · · Поднимающийся вверх воздух будет охлаждаться (адиабатное расширение, т.к. воздух поднимается относительно быстро) · Воздух охладится настолько, что начинается конденсация водяных паров. · Поступающий снизу воздух способствует вертикальному развитию облака
Кучевые и перистые
Конвекция, поток воздуха может встретить горы или другие возвышения, взаимодействие теплых и холодных фронтов
|
Показатель результативности: внимание учеников, уточняющие вопросы.
Сравнение графика адиабаты и изотермы.
График адиабаты идет круче графика изотермы. С помощью формулы p = nkT (n - числа молекул в единице объема - концентрации частиц) нетрудно объяснить, почему адиабата идет круче изотермы. При изотермическом сжатии газа давление p растет вследствие увеличения n, а при адиабатном сжатии увеличивается и n, и T, поэтому растет быстрее. 2) Работа, которую совершает газ при адиабатическом расширении, на участке 1—2 меньше, чем при изотермическом. При адиабатическом расширении осуществляется охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне такого же количества теплоты.
Этап 5. Решение задач
Дидактическая задача: применить полученные знания для решения конкретных задач
Метод: решение задач
Форма организации: фронтальная
|
Деятельность педагога |
Деятельность учащихся |
|
Задачи для решения: 1. При изотермическом расширении идеальным газом совершена работа 15 кДж. Какое количество теплоты сообщено газу?
2. В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на 500 Дж. Какое количество теплоты отдал газ? Совершил ли он работу?
3. Быстрый подъем воздушных масс определенной влажности приводит к образованию облака. Как при этом изменяется внутренняя энергия?
4. Вычислите изменение внутренней энергии кислорода массой 0,5 кг при изохорном повышении его температуры на 15 0С. 5. Качественная задача. Человека можно считать термодинамической системой. Тогда объясните, с точки зрения физики, почему, когда много работаешь, то хочется много есть, а если ничего не делаешь, то и аппетита нет. |
Q=15 кДж
Q=500 Дж, А=0
При адиабатном расширении газа его внутренняя энергия уменьшается, газ охлаждается
56*103Дж.
Высказывают предположения. |
Показатель результатов: выполнение заданий
Этап 5. Рефлексия
Дидактическая задача: мобилизация учащихся на рефлексию, актуализация и оптимизация знаний для следующего урока.
Метод: беседа.
Форма организации: фронтальная.
|
Деятельность учителя |
Деятельность учащихся |
|
Сделать качественную оценку выполнения заданий
Домашнее задание: Выучить конспект Выполнить тестовые задания · (тестовые задания прилагаются)
Спасибо за урок |
Записывают домашнее задание |
Тестовые задания для выполнения дома
Часть А
A1. Если V1 = 2 л, V2 = 2,5 л, р1 = 4∙105 Па, р2 = 20∙105 Па, то газ совершил работу, равную:
1) 80 Дж; 2) 200 Дж; 3) 400 Дж; 4) 800 Дж; 5) 8∙105Дж.
A2. Сосуд, содержащий некоторую массу азота, при нормальных условиях движется со скоростью 100 м/с. Какова будет максимальная температура азота при внезапной остановке сосуда? Удельная теплоёмкость азота при постоянном объёме равна 745 Дж/(кг∙К).
1) 250 К; 2) 280 К; 3) 300 К; 4) 320 К; 5) 400 К.
Часть В
В1 Установите соответствие между физическими величинами, характеризующими процесс изотермического сжатия воздуха, перечисленными в первом столбце, и их изменениями, указанными во втором столбце.
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ИХ ИЗМЕНЕНИЯ |
|
А) Давление. Б) Температура. В) Внутренняя энергия. |
1) Увеличение. 2) Уменьшение. 3) Неизменность. |
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры могут повторяться.
|
А |
Б |
В |
|
|
|
|
B2 Установите соответствие между физическими величинами, характеризующими изохорный процесс охлаждения воздуха, перечисленными в первом столбце, и их изменениями, указанными во втором столбце.
|
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ |
ИХ ИЗМЕНЕНИЯ |
|
А) Давление. Б) Объём. В) Температура. Г) Внутренняя энергия. |
1) Увеличение. 2) Уменьшение. 3) Неизменность. |
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры могут повторяться.
|
А |
Б |
В |
Г |
|
|
|
|
|
Дополнительные задачи:
1. На рис. 1. изображён график зависимости давления от температуры. Как изменяется при этом изменении состояния газа его внутренняя энергия, совершается ли работа, получает или отдаёт система теплоту?
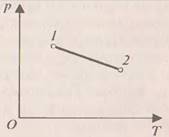 При
переходе газа из состояния 1 в состояние 2 давление уменьшается, температура и
внутренняя энергия газа увеличиваются. Объём газа также увеличивается (
При
переходе газа из состояния 1 в состояние 2 давление уменьшается, температура и
внутренняя энергия газа увеличиваются. Объём газа также увеличивается (![]() ),
следовательно, газ совершает работу расширения, являющуюся положительной.
Количество теплоты также положительно (
),
следовательно, газ совершает работу расширения, являющуюся положительной.
Количество теплоты также положительно (![]() ),
следовательно, газ получает некоторое количество теплоты.
),
следовательно, газ получает некоторое количество теплоты.
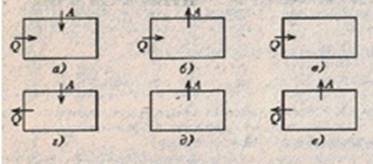
2. На рис. 2 изображено несколько вариантов термодинамического процесса. Стрелками показано, получает система тепло или отдает, совершает газ работу или работа совершается над газом. Какой из вариантов соответствует уравнению:
∆U = А - Q ?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.