Конспект урока химии в 9 классе "Повторение некоторых вопросов курса химии 8 класса. Важнейшие классы неорганических соединений. Реакции ионного обмена"

Конспект урока химии в 9 классе по теме:
«Повторение некоторых вопросов курса химии 8 класса.
Важнейшие классы неорганических соединений.
Реакции ионного обмена»
Подготовила: Федосеенко Ирина Андреевна, учитель химии
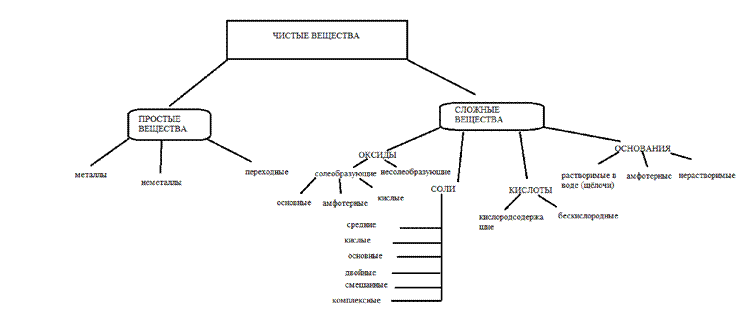 |
Все неорганические соединения делят на классы. Каждый класс объединяет вещества, сходные по составу и по свойствам. Зная особенности классов соединений, можно охарактеризовать свойства отдельных их представителей. НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА делятся на ПРОСТЫЕ и СЛОЖНЫЕ . Простые вещества подразделяются на металлы, неметаллы и инертные газы. Важнейшими классами сложных неорганических соединений являются ОКСИДЫ, ОСНОВАНИЯ, КИСЛОТЫ, АМФОТЕРНЫЕ ГИДРОКСИДЫ и их СОЛИ. (Новошинский Н.С., Общая химия: метод.пособие для школьников, абитуриентов и студентов. Краснодар, «Советская кубань», 1997 г.)
1. Оксидами называют соединения, молекулы которых состоят из двух элементов, одним из которых является кислород со степенью окисления «-2». Состав оксидов выражается общей формулой ЭхОу, где Э – любой элемент, О – кислород. Числовые значения Х иУ определяются степенью окисления элемента.
Способы получения оксидов
1. Окисление простых веществ или ещѐ называется соединение простого вещества с кислородом (горение):
С + О2 = СО2 ꜛ; 2 Мg + O2 = 2 MgO;
4 Li + O2 = 2Li2O; S + O2 = SO2
2. Горение сложных веществ (при этом, как правило, образуются оксиды тех элементов, из которых состоит сложное вещество):
CH4 + 2O2 = CO2 + 2H2O
4CH3NH2 + 9O2 = 4CO2 + 2N2 + 10 H20
3. Разложение сложных веществ или разложение при нагревании кислородных соединений:
карбонатов, нитратов, гидроксидов: а) нерастворимых оснований
2Fe(OH)3 = Fe2O3 + 3H2O (при нагревании) б) кислот
H2SiO3 = SiO2 + H2O (при нагревании)
Иногда воду удаляют из кислородных кислот действием на них водоотнимающих веществ:
2 HNO3 + P2O5 = 2HPO3 + N2O5 в) кислородсодержащих солей CaCO3 = CaO + CO2 Fe2(SO4)3 = Fe2O3 + 3SO3
4. Обжиг сульфидов:
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS + 7O2 = 2Fe2O3 + 4 SO2
5. Вытеснение одних оксидов другими (нелетучие кислотные оксиды при нагревании вытесняют более летучие из их солей):
CaCO3 + SiO2 = CaSiO3 + CO2
MgSO3 + B2O3 = Mg(BO2)2 + SO2
6. Взаимодействие кислот окислителей с металлами и неметаллами: C + 2 H2SO4 (конц) = CO2 + 2SO2 + 2 H2O
Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Физические свойства оксидов
Оксиды бывают 1) твѐрдые (MgO, Fe2O3, P2O5, CaO)
2) жидкие (SO3, N2O3)
3) газообразные (CO2, SO2)
Классификация и химические свойства оксидов По химическим свойствам оксиды классифицируются на солеобразующие и несолеобразующие (безразличные).
Несолеобразующие не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей.
К несолеобразующим оксидам относятся: CO, SO, NO, N2O, SiO2, SeO (безразличные) Солеобразующие делятся на ОСНОВНЫЕ, АМФОТЕРНЫЕ И КИСЛОТНЫЕ.
ОСНОВНЫЕ оксиды образуют только металлы, и как правило со степенью окисления +1 и +2 (исключение BeO, ZnO, SnO, PbO, GeO).
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ:
1) Взаимодействие с кислотами и кислотными оксидами
2) Оксиды активных металлов (щелочных и щелочноземельных Ca, Sr, Ba, Ra) взаимодействуют с водой с образованием щѐлочи.
АМФОТЕРНЫЕ оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот, образованные металлами со степенью окисления +3, +4 и исключения из основных оксидов BeO, ZnO, SnO, PbO, GeO.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ:
Амфотерные оксиды проявляют свойства как основных , так и кислотных оксидов.
1) Как основные: взаимодействие с кислотными оксидами и кислотами
2) Как кислотные: с основаниями и основными оксидами
КИСЛОТНЫЕ оксиды образуют все неметаллы, независимо от степени окисления и металлы, со степенью окисления +5 и выше.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ:
1) Взаимодействие с основаниями и основными оксидами
2) Взаимодействие с водой с образованием кислот.
ГИДРОКСИДЫ
Гидроксиды делятся на основные (основания), кислотные (кислородсодержащие кислоты), амфотерные.
Основания – соединения, молекулы которых состоят из атомов металла и одной или несколько гидроксогрупп.
Классификация: 1) в зависимости от числа гидроксогрупп основания делятся на: однокислотные (одна -ОН группа), многокислотные (две и более группы –ОН). 2) По растворимости: на растворимые (щѐлочи) и нерастворимые
СПОСОБЫ ПОЛУЧЕНИЯ
1) РАСТВОРИМЫЕ = действие воды на металл или оксид металла
2) НЕРАСТВОРИМЫЕ = действие раствора щѐлочи на соль того металла, основание которого нужно получить.
Кислотные (кислородсодержащие кислоты) – Н2СО3, HNO3, H2SO4
Амфотерные гидроксиды в зависимости от условий реакции могут проявлять свойства как нерастворимых в воде оснований, так и нерастворимых в воде кислот.
ПОЛУЧАЮТ АМФОТЕРНЫЕ ГИДРОКСИДЫ: взаимодействием соли со щелочью, избегая избытка последней.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ:
1) Как основания: взаимодействие с кислотами и кислотными оксидами
2) Как кислоты: взаимодействие с основаниями и основными оксидами , при сплавлении со щелочами.
КИСЛОТЫ
КИСЛОТЫ – вещества, которые в воде диссоциируют на ионы водорода (катионы) и кислотные остатки (анионы)
Кислоты делятся на КИСЛОРОДНЫЕ (КИСЛОРОДСОДЕРЖАЩИЕ) и БЕСКИСЛОРОДНЫЕ.
Способы получения кислот
Кислородсодержащих: 1)взаимодействие оксида неметалла с водой, 2) взаимодействие соли с кислотой
Бескислородные: соединение водорода с неметаллом с последующим растворением в воде
Свойства кислот Физические:
1) Кислоты бывают жидкие и твѐрдые
2) Многие хорошо растворимы
3) Растворы кислот имеют кислый вкус
4) Разъедают растительные и животные ткани
5) При взаимодействии синего лакмуса раствор становится красным
Химические:
1) Взаимодействие с металлами, стоящими в ряду активности металлов до водорода
2) Взаимодействие с основными оксидами 3) Взаимодействие с основаниями 4) Взаимодействие с солями.
СОЛИ
Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками.
Классификация солей
Соли делятся на СРЕДНИЕ (нормальные), КИСЛЫЕ и ОСНОВНЫЕ.
СРЕДНИЕ (нормальные) – это продукты полного замещения атомов водорода в молекуле кислоты на металл. Средние соли бывают растворимые и нерастворимые.
КИСЛЫЕ – это продукты неполного замещения атомов водорода в молекуле кислоты на металл. Все кислые соли являются растворимыми веществами.
ОСНОВНЫЕ – это продукты неполного замещения гидроксогруппы в молекуле оснований кислотными остатками. Все основные соли нерастворимы, кроме гидроксонитратов.
Способы получения солей
Средние соли:
1) Реакция нейтрализации (взаимодействие основания с кислотой)
2) Взаимодействие кислоты с основным оксидом
3) Взаимодействие соли с кислотой
4) Взаимодействие оснований с кислотными оксидами
5) Взаимодействие соли с кислотным оксидом
6) Взаимодействие основания и соли
7) Взаимодействие двух различных солей
8) Взаимодействие основного оксида с кислотным оксидом
9) Взаимодействие металла с неметаллом
10) Взаимодействие металла с кислотой 11) Взаимодействие металла с солью
12) Взаимодействие металла с щѐлочью
13) Взаимодействие неметалла с щѐлочью 14) Взаимодействие неметалла с солью 15) Термическое разложение солей.
Кислые соли:
1) Действием избытка многоосновной кислоты на основание
2) Действием избытка кислоты на средние соли многоосновных кислот.
Основные соли:
1) Действием избытка многокислотного основания на кислоту
2) Действием недостатка основания на среднюю соль многокислотного основания.
РЕАКЦИИ ИОННОГО ОБМЕНА
Согласно теории электролитической диссоциации реакции в растворах электролитов протекают между ионами или между молекулами и ионами. Такие реакции называются ионно-молекулярными, а уравнения, с помощью которых раскрывается сущность данных реакций, получили название ионно-молекулярных уравнений. Для написания ионно-молекулярного уравнения необходимо:
1) Составить молекулярное уравнение реакции и подобрать коэффициенты;
2) Среди продуктов найти вещество, образование которого вызывает протекание реакции. Это может быть осадок (малорастворимое вещество), слабый электролит (малодиссоциируемое соединение) газ, комплексный ион, т.е. реакция протекает в направлении наиболее прочного связывания ионов. В молекулярном уравнении под каждым веществом указать: силу кислот и оснований, растворимость для средних солей.
3) Составить полное ионно-молекулярное уравнение, руководствуясь правилами:
- в виде ионов пишутся только
А) сильные кислоты
Б) сильные основания (основания щелочных и щелочно-земельных металлов)
В) растворимые средние соли
Г) диссоциацию кислых солей в ионно-молекулярных уравнениях указывают по первой ступени. Все кислые соли растворимы.
4) исключить из обеих частей ионно-молекулярного уравнения одинаковые ионы
(подчеркнуть их),
5) выписать оставшиеся ионы, в результате получим краткое ионно-молекулярное уравнение, которое будет выражать сущность данной реакции.
© ООО «Знанио»
С вами с 2009 года.
![]()

