
Итоговая контрольная работа за курс химии 8 класса. Вариант 3.
Задание 1. К каждому из заданий №№ 1 – 10 даны 4 варианта ответа, из которых только один правильный.
1. В атоме химического элемента, расположенном в третьем периоде, VIA группе общее число электронов равно
1) 6 2) 3 3) 32 4) 16
2. Химический элемент, заряд ядра которого + 17
1) кислород 2) аргон 3) хлор 4) фтор
3. Химический элемент, в ядре атома которого содержится 13 протонов:
1) Азот 2) углерод 3) магний 4) алюминий
4. Число электронных слоев и число электронов во внешнем слое в атоме N равны соответственно:
1) 4 и 6 2) 2 и 5 3) 3 и 7 4) 4 и 5
5. Степень окисления + 3 азот проявляет в соединении
1) N2O5 2) Mg (NO2)2 3) Li3N 4) KNO3
6. В соединениях FeCl3 и Fe(OH)3 степени окисления железа соответственно равны:
1) +3 и +2 2) +3 и +3 3) +2 и +2 4) +6 и 0
7. На какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната цинка?
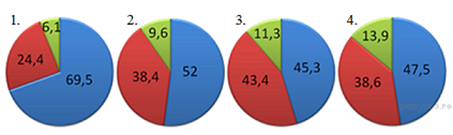
8. Наибольшее количество ионов натрия образуется при диссоциации 1 моль
1) NaCl 2) Na2S 3) Na3 PO4 4) Na2SO3
9. Наименьшее число ионов образуется при диссоциации 1 моль
1) CaCl2 2) K2SO4 3) Mg SO4 4) FeCl3
10. Выберите верную запись правой части уравнения диссоциации карбоната калия в водном растворе
1) = 2K+ + CO32- 2) = K+ + CO3 3) =2K+ + HCO32- 4) = K2O + CO2
Задание 2. При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
2.1. Каждый тип реакции иллюстрирован одним уравнением.
|
Тип химической реакции |
Уравнение реакции |
|
А) реакция соединения |
1) 2Al + Fe2O3 = 2Fe + Al2O3 |
|
Б) реакция разложения |
2) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 |
|
В) реакция замещения |
3) Cu(OH)2 = CuO + H2O |
|
Г) реакция обмена |
4) H2O + K2O = 2KOH |
2.2. Каждый тип связи иллюстрирован более чем одним примером веществ
|
Тип химической связи |
вещества |
|
А) ковалентная неполярная |
1. H2S |
|
Б) ковалентная полярная |
2. SO3 |
|
В) ионная |
3. Cl2 |
|
Г) металлическая |
4. MgS |
|
|
5. Fe2O3 |
|
|
6. CO2 |
|
|
7. Al |
|
|
8. Ca |
|
|
9. PH3 |
|
|
10. H2 |
|
|
11. AlBr3 |
|
|
12. NaCl |
2.3 Каждая группа веществ представлена одним или несколькими представителями
|
Класс веществ |
вещества |
|
А) основные оксиды |
1. K3PO4 |
|
Б) кислотные оксиды |
2. P2O5 |
|
В) основания (нерастворимые гидроксиды) |
3. K2O |
|
Г) щелочи (растворимые гидроксиды) |
4. KOH |
|
Д) кислоты |
5. Cu(OH)2 |
|
Е) соли |
6. SO2 |
|
|
7. CuSO4 |
|
|
8. AlCl3 |
|
|
9. H2SO4 |
|
|
10. HNO3 |
|
|
11. Mg(OH)2 |
|
|
12. Fe2O3 |
Задание 3. Осуществить цепочку превращений. Представить 2, 3 уравнения в ионном виде (с позиции ТЭД)
Mg→ MgO → Mg(NO3)2 → Mg(OH)2 → MgO → Mg
Задание 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой приведена. Определите окислитель и восстановитель.
HNO2 + HI → NO + I2 + H2O
Задание 5. К 50 г 24,5%-го раствора серной кислоты прилили избыток раствора нитрата бария. Какова масса выпавшего осадка?
Итоговая контрольная работа за курс химии 8 класса. Вариант 4.
Задание 1. К каждому из заданий №№ 1 – 10 даны 4 варианта ответа, из которых только один правильный.
1. В атоме химического элемента, расположенном в третьем периоде, IIA группе общее число электронов равно
2) 3 2) 2 3) 12 4) 24
2. Химический элемент, заряд ядра которого + 11
1) бор 2) углерод 3) магний 4) натрий
3. Химический элемент, в ядре атома которого содержится 9 протонов:
1) Кислород 2) углерод 3) бериллий 4) фтор
4. Число электронных слоев и число электронов во внешнем слое в атоме Si равны соответственно:
1) 4 и 6 2) 3 и 4 3) 4 и 3 4) 3 и 3
5. Степень окисления + 6 сера проявляет в соединении
1) SO2 2) Li2S 3) K2SO3 4) BaSO4
6. Степень окисления азота в соединениях NaNO2 и N2O5 равна соответственно
1) +3 и – 5 2) +3 и – 2 3) +4 и +5 4) +5 и +4
7. На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрата калия?
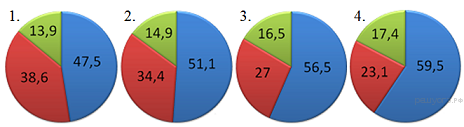
8. Наибольшее число хлорид-ионов образуется при диссоциации 1 моль
1) СaCl2 2) AlCl3 3) AgCl 4) KCl
9. Наименьшее число ионов образуется при диссоциации 1 моль
1) Mg(NO3)2 2) Na2CO3 3) CuSO4 4) K3PO4
10. Выберите верную запись правой части уравнения диссоциации нитрата бария в водном растворе
1) = Ba2+ + NO3- 2) = Ba2+ + HCO3- 3)=Ba2+ + 2NO3- 4) = Ba2+ + 3NO-
Задание 2. При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
2.1. Каждый тип реакции иллюстрирован одним уравнением.
|
Тип химической реакции |
Уравнение реакции |
|
А) реакция соединения |
1) 2Al + 3S = Al2S3 |
|
Б) реакция разложения |
2) 2Cu(NO3)2 = 2CuO + 4 NO2 + O2 |
|
В) реакция замещения |
3) NaOH + H2SO4 = Na2SO4 + 2H2O |
|
Г) реакция обмена |
4) Zn + H2SO4 = ZnSO4 + H2 |
2.2. Каждый тип связи иллюстрирован более чем одним примером веществ
|
Тип химической связи |
вещества |
|
А) ковалентная неполярная |
1. Cu |
|
Б) ковалентная полярная |
2. P2O5 |
|
В) ионная |
3. I2 |
|
Г) металлическая |
4. Na3N |
|
|
5. Fe |
|
|
6. MgCl2 |
|
|
7. K2O |
|
|
8. Li |
|
|
9. BaO |
|
|
10. O3 |
|
|
11. CS2 |
|
|
12. KCl |
2.3. Каждая группа веществ представлена одним или несколькими представителями
|
Класс веществ |
вещества |
|
А) основные оксиды |
1. SiO2 |
|
Б) кислотные оксиды |
2. NaOH |
|
В) основания (нерастворимые гидроксиды) |
3. MgO |
|
Г) щелочи (растворимые гидроксиды) |
4. Fe(OH)3 |
|
Д) кислоты |
5. CuO |
|
Е) соли |
6. SO3 |
|
|
7. CuCl2 |
|
|
8. Al(NO3)3 |
|
|
9. H2S |
|
|
10. N2O5 |
|
|
11. Ba(OH)2 |
|
|
12. HNO3 |
Задание 3. Осуществить цепочку превращений. Представить 2, 3 уравнения в ионном виде (с позиции ТЭД)
Fe → Fe2O3 → FeCl3→ Fe(OH)3→ Fe2O3→ Fe
Задание 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой приведена. Определите окислитель и восстановитель.
H2S+ H2O + Cl2 → H2SO4 + HCl
Задание 5. Рассчитайте массу осадка, который выпадает при взаимодействии избытка карбоната калия с 174 г 15%-го раствора нитрата бария.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.