
|
Краткосрочный план урока |
|||||||
|
Раздел долгосрочного плана: 9.1В Периодическая система химических элементов |
Школа: НИШ ХБН Атырау |
||||||
|
Дата: |
ФИО учителя: Ким Е.Г. |
||||||
|
Класс: 9 |
Количество присутствующих: |
отсутствующих: |
|||||
|
Тема урока |
Периодическое изменение некоторых характеристик и свойств атомов химических элементов |
||||||
|
Цели обучения, которые достигаются на данном уроке |
9.2.1.3 понимать, что элементы одной группы содержат на внешнем энергетическом уровне одинаковое количество электронов; 9.2.1.4 объяснять закономерности изменения химических свойств элементов и их соединений в группах и периодах |
||||||
|
Цели урока |
Рассмотреть закономерности изменения химических свойств в периодической системе, понимать, что элементы одной группы содержат одинаковое число атомов |
||||||
|
Языковые цели
|
Учащиеся должны уметь: объяснять закономерности изменения химических свойств в периодической системе, понимать, что элементы одной группы содержат одинаковое число атомов использовать научную терминологию при устных и письменных ответах Предметная лексика и терминология Периодическая таблица, химические элементы, электроны, внешняя оболочка, внешние электроны, строение, группа Серия полезных фраз для диалога/письма Если элемент содержит на внешнем энергетическом уровне три электрона, то он располагается в …………. группе. Элемент Х может располагаться в первой группе, если ……………… . Количество элементов, содержащих два электрона на внешнем энергетическом уровне составляют …………….. .
|
||||||
|
Привитие ценностей |
Обучение в течение всей жизни, открытость при оценивании работ Cотрудничество при разных видах работ |
||||||
|
Межпредметные связи |
По содержанию межпредметная с физикой, биологией |
||||||
|
Предварительные знания
|
Расположение электронов в атомах (8.1А.) Ряд активности металлов (8.2.А) |
||||||
|
Ход урока |
|||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке
|
Ресурсы |
|||||
|
Начало урока
0-5 минут
6-10 мин
11- 15мин
|
Приветствие. Создание доброжелательной атмосферы урока. Учитель проводит игру «Я-элемент» Представьте, что вы - химический элемент.Что вы о себе можете сказать?
После обсуждения ответов учащихся, учитель совместно с учащимися определяет тему урока и цели обучения.
Индивидуальная работа. Попросите учащихся на примере шестой группы (подгруппа кислорода) обсудить вопросы: - Как изменяется радиус атома в группе сверху вниз? \ -Какова сила притяжения электронов к ядру атома? - Как изменяется способность атомов отдавать и принимать электроны? - В каком случае элемент обладает металлическими свойствами? Попросите учащихся разработать правила закономерностей изменения химических свойств элементов и их соединений в группах. Предложите учащимся на примере элементов второго периода (Li-Ne) ответить на следующие вопросы: - Как изменяются радиусы атомов химических элементов в периоде? - Что происходит с электронами последнего энергетического уровня? Учащиеся должны написать в тетрадях закономерность изменения химических свойств элементов и их соединений в периодах.
|
Презентация
|
|||||
|
16-39минут
41-77 мин
|
Учитель проводит беседу с учащимися Вопросы для обсуждения: Попросите учащихся определить «Короля Неметаллов» и «Короля Металлов» и объяснить свой выбор. Акцентируйте внимание учащихся, что есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства. Попросите учащихся выписать их в тетради: Zn, Cr, Al, Sn, Pb, Mn, Fe, Be. Попросите учащихся сделать надписи в копиях таблиц, в виде стрелочек указывающих закономерности: а) окислительных и неметаллических свойств в периодах; б) восстановительных и металлических свойств в периодах; в) восстановительных и металлических свойств в группах. Выводы: С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Прием «INSERT» Учащимся предлагается текст для ознакомления и выписывают закономерности в тетрадях учащиеся выполняют проверочный тест по данной дифференциации заданий. После выполнения проводится самооценивание
Обсуждение работы.Подведение итогов урока |
Копии периодической таблицы
презентация
Приложение 1
ноутбуки https://distant-lessons.ru/ximiya/zakonomernosti-izmeneniya-ximicheskix-svojstv-elementov-i-ix-soedinenij
|
|||||
|
Конец урока 78-80 минут |
Рефлексия. Ответьте на вопросы: 1-мне было комфортно на уроке 2-я получил ответы на все интересующие меня вопросы 3-я принимал активное участие во всех этапах урока 4-мне урок понравился
|
стикеры |
|||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники
безопасности |
|||||
|
Все ученики будут: Знать закономерности периодической таблицы. Большинство: уметь обьяснять закономерности распределения элементов в таблице Некоторые: предсказывать свойства элементов |
На уроке будет проходить самооценивание и взаимооценивание, также учитель наблюдает за работой учащихся. |
|
|||||
|
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными? Все ли учащиеся достигли ЦО? Если нет, то почему? Правильно ли проведена дифференциация на уроке? Выдержаны ли были временные этапы урока? Какие отступления были от плана урока и почему? |
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. |
||||||
|
|
|||||||
|
Общая оценка Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)? 1:
2:
Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)? 1:
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
|
|||||||
Приложение 1
Изменения свойств химических элементов и их соединений в группах:
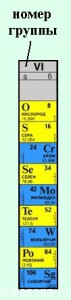
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
· Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
· В группах сверху вниз возрастают металлические свойства элементов
· усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:
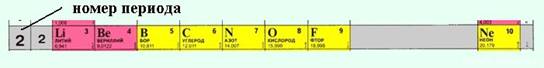
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
· В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
· усиливаются кислотные свойства их соединений
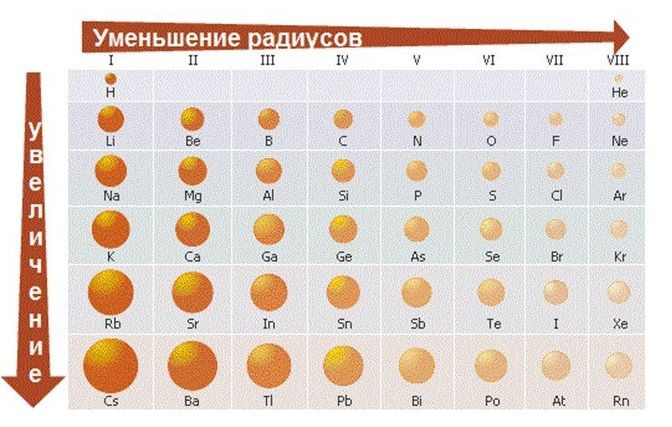

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
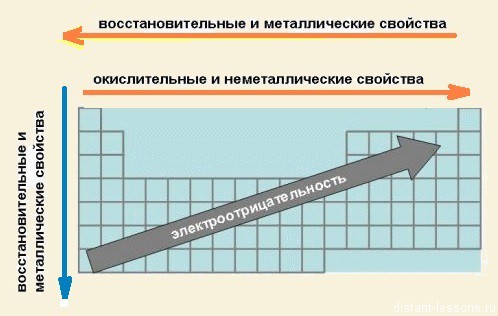
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
· Zn
· Cr
· Al
· Sn
· Pb
· Mn
· Fe
· Be
Ф.И. _____________________________________Класс
Рабочий лист
Тест
1. В ряду Li → Ве → В → С
![]() усиливаются
восстановительные свойства простых веществ
усиливаются
восстановительные свойства простых веществ
![]() усиливается основность
соединений
усиливается основность
соединений
![]() усиливаются кислотные свойства
соединений
усиливаются кислотные свойства
соединений
![]() кислотные свойства
элементов ослабевают
кислотные свойства
элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
![]() N → Р → As
N → Р → As
![]() S → Р → Si
S → Р → Si
![]() Sb
→ As → P
Sb
→ As → P
![]() Al → C → N
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
![]() Ca(0)
Ca(0)
![]() Al(3+)
Al(3+)
![]() Cs(+)
Cs(+)
![]() K(+)
K(+)
4. В каком ряду кислотность соединений возрастает
![]() Cr(0),
Cr(3+), Cr(+6)
Cr(0),
Cr(3+), Cr(+6)
![]() Mn(+6),
Mn(+4), Mn(+2)
Mn(+6),
Mn(+4), Mn(+2)
![]() Cl(+7), Cl(+3), Cl(+1)
Cl(+7), Cl(+3), Cl(+1)
![]() S(+6), S(+4), S(0)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO - Cr2O3 - CrO3
![]() основной - кислотный -
амфотерный
основной - кислотный -
амфотерный
![]() основной - амфотерный -
кислотный
основной - амфотерный -
кислотный
![]() все основные
все основные
![]() все несолеобразующие
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
![]() в
заданном ряду элементов электроотрицательность уменьшается
в
заданном ряду элементов электроотрицательность уменьшается
![]() основные свойства
оксидов этих элементов ослабевают, а кислотные усиливаются
основные свойства
оксидов этих элементов ослабевают, а кислотные усиливаются
![]() неметаллические
свойства простых веществ усиливаются
неметаллические
свойства простых веществ усиливаются
![]() степень окисления
атомов в высших оксидах одинакова
степень окисления
атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
![]() фософра
фософра
![]() азота
азота
![]() рубидия
рубидия
![]() водорода
водорода
8. Только амфотерные оксиды указаны в ряду:
![]() Na2O,
ZnO, CuO
Na2O,
ZnO, CuO
![]() ZnO,
Al2O3, Cr2O3
ZnO,
Al2O3, Cr2O3
![]() Al2O3,
FeO, SO3
Al2O3,
FeO, SO3
![]() CO2, CO, N2O5
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
![]() утвеждение А верно
утвеждение А верно
![]() веное утверждение - B
веное утверждение - B
![]() оба утверждения верны
оба утверждения верны
![]() оба неверны
оба неверны
10. Соединения элемента с порядковым номером 20
![]() простое вещество
проявляет металлические свойства
простое вещество
проявляет металлические свойства
![]() оксид элемента —
кислотный
оксид элемента —
кислотный
![]() при взаимодействии с
водой оксид элемента образует кислоту
при взаимодействии с
водой оксид элемента образует кислоту
![]() в соединениях проявляет
отрицательную степень окисления
в соединениях проявляет
отрицательную степень окисления
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.