
|
Раздел долгосрочного плана 9.2В Неорганический анализ |
Назарбаев Интеллектуальная школа химико-биологического направления города Атырау |
||||
|
Предмет: Химия |
ФИО учителя: Ким Е.Г. |
||||
|
Дата:10.12.21
|
Класс: 9 f |
Количество учащихся: |
|||
|
Тема урока |
Повторение |
||||
|
Цели обучения |
9.4.1.13 составлять план эксперимента по определению состава незнакомого вещества и осуществлять его на практике; |
||||
|
Цели урока |
составлять план эксперимента по определению состава незнакомого вещества и осуществлять его на практике; |
||||
|
Критерии оценивания |
составляет план эксперимента по определению состава незнакомого вещества и осуществлять его на практике; |
||||
|
Языковые цели |
цветное пламя, металлы, растворы металлов, проволока, соединение, литий, натрий, калий, рубидий, кальций, стронций, барий, медь, раствор, темный/светлый синий, испытывать, предел, выделять, образовать, погружать Учащиеся могут: описывать этапы по выполнению эксперимента по окрашиванию пламени, правильно произносить термины по данной теме. Раствор Х окрасил пламя (цвет) Раствор Х выделил пламя (цвет) Какого цвета получился раствор? В какой цвет окрасился раствор? Стронций окрасил пламя (цвет) Калий “ “ “ “ “ Натрий “ “ “ “ “ Сначала погрузите проволоку в раствор, затем… |
||||
|
Привитие ценностей |
Честность взаимооценивание, сотрудничество толерантность, трехъязычие, здоровье, уважение, ответственность и обучение на протяжении всей жизни - выполнение эксперимента. Глобальное гражданство
|
||||
|
|
-в заданиях (презентация), разделение обязанностей внутри группы, в заданиях на дом. |
||||
|
Предваритель ные знания |
Простые химические реакции (7.2В) Растворы и растворимость (7.3C) Ряд активности металлов (8.2А ) Вода (8.4В) |
||||
|
Ход урока |
|||||
|
Запланированные этапы урока 0-1 мин
2-4мин
5-15 мин
16-18 мин
19-30 мин
35-38 мин
|
Запланированная деятельность на уроке 1.Приветствие учителем класса, проверка готовности учащихся к уроку; 2.Создание доброжелательной рабочей атмосферы в классе, настрой на работу. Мозговой штурм: Задача 1. Элементы А и В принадлежат к 1 группе, а элемент С к 7 группе. Соединение элементов А и С растворимо в воде и окрашивает пламя в фиолетовый цвет, а соединение В и С имеет белую окраску и нерастворимо ни в воде ни в кислотах, Что представляют собой элементы? Индивидуальная работа.Задания по PIZA
Вспомнить основные правила составления теоретической и практической матрицы Составление плана эксперимента позволяет определять ионы в определенной последовательности. Изначально составляется теоретическая таблица. Количество ячеек в таблице соответствует количеству исследуемых веществ. Например, если исследуются 5 веществ, количество ячеек в горизонтальных и вертикальных строках будет равно пяти. В горизонтальных строках записываются формулы веществ, в вертикальных – формулы реактивов. Если в условиях задачи отмечается, что неизвестные вещества должны быть определены без дополнительных реактивов, то в вертикальных и горизонтальных строках пишутся формулы исследуемых веществ. В пересекающиеся ячейки записывают формулы образующихся в результате взаимодействия веществ, указывая условными знаками ↓ – образование осадка, ↑ – образование газа. В случае отсутствия признака реакций ставится знак (–). Групповая работа Учащиеся по группам на Цели обучения: - составлять план эксперимента по определению катионов и анионов и осуществлять его на практике; - составлять план эксперимента по определению состава незнакомого вещества и осуществлять его на практике.
В конце урока предоставить ответы для самопроверки учащихся |
Ресурсы
презентация
Приложение 1
Приложение2
Приложение 3
|
|||
|
Конец урока 39-40 мин
|
Домашнее задание параграф 5.4. презентация Рефлексия «Три М». Учащимся предлагается назвать три момента, которые у них получились хорошо в процессе урока, и предложить одно действие, которое улучшит их работу на следующем уроке. |
|
|||
|
Дифференциация Вес могут применить основные теоретические знания качественных реакций катионов и анионов Большинство составляют теоретическую матрицу? Записывают уравнения химических реакций и определяют вещества Некоторые Могут проанализировать результаты и обобщить результаты работы Рефлексия по уроку Были ли цели урока/цели обучения реалистичными? Все ли учащиеся достигли ЦО? Если нет, то почему? Правильно ли проведена дифференциация на уроке? Выдержаны ли были временные этапы урока? Какие отступления были от плана урока и почему? |
Используйте данный раздел для размышления об уроке. Ответьте на самые важные вопросы о вашем уроке из левой колонки. |
||||
|
Общая оценка Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)? 1: 2: Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)? 1: 2: Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
|
|||||
Приложение 1
|
Задание 1/3 . Батискаф Учёные проводив исследование, выяснили что объём лёгких человека в среднем составляет 4-6 литров , и при дыхании человек употребляет приблизительно 1 моль газа в час в сутки. Вычислите, сколько необходимо пероксида натрия для обеспечения кислородом в течение двух суток для семьи из 4-х человек. Приведите вычисления, подтверждающие ваш ответ. Ответ
Задание 2/3 Обсудите решение данного задания в паре .Выберите оптимальный вариант выполнения задания и предложите способ увеличения кислорода
Задание 3\3 Используйте своё воображение, предложите модель батискафа с усовершенствованиями для увеличения количества кислорода, которые были бы инновационными для погружения на глубину для семьи из 4-х человек . Опишите кратко каждое из ваших усовершенствований в ячейках, расположенных ниже Усовершенствование 1
Усовершенствование 2
|
|
Критерии оценивания:
Задание 1
Приемлимость идеи- максимальный бал-2
Задание 2
Доработка идеи – максимальный балл -2
Задание 3
Выдвижение креативной идеи – максимальный балл -2
Ожидаемые ответы детей:
Задание 1/3:
Ответ 1 Приводит расчет Полностью принимаемый ответ -2 балла
Х моль 192 моль
2Na2O2 ( т )+ 2CO2(г)=2Na2CO3(т)+O2(г)
2 моль 1 моль
За сутки 24 моль кислорода, за двое суток 48 моль., на 4 человека .количество увеличивается в 4 раза -192 моль кислорода.Составляем пропорцию :
Х Моль Na2O2 -192 моль кислорода
2 моль Na2O2 – 1 моль кислорода х=384 моль
Вычислим массу пероксида натрия: m = n*M =384 моль*78 г/моль = 29952 г
Ответ: 29952 г
Ответ 2 Учащийся может предложить другой вариант решения данной задачи частично принимаемый ответ -1 балл
Непринимаемый ответ, если отсутствует решение задачи -0 баллов
Задание 2/3
Ответ 1 Предложить расчеты получения кислорода из перманганат натрия, хлорат калия и др. веществ. Полностью принимаемые ответы -2 балла
Ответ 2 Можно заменить пероксид натрия на перманганат натрия, хлорат калия и др. вещества, из которых можно получить кислород частично принимаемый ответ -1 балл
Ответ 3 Принимается любой другой способ получения кислорода в пользу ученика
Непринимаемый ответ, если не раскрывает ответ задания -0 баллов
Задание 3/3
Ответ 1 Усовершенствование 1- присоединить дополнительный баллон с пероксидом натрия Полностью принимаемые ответы -2 балла
Ответ 2 Усовершенствование2- установка своеобразных ингаляторов ,вырабатывающих кислород частично принимаемый ответ -1 балл
Ответ 3 Усовершенствование 3- применение установок на батискафе , когда за счет тока , кислород будет производится из воды
Непринимаемый ответ, если не раскрывает ответ задания -0 баллов
Приложение 2
Правила составления теоретической и практической матриц неизвестного неорганического вещества
Составление плана эксперимента позволяет определять ионы в определенной последовательности. Изначально составляется теоретическая таблица. Количество ячеек в таблице соответствует количеству исследуемых веществ. Например, если исследуются 5 веществ, количество ячеек в горизонтальных и вертикальных строках будет равно пяти. В горизонтальных строках записываются формулы веществ, в вертикальных – формулы реактивов. Если в условиях задачи отмечается, что неизвестные вещества должны быть определены без дополнительных реактивов, то в вертикальных и горизонтальных строках пишутся формулы исследуемых веществ. В пересекающиеся ячейки записывают формулы образующихся в результате взаимодействия веществ, указывая условными знаками ↓ – образование осадка, ↑ – образование газа. В случае отсутствия признака реакций ставится знак (–).
I Составление матрицы с известными реагентами
Примеры составления практической и теоретической матрицы
Вам дано четыре водных растворов Na2SO4, CuCl2, K2СО3, ВаSiO3.
1.1.Определите в какой из пробирок находиться вещества Х, У, Z, F, на основании признаков продуктов реакции.
Для этого составляется теоретическая таблица с предложенными веществами. Определяют продукты каждого неизвестного вещества с реагентами, в конце таблицы указывают число осадков и газов, которое необходимо вещество при определении веществ по практической матрице и записи уравнений химических реакций.
Таблица 1. Теоретическая матрица.
|
Реагенты и признаки |
Неизвестные вещества |
Число осадков и газов |
|||
|
Na2SO4 |
CuCl2 |
K2СО3 |
ВаSiO3 |
||
|
BaCl2 |
(BaSO4) |
- |
(Ba СО3) |
|
2 |
|
HCl |
- |
- |
|
Определение силикат иона SiO32- ; Белый студенистый осадок (Н2SiO3) |
1 |
|
NaOH |
- |
Голубой осадок (Сu(OH)2) |
- |
- |
1 |
|
Цвет пламени |
Желтый (Na+) |
Зеленый (Cu2+) |
Фиолетовый (К+) |
Желто-зеленый (Ва2+) |
|
Таблица 2. Практическая матрица.
1. Неизвестные вещества определяются путем сравнения с теоретической матрицей по количеству образованных осадков,выделенных газов, а по цвету пламени можно определить катионы металлов, по групповым реагентам определить анион, входящий в соединение.
|
Реагенты и признаки |
Неизвестные вещества |
Число осадков и газов |
|||
|
Х |
У |
Z |
F |
||
|
BaCl2 |
|
- |
|
- |
2 |
|
HCl |
- |
- |
Газ |
|
1 |
|
NaOH |
- |
Голубой осадок |
- |
- |
1 |
|
Цвет пламени |
желтый |
зеленый |
Фиолетовый |
Желто-зеленый |
|
Сравнивая теоретическую и практическую матрицы приходим к выводу, что вещества:
Х –Na2SO4; Y – CuCl2; Z – K2СО3, F – ВаSiO3
II Составление матрицы с неизвестными веществами без применения других реагентов
2.1 Составление теоретической матрицы
|
ВаСl2 |
AgNO3 |
Na2CO3 |
KOH |
НCl |
Al(NO3)3 |
Выводы |
|
|
ВаСl2 |
Х |
|
|
- |
- |
- |
|
|
AgNO3 |
|
Х |
|
- |
|
- |
|
|
Na2CO3 |
|
|
Х |
- |
|
- |
|
|
KOH |
- |
- |
- |
Х |
- |
|
|
|
НCl |
- |
|
|
- |
Х |
- |
|
|
Al(NO3)3 |
- |
- |
- |
|
- |
Х |
1 |
|
Выводы |
|
|
|
|
|
1 |
В конце таблицы указывают число осадков и газов, которое необходимо вещество при определении веществ по практической матрице и записи уравнений химических реакций.
2.2 Практическая матрица
|
А |
В |
С |
D |
F |
H |
Выводы |
|
|
А |
Х |
|
|
- |
- |
- |
|
|
B |
|
Х |
|
- |
|
- |
|
|
C |
|
|
Х |
- |
|
- |
|
|
D |
- |
- |
- |
Х |
- |
|
|
|
F |
- |
|
|
- |
Х |
- |
|
|
H |
- |
- |
- |
|
- |
Х |
1 |
|
Выводы |
|
|
|
|
|
1 |
Неизвестные вещества определяются путем сравнения с теоретической матрицей по количеству образованных осадков, выделенных газов.
Необходимо обратить внимание на количество осадков и образующихся газов для определения неизвестного вещества.
Согласно данной таблицы веществами являются А - ВаСl2, В - AgNO3, С - Na2CO3, D – KOH, F – НCl, H- Al(NO3)3
Приложение 3
Самопроверка учащимися
1 группа
Сначала во все пробирки наливается раствор соляной кислоты. В пробирке с карбонатом калия выделяется газ 2Н+ (водн.) + CO32- (водн.) = СО2(г) + Н2О(водн.)
В пробирке с нитратом серебра образуется осадок белого цвета. Ag+ (водн.)+ Cl- (р-р.) = AgCl(тв) реакция между сульфатом натрия и хлоридом аммония не протекает. Для определения этих двух веществ используется растворимая в воде соль бария.
В пробирке с сульфатом натрия образуется белый осадок, реакция с хлоридом аммония не протекает.
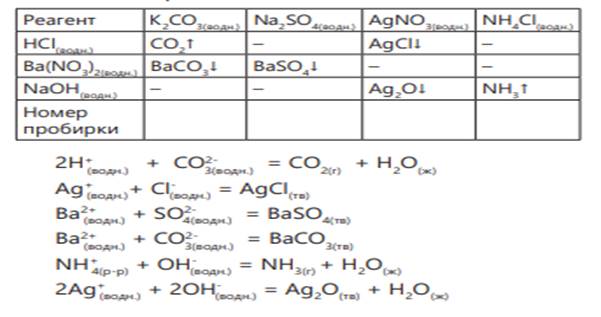
2 группа
Сначала во все пробирки наливается раствор соляной кислоты. В пробирке с карбонатом калия выделяется газ 2Н+ (водн.) + CO32- (водн.) = СО2(г) + Н2О(водн)
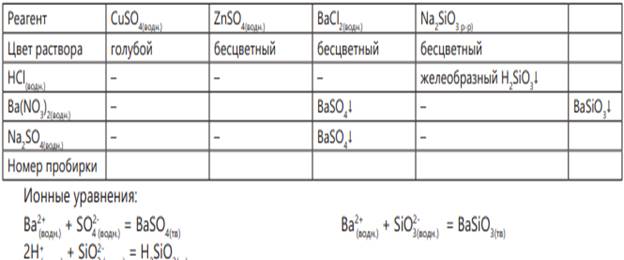
3 группа
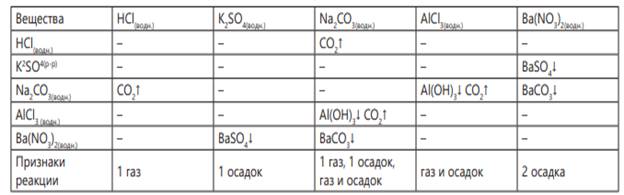
Во время эксперимента заполняется практическая таблица. Необходимо сравнить две таблицы и сделать вывод. Согласно экспериментальной таблице вещество, образующее два осадка, - это Ba(NO3 )2 , вещество, образующее два осадка и два газа, - Na2CO3 , вещество, образующее при взаимодействии с одним и тем же веществом как осадок, так и газ, - AlCl3 , вещество, образующее только один осадок, - K2SO4 , вещество, образующее только одно вещество, – HCl.
4 группа
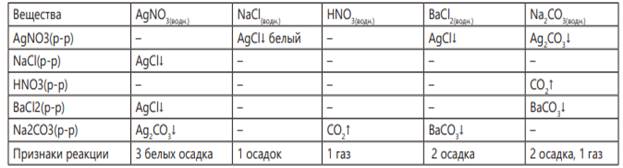
Сравнение с практической таблицей. Согласно практической таблице в случае образования трех осадков белого цвета в пробирке находится AgNO3 , в случае образования двух осадков, одного газа - Na2CO3 , в случае образования одного газа - HNO3 . Для определения данных веществ можно использовать реактивы AgNO3 или Na2CO3 . При взаимодействии нитрата серебра с хлоридом натрия образуется белый осадок, а при взаимодействии BaCl2 с карбонатом натрия образуется осадок. В выводах указываются номер пробирки и соответствующее ему название вещества.
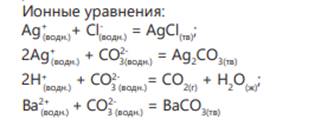
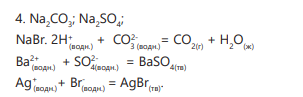
5. При взаимодействии с соляной кислотой раствор нитрата серебра образует осадок белого цвета, при добавлении в раствор карбоната натрия выделяется газ. Нитрат калия не взаимодействует с раствором соляной кислоты.
Качественные реакции на анионы.
|
Анион |
Воздействие или реактив |
Признак реакции. Уравнение реакции |
|
SO42- |
Ba2+ |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
|
NO3− |
1) Добавить H2SO4 (конц.) и Cu, нагреть
2) Смесь H2SO4 + FeSO4 |
1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
|
PO43- |
Ag+ |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
|
CrO42- |
Ba2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
|
S2- |
Pb2+ |
Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
|
CO32- |
1) Ca2+
2) H+ |
1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
|
CO2 |
Известковая вода Ca(OH)2 |
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
|
SO32- |
H+ |
Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
|
F− |
Ca2+ |
Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
|
Cl− |
Ag+ |
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.): Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
|
Br− |
Ag+ |
Выпадение светло-желтого осадка, не растворимого в HNO3: Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
|
I− |
Ag+ |
Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.): Ag+ + I− = AgI↓ (осадок темнеет на свету) |
|
OH− (щелочная среда) |
Индикаторы: — лакмус — фенолфталеин |
— синее окрашивание — малиновое окрашивание |
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.