
Масса молекул. Количество вещества. Постоянная Авогадро.
Тепловое равновесие
Вы знаете, что все тела состоят из молекул. Если говорить о массе молекул и выражать ее в граммах или килограммах, то мы увидим, что масса очень мала, а если говорить о количестве молекул, например в одном кубическом сантиметре окружающего нас пространства, то количество этих молекул будет огромно. Работать с очень маленькими или очень большими числами не очень удобно, тем не менее ученые смогли разобраться, как можно выражать массу или размеры молекул не очень большими обозримыми числами, не больше сотни
У нас есть пластмассовые шарики и гирька, как нам определить, где больше вещества?
Положим шарики и гирьку на весы для сравнения массы (рис. 1):

Рис. 1. Определение массы
Мы видим, что одна гирька значимо перевешивает семь пластмассовых шариков. Опыт с весами дает нам ответ – больше вещества в железной гирьке, это если мы сравниваем массы – меры инертности железа и пластмассы.
А что если мы сравним не массы, а количество вещества, которое пошло на изготовление шариков и гирьки, фактически количество частиц, из которых они состоят? Взяв в руки шарики и гирьку, мы увидим, что гирька фактически теряется на фоне этих шариков. Если бы мы умели считать количество частиц, которые входят в железо и пластмассу, то мы бы увидели, что количество атомов железа окажется значительно меньше количества молекул во всех пластмассовых шариках. Значит вещества больше в пластмассе.
Все дело в том, что в первом случае мы сравнивали массу, то есть меру инертности тел, а во втором случае мы сравнивали количество молекул, количество вещества.
 Простую аналогию мы
можем провести с сахаром в мерном стаканчике. На вопрос, сколько там сахара,
можно ответить, посмотрев на деление стаканчика и ориентировочно сказать,
сколько там граммов сахара. Можно пересчитать каждую крупинку, находящуюся в
стаканчике, и ответить, какое количество их содержит стаканчик. Правильными
будут и первый, и второй ответы.
Простую аналогию мы
можем провести с сахаром в мерном стаканчике. На вопрос, сколько там сахара,
можно ответить, посмотрев на деление стаканчика и ориентировочно сказать,
сколько там граммов сахара. Можно пересчитать каждую крупинку, находящуюся в
стаканчике, и ответить, какое количество их содержит стаканчик. Правильными
будут и первый, и второй ответы.
Количество молекул. Число Авогадро
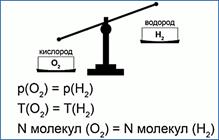
В XIX веке итальянский ученый Авогадро установил интересный факт: если два разных газа, например водород и кислород, находятся в одинаковых сосудах, при одинаковых давлениях и температурах, то в каждом сосуде будет одинаковое количество молекул, хотя массы газов могут отличаться очень сильно, в нашем примере – в 16 раз (рис. 2).
Рис. 2. Опыт Авогадро
Все это обозначает, что некоторые свойства тела определяются именно количеством молекул, а не только массой.
Что же мы понимаем под термином «количество вещества»? Любое вещество состоит из молекул, атом, ионов – значит, имеет смысл под количеством вещества понимать количество молекул.
Физическая величина, которая определяет количество молекул в данном теле, называется количеством вещества. Обозначается греческой буквой ν – ню.
Условились за единицу количества вещества принять такое его количество, в котором содержится столько частиц (атомов, молекул), сколько атомов содержится в 0,012 кг (12 граммах) изотопа углерода с атомной массой 12. Называется эта единица моль.
Из этого определения
выходит, что в одном моле любого вещества будет одинаковое количество молекул.
В одном моле любого вещества содержится 6,02·1023 молекул
или частиц. Эта величина носит название постоянная Авогадро:

Рис. 3. Определение полного числа молекул
Эта формула позволяет узнать полное число молекул при известном количестве вещества.
Масса молекул
Масса молекулы крайне мала. Определили это физики при помощи так называемого масс-спектрографа. К примеру, значение массы молекулы воды (рис. 4):

Рис. 4. Определение массы молекулы воды
Как мы видим, так же, как и в случаях с количеством вещества, сравнивать массу одной молекулы с эталоном массы, килограммом, не очень удобно. Если в случаях с количеством вещества числа огромны, то в случаях с массой молекул числа очень малы. Именно поэтому в качестве единицы измерения массы молекулы или атома была выбрана особая внесистемная единица – атомная единица массы. Мы будем сравнивать единицу массы не с эталоном, а с массой молекулы какого-то вещества.
Этим веществом стал самый распространенный в природе элемент – углерод, который входит во все органические соединения.
Атомная единица массы равна: 1 а.е.м. = 1/12 массы углерода – 12 (изотоп, в котором 12 нуклонов)
1 а.е.м. = 1, 66·10-27 кг
Так как мы будем измерять массу молекул в атомных единицах массы, то мы приходим к новой физической величине – относительная молекулярная масса.
Отношение массы молекулы (атома) данного вещества к 1/12 массы атома углерода называется относительной молекулярной массой (или относительной атомной массой) в случае атомарного строения вещества.
Формулы, выражающие
это определение: ![]()
Относительная молекулярная масса – это безразмерная величина, она ни в чем не измеряется. Нам ничего не мешает по-прежнему измерять массы атомов и молекул в килограммах тогда, когда нам это будет удобно. Из курса химии мы знаем, что: относительная молекулярная масса вещества равна сумме относительных атомных масс элементов, входящих в него. Например, для воды Н2О относительная молекулярная масса будет:
Мr = 1·2 + 16 = 18
Сумма относительной молекулярной массы кислорода (16) и двух водородов (2•1) даст 18
Как же найти общее между массой в килограммах и количеством вещества в молях? Это величина – молярная масса.
Молярная масса – это масса одного моля вещества. Обозначается [ М ], измеряется в кг/моль.
Молярная масса равна
отношению массы к количеству вещества: М = ![]()
Получим формулы, которые связывают различные характеристики молекул.
Для определения молярной массы химического элемента обратимся к периодической таблице химических элементов Менделеева – берем просто атомную массу А (число нуклонов необходимого элемента) – это и будет его молярная масса, выраженная в г/моль. Например, для алюминия (рис. 5):

Рис. 5. Определение молярной массы вещества
Атомная масса алюминия будет равна 27, а молярная масса будет равна 0,027 кг/моль.
Это объясняется тем, что молярная масса углерода равна 12 г/моль по определению, в то же время ядро атома углерода содержит 12 нуклонов – 6 протонов и 6 нейтронов, выходит, что каждый нуклон вносит в молярную массу 1 г/моль, поэтому молярная масса химического элемента с атомной массой А окажется равной А г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием малярных масс, так например (рис. 6):

Рис. 6. Молярная масса углекислого газа
Нужно быть особо внимательными с молярными массами некоторых газов, таких как газообразный водород, азот, кислород – их молекула состоит из двух атомов – H2, N2, O2, а гелий, часто встречающийся в задачах, является одноатомным и имеет молекулярную массу 4 г/моль, предписанную таблицей Менделеева (рис. 7).

Рис. 7. Молярные массы некоторых газов
В одном моле любого вещества содержится число Авогадро молекул, значит, если умножить число Авогадро (число молекул в одном моле) на массу одной молекулы m0, то мы получим молярную массу вещества, то есть массу одного моля вещества: М = m0 · NА
Если 25 учеников занимаются в классе, площадь которого 50 м2, то на каждого ученика приходится 2 м2. При переходе их на занятие в спортзал, площадь которого 500 м2, на каждого ученика уже будет приходиться 20 м2. Число учеников не изменилось, но они стали реже расположенными, в этом случае говорят: уменьшилась концентрация людей. Точно так же для молекул вводится понятие концентрации в молекулярной кинетической теории.
Концентрацией (n) называется
количество молекул, приходящихся на единицу объема вещества. Она равна
отношению числа молекул к объему: n = ![]() ,
[n] =
,
[n] = ![]() =
м-3
=
м-3
Формулы, связывающие
концентрацию с другими характеристиками молекул: 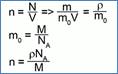
Пользуясь этими формулами, мы можем сравнивать вещества как по количеству молекул, так и по массе.
Тепловое равновесие
Для определения температуры нужно ввести новое и очень важное понятие — тепловое равновесие.
Чтобы измерить температуру тела, следует подержать медицинский термометр под мышкой 5—8 мин. За это время ртуть в термометре нагревается и уровень ее повышается. По длине столбика ртути можно судить о температуре. То же самое происходит при измерении температуры любого тела любым термометром. Термометр никогда не покажет температуру тела сразу же после того, как он соприкоснулся с ним. Необходимо некоторое время для того, чтобы температуры тела и термометра выравнялись и между ними установилось тепловое равновесие, при котором температура перестает изменяться.
Тепловое равновесие с течением времени устанавливается между любыми телами с различной температурой. Бросьте в стакан с водой кусочек льда и закройте стакан плотной крышкой. Лед начнет плавиться, а вода охлаждаться. Когда лед растает, вода станет нагреваться; после того как она примет температуру окружающего воздуха, никаких изменений внутри стакана с водой происходить не будет.
Из этих и подобных им простых наблюдений можно сделать вывод о существовании очень важного свойства тепловых явлений. Тело при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия. Тепловым, или термодинамическим, равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Это означает, что не меняются объем и давление, не происходит теплообмен, отсутствуют взаимные превращения газов, жидкостей, твердых тел и т. д. В частности, не меняется объем столбика ртути в термометре. Это означает, что температура системы остается постоянной.
Но микроскопические процессы внутри тела не прекращаются и при тепловом равновесии. Меняются положения молекул, их скорости при столкновениях.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.