
Металлотермия.
Пирометаллургия, гидрометаллургия и электрометаллургия
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».
За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений.
Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений.
Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд.
Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
![]()
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
 Водород как восстановитель может использоваться для
получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае
водород восстанавливает металл из его оксида при высокой температуре.
Водород как восстановитель может использоваться для
получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае
водород восстанавливает металл из его оксида при высокой температуре.
WO3 + 3H2 = W + 3H2O↑
CuO + H2 = Cu + H2O↑
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.
 Так, алюминий используется для получения кальция
из его оксида, а металлический кальций используют для получения цезия.
Так, алюминий используется для получения кальция
из его оксида, а металлический кальций используют для получения цезия.
4CaO + 2Al = Ca (AlO2)2 + 3Ca
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑
PbO + C = Pb + CO↑
Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде: Fe2O3 + С или CO = Fe3O4 + CO2↑
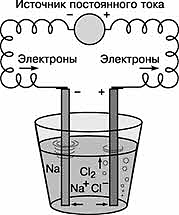
Постоянный электрический ток является самым сильным восстановителем.
С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др.
При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
2NaCl = 2Na + Cl2↑
BaCl2 = Ba + Cl2↑
 Алюминий в промышленных масштабах получают путём электролиза раствора оксида
алюминия в расплавленном криолите (Na3AlF6).
Алюминий в промышленных масштабах получают путём электролиза раствора оксида
алюминия в расплавленном криолите (Na3AlF6).
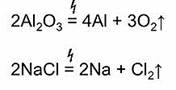
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы:
· пирометаллургия
· электрометаллургия
· гидрометаллургия.
В пирометаллургическом методе используют восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.