
Томарович Л.А
Практические работы по химии
10 класс
Кандалакша, 2020
Оглавление
Практическая работа 1 Конструирование шаростержневых моделей молекул органических веществ
Практическая работа 2 Качественное определение углерода, водорода и хлора в органических веществах
Практическая работа 3 Получение этилена и опыты с ним
Практическая работа 4 Свойства одноатомных и многоатомных спиртов
Практическая работа 5 Получение и свойства альдегидов
Практическая работа 6 Свойства уксусной кислоты
Практическая работа 7 Гидролиз жиров
Практическая работа 8 Гидролиз углеводов
Практическая работа 9 Решение экспериментальных задач на получение и распознавание органических веществ
Практическая работа 10 Свойства белков
Практическая работа 11 Решение экспериментальных задач по теме «Генетическая связь между классами органических соединений»
Практическая работа 12 Распознавание пластмасс и волокон
Критерии оценивания практических работ
В течение учебного года тетради для практических работ хранится в школе.
Отметка «5»:
· Эксперимент выполнен полностью. Сделаны правильные наблюдения и выводы,
· эксперимент осуществлен по плану, с учетом техники безопасности и правил работы с веществами и приборами,
· проявлены организационно-трудовые умения (поддерживается чистота рабочего места, порядок на столе, экономно используются реактивы).
· Допущены не более двух несущественных ошибок при оформлении работы.
Отметка «4»:
· работа выполнена, сделаны правильные наблюдения и выводы: эксперимент выполнен неполно или наблюдаются несущественные ошибки в работе с веществами и приборами.
Отметка «3»:
· ответ неполный, работа выполнена правильно не менее, чем наполовину, допущена существенная ошибка (в ходе эксперимента, в объяснении, в оформлении работы, по ТБ при работе с веществами и приборами), которую учащийся исправляет по требованию учителя. Допускается оформление работы без записи уравнений реакций.
· Эксперимент полностью выполнен в соответствии с инструкциями и правилами техники безопасности, но работа не оформлена.
Отметка «2»:
· Выполнено менее половины работы;
· допущены две или более существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, по ТБ при работе с веществами и приборами), которые учащийся не может исправить.
Отметка «1»:
· работа не выполнена,
· полное отсутствие экспериментальных умений.
Отработка практических работ не предусматривается при отсутствии учащегося на практической работе, при выполнении указанных работ на отметки «1» и «2».
В исключительных случаях при отсутствии учащегося по уважительным причинам учитель может предоставить возможность выполнить практическую работу.
Оценка умений решать экспериментальные задачи
При оценке этого умения следует учитывать наблюдения учителя и предъявляемые учащимся результаты выполнения опытов.
Отметка «5»:
· План решения задачи составлен правильно,
· осуществлен подбор химических реактивов и оборудования,
· эксперимент выполнен полностью,
· дано полное объяснение и сделаны выводы.
Отметка «4»:
· план решения составлен правильно,
· осуществлен подбор химических реактивов и оборудования,
· эксперимент выполнен полностью,
· допущено не более двух несущественных ошибок (в объяснении и выводах).
Отметка «3»:
· план решения составлен правильно,
· осуществлен подбор химических реактивов и оборудования,
· эксперимент выполнен не менее, чем наполовину, допущена существенная ошибка в объяснении и выводах,
· эксперимент выполнен полностью, отчет не составлен
· допущены нарушения техники безопасности, эксперимент выполнен полностью, сделаны несущественные ошибки в объяснении и выводах.
Отметка «2»:
· допущены две и более ошибки (в плане решения, в подборе химических, реактивов и оборудования, в объяснении и выводах).
· допущены нарушения техники безопасности
Планируемые результаты: Объяснять причины многообразия органических веществ и особенности строения атома углерода. Различать понятия «валентность» и «степень окисления», оперировать ими. Отражать состав и строение органических соединений с помощью структурных формул и моделировать их молекулы. Различать понятия «изомер» и «гомолог».
Цель урока: научить составлять структурные формулы и шаростержневые модели молекул алканов и алкенов по их молекулярным формулам; организовать исследовательскую деятельность, направленную на усвоение знаний по изомерии и гомологии органических веществ.
Оборудование: пластмассовые шарики белого и чёрного цвета или пластилин двух контрастных цветов.
Ход работы:
1. Повторите гомологический ряд алканов, понятия «гомолог», «изомер».
2. Составьте шаростержневую модель молекулы метана:
- возьмите из набора шарик черного цвета, который будет символизировать атом углерода, и необходимое число шариков белого цвета, которые будут символизировать атомы водорода;
- используя детали набора, необходимые для соединения шариков, составьте шаростержневую модель молекулы метана.
3. Составьте шаростержневую модель молекулы пропана:
- исходя из модели молекулы метана, составьте модель молекулы пропана;
- отнимите от модели молекулы метана шарик белого цвета (символ атома водорода) и на его место прикрепите черный шарик (символ атома углерода), к которому добавьте еще один шарик — символ другого атома углерода;
- далее, используя детали набора, необходимые для построения модели молекулы, дополните ее до модели молекулы пропана;
- проверьте возможность вращения атомов углерода вокруг одинарной связи С—С.
4. Зарисуйте модель молекулы пропана, отражающую пространственное изображение связей, используя обозначения: темный клин — это связи, выступающие над плоскостью рисунка, пунктирная линия — связи, уходящие за плоскость рисунка, сплошная линия — связи, лежащие в плоскости рисунка.
5. Составьте шаростержневые модели цис- и транс-изомеров молекулы бутена-2:
- используйте тот же способ построения модели, что и для пропана;
- проверьте возможность совмещения моделей изомеров друг с другом и вращения атомов вокруг связи С=С с переходом на модели любого изомера.
Сделайте вывод о проделанной работе.
Д/з (модели изготовить из пластилина)
I вариант
1.Составьте структурную формулу для вещества С5Н12.Изобразите её в тетради.
2.Соберите шаростержневую модель молекулы. Изобразите её в тетради.
3.Составьте одну молекулярную формулу гомолога для этого вещества. Запишите её структурную формулу в тетради.
4.Соберите шаростержневую модель молекулы для этого гомолога. Изобразите её в тетради.
5.Запишите структурную формулу одного изомера для пентана.
II вариант
1.Составьте структурную формулу для вещества С6Н14.Изобразите её в тетради.
2.Соберите шаростержневую модель молекулы. Изобразите её в тетради.
3.Составьте одну молекулярную формулу гомолога для этого вещества. Запишите её структурную формулу в тетради.
4.Соберите шаростержневую модель молекулы для этого гомолога. Изобразите её в тетради.
5.Запишите структурную формулу одного изомера для гексана.
Планируемые результаты: Проводить и наблюдать химический эксперимент. Определить наличие основных химических элементов органических веществ.
Цель работы: определить наличие углерода, водорода и хлора в органических веществах с помощью химических реакций.
Оборудование и реактивы: порошок оксида меди, парафин, керосин, вазелиновое масла, сульфат меди, известковая вода, тетрахлорметан, медь, спиртовка, спички, металлический штатив.
Ход работы:
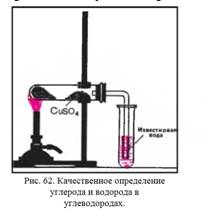
1.
Качественный состав жидких и твердых углеводородов можно установить
путем окисления их оксидом меди (II).
Поместите в сухую пробирку 1 г порошка оксида
меди (II) и очень немного (0,2 г) парафина, керосина или вазелинового масла.
Жидкие нефтепродукты должны пропитать оксид меди (II). Пробирку с парафином
для этой цели следует подогреть, чтобы твердый нефтепродукт расплавился.
Придав пробирке горизонтальное положение,
внесите в нее немного обезвоженного медного купороса и закройте пробкой с
газоотводной трубкой так, чтобы порошок сульфата меди (II) находился возле
пробки. Конец газоотводной трубки опустите в пробирку с известковой водой.
Нагревайте несильно смесь веществ. Что замечаете
на стенках пробирки? Какие изменения происходят с сульфатом меди (II) и
известковой водой?
Прекратите опыт. После того как пробирка
остынет, удалите из нее сульфат меди (II) и извлеките продукты реакции. Во что
превратился оксид меди (II) при окислении углеводородов?
Какой вывод можно сделать о качественном составе
взятых для исследования нефтепродуктов на основании проведенного опыта?
Составьте уравнение реакции полного окисления оксидом меди (II) предельного
углеводорода, в состав молекулы которого входят 14 атомов углерода.
2. Наличие хлора можно
установить при нагревании органического вещества с медью: хлор образует с
медью летучую соль, окрашивающую пламя в характерный зеленый цвет.
Сделайте спираль на конце медной проволочки и
прокалите ее в пламени горелки до тех пор, пока пламя от спирали уже не будет
окрашиваться.
Прикоснитесь спиралью к 2—3 каплям
тетрахлорметана и затем вновь поместите спираль в пламя горелки.
Наблюдайте зеленое окрашивание пламени,
свидетельствующее о наличии хлора во взятом органическом растворителе.
Таким же способом проверьте, содержится ли хлор
в другом выданном вам для исследования образце.
Планируемые результаты: Характеризовать строение, свойства, способы получения и области применения этилена. Наблюдать, самостоятельно проводить и описывать химический эксперимент.
Устанавливать зависимость между типом строения углеводорода и его химическими свойствами на примере логических связей: предельный — реакции замещения, непредельный — реакции присоединения.
Цель работы: получить этилен и провести реакции, характеризующие его свойства.
Оборудование и реактивы: этанол, концентрированная серная кислота, раствор йода, раствор перманганата калия, прокаленный песок, спиртовка, спички, штатив для пробирок, металлический штатив.
Ход работы:
1. В пробирку налейте 2 мл смеси этилового спирта и концентрированной серной кислоты. Затем всыпьте немного прокалённого песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой. Закрепите её в штативе. Осторожно нагрейте.
2. Возьмите пробирку с раствором йода. Пропускайте через него выделяющийся газ до обесцвечивания раствора. Что доказывает этот опыт? Составьте соответствующее уравнение реакции.
3. Возьмите пробирку с раствором перманганата калия. Пропускайте через него выделяющийся газ до обесцвечивания раствора. Что доказывает этот опыт? Составьте соответствующее уравнение реакции.
4. Сделайте вывод о проделанной работе.
Планируемые результаты: Характеризовать строение, свойства, способы получения и области применения этанола и глицерина с помощью родного языка и языка химии. Классифицировать спирты по их атомности. Наблюдать, самостоятельно проводить и описывать химический эксперимент.
Цель работы: познакомиться с физическими и химическими свойствами одноатомных спиртов; изучить особые свойства многоатомных спиртов.
Оборудование и реактивы: этиловый и изоамиловый спирт, вода, медная проволока, сульфат меди, гидроксид натрия, глицерин, спиртовка, спички, щипцы для пробирок, штатив для пробирок.
Ход работы.
Опыт 1. Растворимость спиртов в воде.
В отдельные пробирки прилейте по 1 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой.
1. В чем причина различного «поведения» спиртов в воде? 2. Почему изоамиловый спирт отслаивается над водой, а не наоборот? 3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
Опыт 2. Дегидрирование
этанола
Отмерьте мерной пробиркой 1 мл этанола. В чистую пробирку налейте 1мл этанола,
раскалите на спиртовке медную проволоку, погрузите в этанол медную проволоку.
Повторите процедуру несколько раз. Какой ощущается запах?
Опыт 3. Получение глицерата меди.
В пробирку налейте около 1 мл 10% ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II). К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета. 1. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции. 2. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II). 3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Сделайте общий вывод.
Планируемые результаты: Характеризовать особенности свойств формальдегида и ацетальдегида на основе строения молекул, способы получения и их области применения с помощью родного языка и языка химии. Наблюдать, описывать и проводить химический эксперимент. Соблюдать правила экологически грамотного и безопасного обращения с горючими и токсичными веществами в быту и окружающей среде.
Цель работы: получить уксусный альдегид и изучить его свойства.
Оборудование и реактивы: этанол, медная проволока, формалин, этаналь, аммиачный раствор нитрата серебра, гидроксид натрия, сульфат меди, спиртовка, штатив для пробирок.
Ход работы:
Опыт 1. Получение
этаналя.
В чистую пробирку налейте 1мл этанола, раскалите на спиртовке медную проволоку,
погрузите её в этанол. Повторите процедуру несколько раз. Какой
ощущается запах? Запишите уравнение соответствующей реакции.
Опыт 2. Реакция «серебряного зеркала».
В пробирку налейте 2 мл раствора формалина и добавьте несколько капель аммиачного раствора нитрата серебра. Пробирку нагрейте до появления серебра на стенках пробирки. Запишите уравнение реакции.
Опыт 3.Взаимодействие этаналя с гидроксидом меди (II).
1. Налейте в пробирку 1 мл раствора этаналя и столько же раствора гидроксида натрия.
2. Затем добавьте несколько капель раствора сульфата меди (II). Пробирку с полученным раствором нагрейте. Что наблюдаете?
3.Напишите уравнение реакции между сульфатом меди (II) и гидроксидом натрия. Напишите уравнение реакции взаимодействия этаналя с полученным раствором гидроксидом меди (II).
Запишите общий вывод по работе.
Планируемые результаты: Характеризовать способы получения и области применения уксусной кислоты с помощью языка химии. Различать общее и особенное в строении и свойствах органических и неогранических кислот описывать и проводить химический эксперимент. Соблюдать правила экологически грамотного и безопасного обращения с горючими и токсичными веществами в быту и окружающей среде и неорганических кислот. Наблюдать, описывать и проводить химический эксперимент. Соблюдать правила экологически грамотного и безопасного обращения с горючими и токсичными веществами в быту и окружающей среде.
Цель: экспериментальным путём определить, проявляет ли уксусная кислота, как одноосновная карбоновая кислота, свойства, характерные для других кислот.
Оборудование и реактивы: ацетат натрия, раствор серной кислоты, уксусная и соляная кислоты, гидроксид натрия, порошок магния, лакмусовая бумажка, карбонат натрия, штатив для пробирок.
Ход работы:
1. Получение уксусной кислоты.
Поместите в пробирку 3—4 г ацетата натрия и прибавьте примерно 2—3 мл раствора серной кислоты (1:1). Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустите в пустую пробирку. Нагревайте смесь веществ на пламени до тех пор, пока в пробирке-приемнике соберется 1—2 мл жидкости. Обратите внимание на запах уксусной кислоты.
2. Свойства уксусной кислоты
Эксперименты выполняйте по вариантам, но одновременно, сравнивая результаты.
1 вариант
1. Возьмите 4 пробирки; в одной лакмусовая бумажка, во второй – порошок магния, в третьей - гидроксид натрия (NaОН) (добавьте туда несколько капель фенолфталеина), в четвёртой – Na2CO 3.
2. В каждую из четырёх пробирок добавьте по 3-5 капель уксусной кислоты.
3. Внимательно наблюдайте за химическими реакциями.
4. Сравните результаты эксперимента с соседом по парте.
5. Укажите, в чем сходство свойств уксусной и разбавленной соляной кислот.
6. Оформите отчет о работе в таблице.
7. Сделайте общий вывод о проделанной работе, исходя из цели.
2 вариант
1. Возьмите 4 пробирки; в одной лакмусовая бумажка, во второй – порошок магния, в третьей - гидроксид натрия (NaОН) (добавьте туда несколько капель фенолфталеина), в четвёртой – Na2CO 3.
2. В каждую из четырёх пробирок добавьте по 3-5 капель соляной кислоты.
3. Внимательно наблюдайте за химическими реакциями.
4. Сравните результаты эксперимента с соседом по парте.
5. Укажите, в чем сходство свойств уксусной и разбавленной соляной кислот.
6. Оформите отчет о работе в таблице.
7. Сделайте общий вывод о проделанной работе, исходя из цели.
Приложение 4
Таблица результатов:
|
№ |
Название опыта |
Наблюдения |
Уравнения реакций |
|
1 |
Действие ___________ кислоты на индикатор |
|
|
|
2 |
Взаимодействие ____________ кислоты с магнием
|
|
|
|
3 |
Взаимодействие ____________ кислоты с основаниями |
|
|
|
4 |
Взаимодействие ____________ кислоты с солями |
|
|
|
Вывод (ответ на проблемный вопрос):
|
|||
|
Специфические свойства:
|
|||
Планируемые результаты: На основе реакции гидролиза характеризовать состав и свойства сложных эфиров. Наблюдать, описывать и проводить химический эксперимент.
Цель: изучить реакцию омыления и гидрирования жиров.
Оборудование и реактивы: образцы жира, вода, ацетон, бензин, гидроксид натрия, спиртовка, спички, зажим для пробирок, штатив для пробирок.
Ход работы:
Задание.
1. Составьте формулу жира.
Вариант 1. Глицерин и масляная кислота.
Вариант 2. Глицерин и стеариновая кислота.
Вариант 3. Глицерин и пальметиновая кислота.
2. Отношение жира к нагреванию.
3. Отношение жира к растворителям (вода, ацетон, бензин).
4. Отношение жира к раствору щелочи.
5. Оформите работу в виде таблицы:
|
№ |
Что делаю? |
Что наблюдаю? |
Уравнение реакции |
|
1 |
|||
|
2 |
|||
|
3 |
|||
|
4 |
1. Сделайте вывод
2. Ответьте на вопросы для контроля.
Вопросы для контроля:
1. Что называется жирами?
2. Какие кислоты входят в состав жиров?
3. Что такое гидролиз жира?
4. Что такое гидрирование жира?
5. Что такое реакция омыления?
6. Каковы функции жиров в организме?
Планируемые результаты: Наблюдать, описывать и проводить химический эксперимент. Соблюдать правила техники безопасности при работе в кабинете химии.
Цель работы: провести реакции гидролиза ди- и полисахаридов.
Оборудование и реактивы: растворы сахарозы, сульфата меди, гидроксида натрия, крахмал, концентрированная серная кислота, фильтровальная бумага, водяная баня.
Ход работы
Задание 1. Гидролиз сахарозы.
1. В две пробирки поместите по 10 капель раствора сахарозы.
2. В одну пробирку добавьте 1 – 2 капли 10 %–го раствора серной кислоты.
3. Пробирку с подкисленным раствором сахарозы поставьте в почти кипящую водяную баню. Через 20 минут пробирку достаньте и охладите.
4. В обе пробирки прибавьте по 1 капле раствора сульфата меди и по каплям прибавляйте 10 % –й раствор гидроксида натрия до появления интенсивно–синей окраски, свидетельствующий о полной нейтрализации кислоты.
5. Нагрейте обе пробирки на водяной бане. В обеих ли пробирках появилась оранжево–желтая окраска?
Задание 2. Гидролиз крахмала.
1. Поместите в пробирку 10 капель крахмального клейстера и добавьте 2 капли 10 %–го раствора серной кислоты.
2. Поставьте пробирку в кипящую водяную баню. Через 30 минут пробирку выньте. Раствор стал прозрачным.
3. К полученному раствору добавьте 1 каплю раствора сульфата меди и по каплям добавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски.
4. Нагрейте пробирку на водяной бане. Появляется оранжево–желтая окраска.
Задание 3. Гидролиз целлюлозы.
При выполнении этого задания необходимо соблюдать особую осторожность!
1. Поместите в пробирку мелкоизмельченный кусочек фильтровальной бумаги и добавьте 1–3 капли (ОСТОРОЖНО!) концентрированной серной кислоты так, чтобы кислота смочила бумагу.
2. Смесь осторожно нагрейте (обычно достаточно тепла руки) до почти полного растворения целлюлозы.
3. К полученному раствору добавьте 10 капель воды, хорошо перемешайте и поместите пробирку в кипящую водяную баню на 30 минут.
4. По окончании реакции к небольшой порции раствора прибавьте 1 каплю раствора сульфата меди и по каплям добавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски.
5. Нагрейте пробирку на водяной бане. Появляется оранжево–желтая окраска.
Оформление результатов
Оформите проведенные исследования в виде таблицы. Сделайте выводы о структуре полисахаридов и продуктах его гидролиза.
|
№ задания |
Исследуемое вещество |
Наблюдаемое явление |
Вывод |
|
|
|
|
|
Сделайте общий вывод о проделанной работе.
Планируемые результаты: знать строение. Способы получения и свойства органических веществ, уметь составлять план выполнения эксперимента, строить гипотезу, соблюдать правила техники безопасности.
Цель работы: распознать вещества.
Оборудование и реактивы: уксусная кислота, лакмус, раствор глюкозы, гидроксид натрия, сульфат меди, раствор йода, картофель, белый хлеб, спиртовка, спички, держатель для пробирок, штатив для пробирок.
Ход работы:
Даны вещества: уксусная кислота, глюкоза, глицерин, крахмал.
|
Что делали |
Что наблюдали |
Уравнения реакций |
Выводы |
|
|
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты
Добавить к 1 мл уксусной кислоты немного лакмуса. Наблюдается изменение цвета раствора с фиолетового на красный. Значит, в растворе присутствуют катионы водорода.
2. Распознавание глюкозы
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди (II). Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина
К 2 мл глицерина прилить свежеосажденный гидроксид меди(II). Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4.Распознавание крахмала.
Капнем раствором йода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
Сделайте общий вывод.
Планируемые результаты: Закрепить понятие о химических свойствах белков.
Проводить, наблюдать и описывать химический эксперимент.
Цель: провести реакции, характеризующие свойства белков.
Оборудование и реактивы: раствор яичного белка, гидроксид натрия, сульфат меди, раствор соляной кислоты, этиловый спирт, нитрат серебра, штатив с пробирками.
Цветные реакции на белки
Опыт 1. Биуретовая реакция на пептидную связь.
|
Что делали |
Что наблюдали |
|
В пробирку вносят 1мл раствора яичного белка, 0,5 мл NaOH, несколько капель СuSO4, перемешивают. |
|
Опыт 2. Ксантопротеиновая реакция.
|
Что делали |
Что наблюдали |
|
К 5 каплям раствора яичного белка добавьте 3 капли азотной кислоты и (осторожно!) нагрейте. После охлаждения добавьте (желательно на осадок) 10 капель NaOH |
|
Необратимое осаждение белков.
Опыт 3. Осаждение белка кислотами
|
Что делали |
Что наблюдали |
|
В пробирку налейте 1 мл белка. Добавьте 1 мл соляной кислоты. |
|
Опыт 4. Осаждение белка солями тяжелых металлов.
|
Что делали |
Что наблюдали |
|
В 2 пробирки налейте по1 мл белка. В одну добавьте 1 мл СuSO4. Встряхните. В другую пробирку налейте AgNO3. |
|
Опыт 5. Осаждение белка этиловым спиртом.
|
Что делали |
Что наблюдали |
|
В пробирку налейте 1 мл белка. Добавьте 1 мл этилового спирта |
|
Задание. Оформите результаты работы в таблицу, записав название реакции, ход определения и наблюдения.
Сделайте вывод о проделанной работе.
Планируемые результаты: Устанавливать взаимосвязь между составом, строением и свойствами представителей классов углеводородов и кислород- и азотсодержащих соединений. Описывать генетические связи между классами углеводородов и их производных.
Цель: используя знания, полученные при изучении неорганической и органической химии осуществить практически превращения.
Оборудование и реактивы: растворы HCl, NaOH, H2SO4, CuSO4, медная проволока, штатив с пробирками, спиртовка, спички.
Ход работы.
Осуществить практически следующие превращения:
C2H5OH → CH3COH → CH3COOH
↓
CO2
Уточнения условий проведения опытов.
1. Горение спирта. В фарфоровую чашечку поместить 10 – 15 капель этанола, поджечь его лучинкой. Обратить внимание на цвет пламени.
2. Окисление этанола оксидом меди (II). В пробирку налить примерно 0,5 мл этанола. Спираль из медной проволоки нагреть в пламени спиртовки до появления черного налета оксида меди (II). Горячую спираль опустить в пробирку с этанолом. Черная поверхность спирали становится золотистой вследиствии восстановления оксида меди (II) до меди. Появляется характерный запах уксусного альдегида.
3. Окисление уксусного альдегида. В пробирку налить 2 – 3 мл гидроксида натрия и добавить к нему несколько капель сульфата меди (II). Небольшое количество полученного гидроксида меди (II) добавить к уксусному альдегиду и нагреть на спиртовке.
Результаты оформить в виде таблицы:
|
№ |
Что делали. |
Уравнения реакций. |
Наблюдения и выводы. |
Сделайте общий вывод о проделанной работе.
Планируемые результаты: Описывать отдельных представителей пластмасс и волокон, их строение и классификацию. Опытным путём определять и распознавать высокомолекулярные соединения (пластмассы и волокна).
Цель работы: опытным путём распознать вещества: пластмассы и волокна.
Оборудование и реактивы: образцы пластмасс и волокон, спиртовка, спички, стеклянная палочка.
Ход работы:
I. Распознавание пластмасс
В фарфоровых чашечках под номерами даны образцы пластмасс.
Первый этап работы.
Распознавание пластмасс следует начать с внешнего осмотра (цвет, твёрдость, эластичность и т. д.) Обратите внимание на то, что образцы из полиэтилена жирны на ощупь, полупрозрачны, эластичны, механически прочны, могут иметь различную окраску. Образцы из поливинилхлорида эластичны, механически прочны, могут иметь различную окраску. Полистирольные образцы прозрачны, хрупки, различной окраски. Образцы из оргстекла прозрачны, жестки, различной окраски, механически прочны. Фенолформальдегидные пластмассы тёмных тонов (от коричневого цвета до чёрного), жестки, прочны. Изделия из целлулоида эластичны, различной окраски, имеют характерный рисунок (под мрамор, малахит). Занесите свои наблюдения в отчёт о проделанной работе.
Второй этап работы.
Определяете отношение пластмасс к нагреванию и характеру горения.
Опыт 1. Предметное стекло с образцом полимера подержите с помощью держателя над пламенем спиртовки. Нагревание образца ведите несколько секунд. Затем стеклянной палочкой попытайтесь изменить его форму. После остужения можно снова нагреть этот образец и снова изменить его форму. Данные эксперимента сравните с данными таблицы 1 « Распознавание пластмасс».
Опыт 2. Кусочек образца пластмассы внесите в пламя спиртовки. Когда образец загорится, выньте его из пламени. Продолжает ли он гореть вне пламени? Каким пламенем горит? Погасите пламя, если обильно выделяется копоть. Свои наблюдения сверьте с данными
таблицы 1 « Распознавание пластмасс».
Отчёт о проделанной работе
|
№ образца |
Внешний вид пластмассы |
Отношение к нагреванию |
Характер горения |
Название пластмассы |
Структурное звено пластмассы |
II. Распознавание волокон
В лотке под номерами находятся различные волокна.
Анализ волокна или образца ткани начинают с испытания путём сжигания. Пучок волокна на стеклянной палочке внесите в пламя. Как только он загорится, уберите его из пламени и тщательно рассмотрите. Если волокно перестанет гореть, его снова зажигают. При этом необходимо проследить: а) с какой скоростью происходит горение, б) запах продуктов разложения, в) характер остатка после горения.
Сверьте свои наблюдения с таблицей 2. «Распознавание волокон» и заполните отчёт о проделанной работе.
Отчёт о проделанной работе
|
№ образца волокна |
Характер горения |
Название волокна |
Структурное звено волокна |
Сделайте вывод о проделанной работе.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.