
Лекция № 16
Химические процессы при горении водорода.
Горение углеводородов и углерода.
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств[1]. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около 50 МДж/кг).
Смеси водорода с кислородом или воздухом взрывоопасны и называются гремучим газом (название происходит от knallgas, нем. knall — громкий хлопок, резкий звук выстрела или взрыва). При зажигании искрой или другим источником смесь водорода с воздухом небольшого объёма сгорает чрезвычайно быстро, с громким хлопком, что субъективно воспринимается как взрыв. В физике горения такой процесс считается медленным горением, или дефлаграцией, однако гремучий газ способен и к детонации, при этом действие взрыва оказывается существенно более сильным.
Наиболее опасны околостехиометрические смеси, где на один моль кислорода приходится два моля водорода, то есть, с учётом того, что в воздухе соотношение кислорода и азота по объёму составляет примерно 1:3,76, объёмное соотношение водорода с воздухом в гремучем газе в стехиометрическом соотношении составляет 2:4,76 ≈ 0,4. Однако гремучий газ способен гореть в широком диапазоне концентраций водорода, от 4 — 9 объёмных процентов в бедных смесях до 75% в богатых смесях, приблизительно в этих же пределах он способен и детонировать[2].
Гремучий газ самовоспламеняется при атмосферном давлении и температуре 510 °C. При комнатной температуре в отсутствие источников зажигания (искра, открытое пламя) гремучий газ может храниться неограниченно долго, однако он способен взорваться от самого слабого источника, так как для инициирования взрыва достаточно искры с энергией 17 микроджоулей[3]. С учётом того, что водород обладает способностью проникать через стенки сосудов, в которых он хранится, например, диффундировать сквозь металлические стенки газового баллона, и не обладает никаким запахом, при работе с ним следует быть чрезвычайно осторожным.
Химические процессы при горении водорода
Взаимодействие молекулы водорода с
молекулой кислорода протекает сложным путем через ряд последовательных стадий.
В настоящее время твердо установлено, что горение водорода происходит по
цепному механизму, причем роль активных центров играют частицы ![]() . Последовательность и значение элементарных реакций при
горении водорода описаны очень подробно для различных условий возникновения и
развития водородных пламен.
. Последовательность и значение элементарных реакций при
горении водорода описаны очень подробно для различных условий возникновения и
развития водородных пламен.
Наиболее подробный анализ процесса горения водорода в режиме самовоспламенения экспериментальным и расчетным методами выполнен профессором А. Н. Баратовым. Им предложена следующая схема процесса, включающая четырнадцать основных элементарных реакций:
— зарождение активных центров происходит по реакции
![]()
— продолжение цепей по реакциям
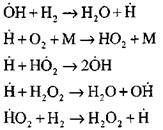
(0)
(1)
(2) (3) (4) (5)
— разветвление цепей
|
|
(6) (7) (8)
Обрыв цепей
|
|
(9) (10)
(П) (12) (13)
Концентрация атомов водорода в начальной стадии процесса самовоспламенения составляет незначительную часть от начального содержания водорода. При развитии цепной реакции скорость превращения молекулярного водорода становится столь высокой, что он расходуется за сотые доли секунды.
Горение оксида углерода и углеводородов.
По разветвленным цепным реакциям протекает горение и других составляющих газообразных топлив: оксида углерода, метана и других углеводородов. На горение оксида углерода существенное влияние оказывает наличие в газе паров воды, которые участвуют в реакциях продолжения цепей. Поэтому в выражение для скорости горения оксида углерода входит концентрация паров воды:
![]() . (3.7)
. (3.7)
Как показывает эксперимент, сухой оксид углерода практически не горит. Это связано с тем, что в отсутствие радикалов Н и ОН горение СО не имеет разветвленного цепного механизма. При появлении атомарного кислорода О2 + ν = 2О, он тут же вступает в реакцию с оксидом углерода О + СО = СО2, что приводит к обрыву цепей. Появление в смеси радикалов Н и ОН приводит к образованию дополнительных радикалов О (Н + О2 = ОН + О). Кроме того, при протекании реакции ОН + СО = СО2 + Н дополнительно генерируются радикалы Н, что приводит к разветвленному механизму горения СО. Таким образом, при помощи водяных паров или водорода в пламени создаются концентрации Н и ОН, необходимые для реакций разветвления цепей.
Экспериментально установлено, что скорость горения углеродов меньше, чем скорость горения водорода и оксида углерода. Горение их протекает по более сложным механизмам, одновременно с процессом горения углеводородов протекают реакции термического разложения с образованием сажистого углерода. Полное описание горения метана предполагает рассмотрение более 400 реакций. Основные из них следующие: реакция отщепления первого атома водорода от метана в присутствии кислорода (СН4 + О2 ® СН3 + Н + О2), образование радикалов О и ОН (Н + О2 ® ОН + О), реакции образования и окисления метанола и диссоциация формальдегида (СН3 + ОН ® СН3ОН, СН3ОН + О ® НСНО + Н2О, НСНО ® Н2 + СО) с образованием водорода и оксида углерода. Далее водород и оксид углерода сгорают по своим цепным механизмам. В отсутствии кислорода идет термическая диссоциация метана с образованием в конечном итоге сажистого углерода (СН4 = 2Н2 + С).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.