
ФИЗИКА 10 класс
Тема: Электрический ток в жидкостях. Закон электролиза.
Цели:
- разъяснить физическую природу электропроводности жидких проводников, осуществить вывод закона электролиза в свете электронных представлений;
- формировать умения обучающихся применять полученные знания при решении задач.
Задачи:
- рассмотреть основные понятия темы;
- продолжить формировать познавательный интерес к предмету;
- активизировать мыслительную деятельность,
- развивать познавательные интересы обучающихся, умение анализировать материал, обобщать, делать выводы.
Тип урока: урок усвоения новых знаний
Оборудование: ноутбук, проектор, учебники, видео «Электрический ток в жидкостях», опорный конспект, раздаточный материал.
Ход урока
1. Организационный момент. Актуализация знаний.
2. Изучение нового материала.
3. Закрепление нового материала.
4. Подведение урока и рефлексия.
5. Домашнее задание.
1. Изучение нового материала
1) Демонстрация опытов:
Цель: выделить водород и кислород из воды.
Методика: электроды, погружённые в воду, ставят вертикально и накрывают пробирками, которые в начале эксперимента полностью заполнены водой. К концу опыта вода из пробирок вытесняется: в одной пробирке – кислород, в другой – водород.
Результат: соотношение выделения водорода к кислороду – 2 к 1, поскольку каждая молекула воды состоит из двух атомов водорода и одного атома кислорода.
Цель: пропустить ток через раствор поваренной соли (NaCl).
Методика: в раствор помещают два электрода – анод (положительный) и катод (отрицательный). Обычно используются инертные электроды, такие как уголь или платина.
Результат: на аноде выделяется газообразный хлор (Cl₂), а на катоде – газообразный водород (H₂), а также образуются гидроксид-ион (OH⁻) и натрий-ион (Na⁺)
2) Проработать теоретический материал
Электрический ток в электролитах. Закон электролиза.
Фарадей, стремясь установить количественные соотношения между различными проявлениями электричества, начал экспериментальные исследования по электролизу, и в 1833-1834 годах открыл его законы (введя и сохранившуюся доныне терминологию в этой области). Эти законы явились серьёзным доводом в пользу дискретности вещества и электричества. Кроме того, открытие этих законов имело, конечно, большое практическое значения для электрохимии и техники.
Жидкости в степени электропроводности делятся на диэлектрики (дистиллированная вода), проводники (электролиты), полупроводники (расплавленный селен).
Электролит представляет собой проводящую жидкость (растворы кислот, щелочей, солей и расплавленных солей). Электролитическая диссоциация представляет собой разложение молекул электролита на ионы при растворении в воде или плавлении. Степень диссоциации - это доля молекул, которые распадаются на ионы. Электропроводность электролитов является ионной. Ионная проводимость - это проводимость водных растворов или расплавов электролитов, которая осуществляется ионами. Проход электрического тока связан с переносом вещества.
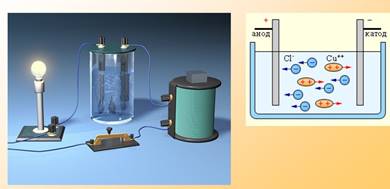
Электролиз - процесс выделения на электроде вещества, связанного с окислительно-восстановительными реакциями.
Закон электролиза открыт в 1833 году Майклом Фарадеем.
Масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду суммарный электрический заряд, прошедший через поверхность электрода
![]()
Закон Фарадея: m = kI∆t
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе при прохождении электрического тока.
![]()
k - электрохимический эквивалент вещества, численно равного массе вещества, выделяемого на электроде, когда он проходит через зарядный электролит в 1 Кл.
Применение электролиза: получение чистых металлов (очистка от примесей); гальваностегия (никелирование, хромирование и т. д.); гальванопластика, то есть получение отслаивающихся покрытий (рельефные копии).
Электролиз широко применяется в технике для различных целей. Электролитическим путем покрывают поверхность одного металла тонким слоем другого – хромирование, никелирование, омеднение. Такие покрытия защищают поверхность от коррозии.
Процесс декоративного или антикоррозийного покрытия металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение, серебрение) называется гальваностегия.
Если электролитическое покрытие будет хорошо отслаиваться от поверхности, на которую осаждается металл, то можем получить копию с рельефной поверхности. В полиграфической промышленности такие копии получают с матриц, на поверхности которых осажден толстый слой железа или другого вещества. Это позволяет получить большое количество копий печатной продукции.
Гальванопластика – это электролитическое изготовление металлических копий, рельефных предметов. Этот процесс был разработан ученым Б. С. Якоби в 1836 году.
Электрометаллургия – это получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд.
Рафинирование металлов – это очистка металлов от примесей с помощью электролиза, когда неочищенный металл является анодом, а на катоде оседает очищенный.
2. Закрепление нового материала.
1) Примеры и разбор решения заданий:
1. Источник тока присоединили к двум пластинам, опущенным в раствор поваренной соли. Сила тока в цепи равна 0,3 А. Какой заряд проходит между пластинами в ванне за 7 минут?
Решение: Сила тока равна отношению заряда ко времени, в течение которого этот электрический заряд прошёл по цепи:
![]() , q = I*∆t
, q = I*∆t
Подставив числовые значения, переведя время в СИ, получим q = 0,3*420 = 126 Кл.
Правильный ответ: q = 126 Кл.
2. В процессе электролиза из водного раствора хлорида железа-2 выделилось 840 мг железа. Какой заряд прошёл через электролитическую ванну?
Решение:
![]()
![]()
q = 840*10-6*1,6*10-19*2*6,02* 1023/ 0,056 = 2880 Кл.
Ответ: q = 2880 Кл.
2) Выполнить самостоятельно
При проведении данного этапа используется индивидуальная форма работы: обучающиеся самостоятельно выполняют задания нового типа и осуществляют их самопроверку, пошагово сравнивая с эталоном.
1. Решить задачу
Определите массу серебра, выделившегося на катоде при электролизе азотнокислого серебра за 2 ч, если к ванне приложено напряжение 1,2 В, а сопротивление ванны равно 5 Ом.
А. 1,9 г. Б. 2,9 г. В. 3,9 г. Г. 4,9 г.
2. Ответить на вопросы:
1. Какие вещества называются электролитами?
2. Дайте определение: электрической диссоциации; степени диссоциации; рекомбинацией.
3. Какой процесс называется электролизом? Кто и когда открыл?
4. Сформулируйте закон Фарадея?
5. Физический смысл электрохимического эквивалента вещества и постоянной Фарадея?
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками?
2) Почему для гальванического покрытия изделия чаще используют никель и хром?
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи?
4. Выставление оценок.
5. Рефлексия: Приём «Рефлексивный экран» используется для подведения итогов урока, обсуждения того, что узнали, и того, как работали – т.е. каждый оценивает свой вклад в достижение поставленных в начале урока целей, свою активность, эффективность работы группы, увлекательность и полезность выбранных форм работы. Обучающиеся высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
Сегодня я узнала…
Мне было интересно…
Мне было трудно…
Я научилась…
Я смогу…
Я попробую…
6. Домашнее задание: Учить § 113, написать конспект.
1. Подготовить сообщение «Возможности использования электролиза в промышленности».
Информационные источники (основные учебники по предмету)
1. Мякишев Г.Я. Физика. 10 класс. Учеб. для общеобразоват. организаций: базовый уровень / Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский; под ред. Н.А. Парфентьевой – М.: Просвещение, 2016. – 416 с.: ил. – (Классический курс).
Источники Интернет
1. http://class-fizika.ru/10_a155.html
2. https://zaochnik.com/spravochnik/fizika/postojannyj-elektricheskij-tok/elektricheskij-tok-v-elektrolitah/
3. Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.