
государственное автономное профессиональное образовательное учреждение
Челябинской области «Политехнический колледж»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА УЧЕБНОГО ЗАНЯТИЯ
по дисциплине ОП.03 Аналитическая химия
на тему «ГИДРОЛИЗ СОЛЕЙ»
для специальности
18.02.01 Аналитический контроль качества химических соединений
Разработала:
Коптева Н.В.
Преподаватель высшей категории
Магнитогорск, 2023
Аннотация
Тема «Гидролиз солей» входит в раздел «Теоретические основы аналитической химии». Студентами уже освоены основные понятия и законы химии (закон действия масс, теория электролитической диссоциации, понятие о растворах, рН), они обладают навыками составления уравнений диссоциации кислот, оснований и солей. Это позволяет применить полученные знания и навыки для изучения гидролиза солей. Качественное усвоение материала данного занятия готовит студентов к изучению следующих разделов аналитической химии «Качественный анализ», «Количественный анализ».
При отборе содержания урока учитывались принципы научности, доступности, последовательности.
Для активизации внимания, актуализации знаний использован фронтальный опрос, что позволило проверить степень усвоения опорных знаний по пройденной теме, подготовить учащихся к восприятию нового материала. Выбранная форма позволяет рационально использовать время.
При изучении нового материала используется демонстрационный эксперимент. Это способствует развитию познавательной активности студентов, лучшему усвоению материала. На занятии применяются разные формы организации учебной деятельности: коллективная – фронтальная, самостоятельная - индивидуальная, парная, что способствует реализации склонностей и возможностей студентов, их творческих способностей; формированию умения работать в коллективе.
Тема «Гидролиз солей» имеет прикладное значение. Поэтому внимание студентов было обращено на значение гидролиза в природе и жизни человека.
Работа на занятии организуется в режиме сотрудничества преподавателя со студентами и студентов между собой.
Учебное занятие № 49-50
Тема учебного занятия: Гидролиз солей
Цель учебного занятия
v Обучающая:
- актуализировать знания о процессе гидролиза солей, раскрыть сущность процесса гидролиза;
- сформировать навыки составления уравнений гидролиза солей, умения объяснять механизм реакции гидролиза;
- закрепить умения объяснять реакцию среды раствора присутствием соответствующих ионов;
- дать представление о практическом значении гидролиза в природе, народном хозяйстве, повседневной жизни человека, профессиональной деятельности студентов.
v Развивающая:
- развивать учебно-информационные навыки: извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов;
- развивать учебно-логические навыки: анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
- развивать учебно-организационные навыки: организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений;
- повышать уровень учебной мотивации и познавательный интерес студентов.
v Воспитательная:
- совершенствовать коммуникативные умения в ходе коллективного обсуждения, развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность.
Тип учебного занятия: формирование новых знаний и умений
Вид учебного занятия: лекция
Содержание урока
Механизм гидролиза солей различного состава, суть процесса гидролиза, роль гидролиза в природе и жизни человека.
Требования к знаниям и умениям студентов:
Должны знать: понятие «гидролиз солей», его сущность, типы гидролиза солей, зависимость среды раствора и продуктов гидролиза от состава исходной соли; значение гидролиза в природе и жизни человека, в профессиональной деятельности.
Должны уметь: объяснять процессы, протекающие в растворах солей, предсказывать реакцию раствора в зависимости от состава соли, подвергающейся гидролизу, образование кислых и основных солей в реакциях гидролиза, записывать сокращенные ионные и молекулярные уравнения реакций гидролиза.
Материально-техническое оснащение: ПСХЭ Д.И.Менделеева, таблица растворимости кислот, солей и оснований, оборудование и реактивы для демонстрационного эксперимента, раздаточный материал (тесты, задания).
Методы обучения
Проблемно-поисковый, практический, объяснительно - иллюстративный.
Формы организации учебной деятельности
Коллективная – фронтальная, самостоятельная - индивидуальная, парная.
Ход занятия
|
№ и название этапа учебного занятия |
Время |
Дидактические задачи этапа учебного занятия |
Деятельность преподавателя |
Деятельность студентов |
|
1. Организационный этап |
3 мин |
Подготовка студентов к работе |
Предъявление единых педагогических требований: § приветствие; § выявление отсутствующих; § организация учебного места |
Готовятся к учебному занятию |
|
Психологическая установка на восприятие материала |
Организация внимания и готовности студентов к учебному занятию |
|
||
|
2. Вводный этап учебного занятия |
20 мин |
Подготовка к основному этапу учебного занятия |
|
|
|
Сообщение темы |
|
|
Сообщение темы: Гидролиз солей |
Слушают и записывают тему |
|
Мотивация |
|
Создание личной заинтересованности в изучении темы Реализация связей: - межпредметных; - внутрипредметных |
Понимание процессов, происходящих при гидролизе солей, необходимо для объяснения явлений, происходящих в живых организмах, природных комплексах и системах. Многие вопросы биологии, медицины, гидрологии связаны с явлением гидролиза солей, поскольку он является основой их устойчивости и равновесия. Данная тема вам нужна будет в вашей профессиональной деятельности. |
Осознают значимость материала в формировании знаний |
|
Постановка цели |
|
Обеспечение понимания предстоящей учебной работы |
В результате изучения учебного материала вы должны: знать_типы гидролиза солей уметь составлять уравнения гидролиза солей, объяснять механизм гидролиза, определять среду раствора солей |
Слушают |
|
Входной контроль |
|
Актуализация опорных знаний. |
Фронтальный опрос Вопросы для контроля: 1. Какие вещества называются электролитами? 2. Какие электролиты относят к сильным? Приведите примеры. 3. Какие электролиты относят к слабым? Приведите примеры. 4. Дайте определение солей в свете теории электролитической диссоциации. 5. Какие типы солей вы знаете? 6. От чего зависит характер среды раствора? Чему равен рН раствора в кислой, нейтральной и щелочной среде? 7. Как экспериментально определить характер среды раствора? |
Отвечают на вопросы
|
|
Коррекция опорных знаний |
|
Выявление пробелов и внесение исправлений |
Разбор вопросов, вызвавших затруднения |
Восполняют и закрепляют знания |
|
3. Основной этап учебного занятия |
60 мин |
Обеспечение достижения основной цели учебного занятия |
|
|
|
Изучение нового материала Демонстрационный эксперимент |
30 мин |
|
Объяснение нового материала по плану: 1. Понятие гидролиза 2. Типы гидролиза солей · Гидролиз по катиону · Гидролиз по аниону · Совместный гидролиз · Полный гидролиз 3. Значение гидрролиза |
Слушают, записывают конспект в тетрадь Наблюдают демонстрационный эксперимент
|
|
Закрепление |
20 мин |
|
Организация деятельности студентов |
Выполняют задания (тест) |
|
Коррекция знаний и умений |
10 мин |
|
Исправление ошибок |
Работают по подведению итогов |
|
4. Заключительный этап учебного занятия |
7 мин |
Анализ и оценка успешности достижения целей учебного занятия |
1.Подведение итогов. Персональный и общий анализ работы. 2. Сообщение оценок |
Самооценка |
|
Задание для самостоятельной внеаудиторной работы |
|
Обеспечение понимания цели, содержания и способов выполнения |
|
Осмысление ориентировочной основы действий |
|
|
|
Постановка целей следующего занятия |
Сообщение |
Осваивают информацию предстоящей учебной деятельности |
Изучение нового материала
1. Понятие «Гидролиз»
Термин «Гидролиз» состоит из двух составных частей от греческого «гидро» – вода, «лизис» – разложение. Дословно, гидролиз – разложение водой.
Гидролиз – реакция обмена между солью и водой, приводящая к образованию слабого электролита и изменению рН среды.
Вода является слабым электролитом, и для смещения данного равновесия вправо необходимо, чтобы среди продуктов реакции был хотя бы один слабый электролит. Соли, образованные сильным основанием и сильной кислотой гидролизу не подвергаются. Растворы таких солей остаются нейтральными, рН = 7.
Катионы и анионы этих солей
не связывают ионы ![]() и
и ![]() воды,
т.к. не образуют с ними молекулы слабых электролитов.
воды,
т.к. не образуют с ними молекулы слабых электролитов.
NaCl + HOH → ![]() ←
NaOH + HCl
←
NaOH + HCl
В процессе гидролиза происходит обмен между солью и водой теми ионами, которые могут соединиться в молекулы слабодиссоциирующего вещества. При этом оставшиеся от воды ионы Н+ или ОН- накапливаются в растворе и обуславливают кислую или щелочную реакцию среды.
2. Типы гидролиза солей
· Гидролиз по катиону
Подвергаются соли, образованные слабым основанием и сильной кислотой
Катион – это положительно заряженная частица, а молекула воды полярна, условно можно представить ее состоящей из положительно заряженного атома водорода и отрицательно заряженной гидроксильной группы. Какую же часть молекулы воды оторвет и присоединит к себе катион?
Катионы соли связывают гидроксид-ионы ОН- воды, образуя молекулы слабого основания (в случае однозарядных ионов) или гидроксокатионы (в случае многозарядных ионов).
а) Соли однокислотных оснований:
NH4Cl ↔ NH4++ Cl-
![]() +
+ ![]() ↔
NH4OH +
↔
NH4OH + ![]()
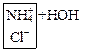 ↔
↔ 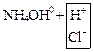
NH4Cl + H2O ↔ NH4OH + HCl
б) Соли многокислотных оснований:
![]() ↔
↔ ![]() +
+![]()
![]() + HOH ↔
+ HOH ↔ ![]() +
+ ![]()
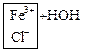 ↔
↔ 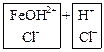
FeCl3 + HOH ↔ FeOHCl2 + HCl
Гидролиз солей по катиону идет обратимо; химическое равновесие сильно смещено влево.
Вывод: гидролиз по катиону приводит к образованию гидроксокатионов и кислой среды раствора (рН < 7).
· Гидролиз по аниону
Подвергаются соли, образованные слабой кислотой и сильным основанием
Анионы соли связывают протоны Н+ воды, образуя молекулы слабой кислоты (в случае однозарядных ионов) или гидроанионы (в случае многозарядных ионов).
а) Соли одноосновных кислот:
KCN ↔ ![]()
![]() ↔
↔ ![]()
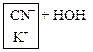 ↔
↔ 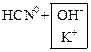
KCN + H2O ↔ HCN + KOH
б) Соли многоосновных кислот:
Na2CO3 ↔ ![]() +
+![]()
![]() + HOH ↔
+ HOH ↔ ![]() +
+ ![]()
![]() ↔
↔ ![]()
Na2CO3 + H2O ↔ NaHCO3 + NaOH
Гидролиз солей по аниону идет обратимо; химическое равновесие сильно смещено влево; реакция среды щелочная (рН > 7).
Вывод: гидролиз по аниону приводит к образованию гидроанионов и щелочной среды раствора (рН > 7).
· Совместный гидролиз
Подвергаются соли, образованные слабой кислотой и слабым основанием.
Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной в зависимости от значений константы диссоциации слабого основания и слабой кислоты, которые образуются в результате гидролиза.
Если Kд(осн) > Kд(кисл), то среда будет слабощелочной.
Если Kд(кисл) > Kд(осн), то среда будет слабокислой.
Если Kд(осн) = Kд(кисл), ионы соли гидролизуются в равной степени, и среда будет нейтральной.
Образующиеся в процессе гидролиза ионы Н+ и ОН‑ связываются в молекулы воды H2O, что приводит к смещению равновесия вправо, то есть к усилению гидролиза.
а) Соли, образованные однозарядными ионами:
![]() ↔
↔ ![]() +
+![]()
Записываются ионные уравнения по катиону и по аниону. Катион и анион объединяются в молекулу соли, а ионы Н+ и ОН‑‑ в молекулу воды:
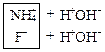 ↔
↔ 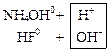
Для написания молекулярного уравнения надо сложить ионные уравнения, сократив лишние молекулы воды:
![]() ↔
↔ ![]()
Kд(HF) > Kд(NH4OH), среда в растворе слабокислая, рН < 7.
б) Соли, образованные многозарядными ионами:
![]() ↔
↔ ![]() +
+![]()
Записываются ионные уравнения по катиону и по аниону. Катион и анион объединяются в молекулу соли, а ионы Н+ и ОН‑ в молекулу воды. Остальные ионы дополняются противоионами, которые образуются при диссоциации соли
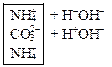 ↔
↔ 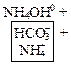
![]()
![]() ↔
↔ ![]()
![]() ↔
↔ ![]()
Kд(NH4OH) > Kд(![]() ),
среда слабощелочная, рН > 7.
),
среда слабощелочная, рН > 7.
При создании специальных условий многозарядные ионы могут гидролизоваться не только по первой, но и по следующим ступеням, хотя при обычных условиях это практически не происходит.
![]() ↔
↔ ![]() +
+![]()
![]() + HOH ↔
+ HOH ↔ ![]() +
+ ![]()
FeCl3 + HOH ↔ FeOHCl2 + HCl
![]() + HOH ↔
+ HOH ↔ ![]() +
+ ![]()
FeOHCl2 + HOH ↔ Fe(OH)2Cl + HCl
![]() +
+ ![]() ↔
↔ ![]() +
+ ![]()
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
· Полный гидролиз
Гидролиз солей, образованных очень слабым основанием и слабой летучей или нерастворимой кислотой, протекает до конца по всем стадиям и является необратимым.
Такие соли в растворах не существуют, так как полностью разлагаются водой с выпадением осадка и выделением газа.
Полному гидролизу подвергаются, например, карбонаты, сульфиды и силикаты трехвалентных металлов (Al3+, Cr3+, Fe3+).
![]() ↔
↔
![]() +
+![]()
Записываются ионные уравнения по всем стадиям:
![]() + HOH →
+ HOH →![]() +
+ ![]()
![]() + HOH →
+ HOH →![]() +
+![]()
![]() + HOH
→Al(OH)3 +
+ HOH
→Al(OH)3 +![]()
![]()
![]() + HOH →
+ HOH →![]() +
+![]()
![]() + HOH →H2S
+
+ HOH →H2S
+![]()
![]()
Затем вместе записываются суммарные ионные уравнения по катиону и аниону. Определяются множители, на которые надо домножить каждое уравнение, чтобы из катиона и аниона получить нейтральную молекулу:
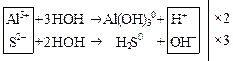
Al2S3 + ![]() → 2Al(OH)3↓ + 3H2S↑
+
→ 2Al(OH)3↓ + 3H2S↑
+ ![]()
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
При растворении сульфида алюминия в воде выпадает белый осадок гидроксида алюминия и выделяется сероводород.
Полный гидролиз происходит также при смешении растворов двух солей, гидролизующихся по противоположному типу.
При сливании растворов AlCl3 и Na2S вместо образования сульфида алюминия выпадет осадок Al(OH)3 и появится запах выделяющегося сероводорода.
Суммарное молекулярное уравнение получается при сложении уравнения обменной реакции солей с суммарным уравнением гидролиза образующегося при этом обмене Al2S3:
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
3. Значение гидролиза
Роль и практическое применение гидролиза (сообщения учащихся)
Гидролиз в природе.
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu2(OH)2CO2) – не что иное, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод (РН приблизительно равно 9) наиболее интенсивно протекает фотосинтез в морских растениях, и наиболее быстро развиваются морские животные.
Гидролиз в народном хозяйстве.
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 град С и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na2CO3 и Na3PO4 применяется для очистки воды и уменьшения ее жесткости.
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы) вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед.
Гидролиз в жизни человека
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, белков, углеводов протекают благодаря гидролизу. Одной из важнейших функций системы пищеварения является химическая переработка пищи, в результате которой сложные органические вещества превращаются в более простые. Они всасываются во внутреннюю среду, а затем используются клетками организма. Используя достаточное количество пищи, мы снабжаем себя необходимыми веществами и получаем достаточное количество энергии. Но прежде чем получить необходимые вещества, пища подвергается в организме атаке ферментов, гидролизу. И только тогда, раздробленная пища усваивается организмом.
Тест по теме «Гидролиз солей»
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
|
A |
Б |
В |
Г |
|
|
|
|
|
1. Установите соответствие между названием соли и ее отношением к гидролизу.
|
Название соли |
|
Отношение к гидролизу |
|
А) Бромид хрома (III) Б) Карбонат лития В) Сульфат железа (II) Г) Ацетат алюминия |
|
1) Гидролизуется по катиону 2) Гидролизуется по аниону 3) Гидролизуется и по катиону, и по аниону 4) Не гидролизуется |
2. Установите соответствие между формулой соли и типом ее гидролиза в водном растворе.
|
Формула соли |
|
Тип гидролиза |
|
А) Б) В) Г) |
|
1) Не гидролизуется 2) Гидролизуется по катиону 3) Гидролизуется по аниону 4) Гидролизуется и по катиону, и по аниону |
3. Установите соответствие между названием соли и отношением её к гидролизу.
|
НАЗВАНИЕ СОЛИ |
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
A) нитрат натрия Б) фосфат натрия B) сульфид калия Г) нитрат алюминия |
|
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) не гидролизуется |
4. Установите соответствие между формулой соли и отношением ее к гидролизу.
|
ФОРМУЛА СОЛИ |
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) Б) В) Г) |
|
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) не гидролизуется |
5. Установите соответствие между солью и её отношением к гидролизу.
|
ФОРМУЛА СОЛИ |
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
A) Б) B) Г) |
|
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) не гидролизуется |
6. Установите соответствие между солью и окраской лакмуса в её растворе.
|
СОЛЬ |
|
ОКРАСКА ЛАКМУСА |
|
A) Б) В) Г) |
|
1) синяя 2) красная 3) фиолетовая |
7. Установите соответствие между формулой соли и типом гидролиза этой соли.
|
ФОРМУЛА СОЛИ |
|
ТИП ГИДРОЛИЗА |
|
A) Б) B) Г) |
|
1) по катиону 2) по аниону 3) по катиону и аниону |
8. Установите соответствие между названием соли и отношением её к гидролизу.
|
НАЗВАНИЕ СОЛИ |
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
A) нитрат алюминия Б) сульфат калия B) сульфид калия Г) карбонат аммония |
|
1) гидролиз по катиону 2) гидролиз по аниону 3) гидролиз по катиону и аниону 4) гидролизу не подвергается |
9. Установите соответствие между названием соли и отношением её к гидролизу.
|
НАЗВАНИЕ СОЛИ |
|
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
|
А) нитрат натрия Б) нитрат меди (II) В) сульфит калия Г) карбонат аммония |
|
1) гидролиз по катиону 2) гидролиз по аниону 3) гидролиз по катиону и аниону 4) гидролизу не подвергается |
10. Установите соответствие между формулой соли и типом гидролиза этой соли.
|
ФОРМУЛА СОЛИ |
|
ТИП ГИДРОЛИЗА |
|
A) Б) B) Г) |
|
1) по катиону 2) по аниону 3) по катиону и аниону |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.