Модульный урок Газовые законы 10класс
Научно-исследовательская работа
docx
физика
10 кл
08.04.2019
Модульный урок " Газовые законы" для учеников хорошо подготовленных,что они сами могли изучить новую тему, а затем самостоятельно воспроизвести газовые законы и экспериментально установить зависимость между двумя термодинамическими параметрами при неизменном третьем. Для этого урока отводится 90 минут. Ученикам нравятся такие уроки
газовые законы.docx
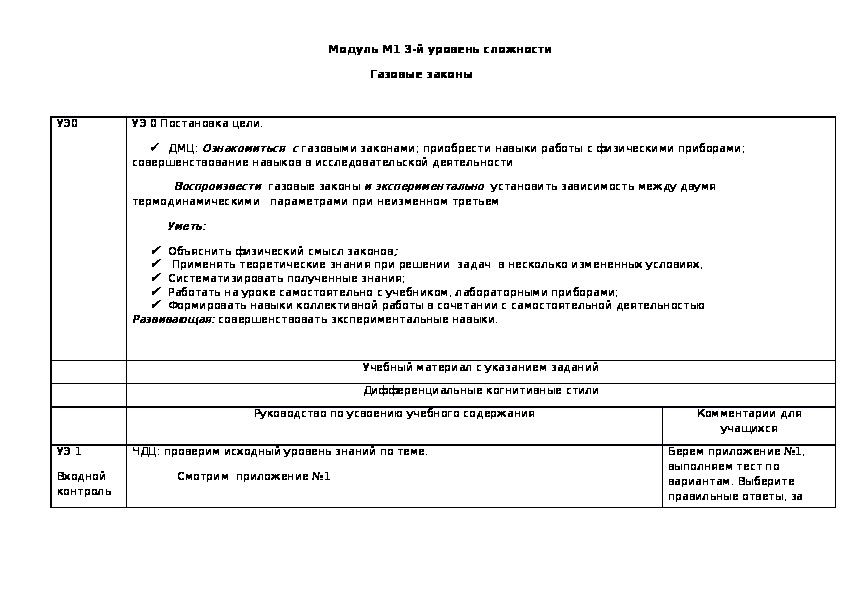
Модуль М1 3-й уровень сложности
Газовые законы
УЭ0
УЭ 0 Постановка цели.
ДМЦ: Ознакомиться с газовыми законами; приобрести навыки работы с физическими приборами;
совершенствование навыков в исследовательской деятельности
Воспроизвести газовые законы и экспериментально установить зависимость между двумя
термодинамическими параметрами при неизменном третьем
Уметь:
Объяснить физический смысл законов;
Применять теоретические знания при решении задач в несколько измененных условиях,
Систематизировать полученные знания;
Работать на уроке самостоятельно с учебником, лабораторными приборами;
Формировать навыки коллективной работы в сочетании с самостоятельной деятельностью
Развивающая: совершенствовать экспериментальные навыки.
Учебный материал с указанием заданий
Дифференциальные когнитивные стили
Руководство по усвоению учебного содержания
УЭ 1
Входной
контроль
ЧДЦ: проверим исходный уровень знаний по теме.
Смотрим приложение №1
Комментарии для
учащихся
Берем приложение №1,
выполняем тест по
вариантам. Выберите
правильные ответы, за каждый верный ответ 1
балл. Общую сумму баллов
занесите в оценочный
лист.
В процессе изучения новой
темы руководствуйтесь
данным вам планом,
непонятные вопросы
обсуждайте друг с другом
или спрашивайте у
учителя.
За выполнения задания
занесите 2 балла в
оценочный лист.
УЭ2
Изучение
нового
материала
ЧДЦ: изучить закон Бойля – Мариотта.
Откройте тетради и запишите тему урока: «Газовые законы».
Изучи § 71 (стр. 177-180)
Записать:
какой процесс называется изопроцессом?
какой процесс называется изотермическим?
Закон Бойля – Мариотта
Сделать опорный конспект
Закон Бойля – Мариотта
Т = const, процесс изотермический (Т-терма)V
1 состояние газа: p1 V1 = m RT/ M p1 V1 = p2 V2 при Т = const
2 состояние газа: p2 V2 = m RT/ M
Р V = const при Т = const
График изотермического процесса в координатах Р V
Р УЭ 3
Изучение
нового
материала
УЭ 4
Изучение
нового
материала
УЭ 5
Изучение
нового
материала
УЭ 6
Изучение
нового
материала
УЭ 7
Изучение
нового
материала
ЧДЦ: Экспериментально докажите справедливость закона Бойля Мариотта
Приложение №2
ЧДЦ: Изучить закон Гей - Люссака
Какой процесс называется изобарическим?
Сделать опорный конспект
ЧДЦ: Экспериментально докажите справедливость закона Гей - Люссака
Приложение №3
ЧДЦ: Изучить закон Шарля
Какой процесс называется изохорическим ?
Сделать опорный конспект
ЧДЦ: Экспериментально докажите справедливость закона Шарля
Приложение №4
За выполнения
экспериментального
задания занесите 5 баллов
в оценочный
За выполнения задания
занесите 2 балла в
За выполнения
экспериментального
задания занесите 5 баллов
в оценочный
За выполнения задания
занесите 2 балла в
За выполнения
экспериментального
задания занесите 5 баллов
в оценочный УЭ 8
ЧДЦ: систематизировать полученные знания
1. какие процессы изображены на графике?
2.
3. заполните таблицу пользуясь графиком.
каким законам они подчиняются?
1 вариант
За выполнения задания
занесите 5 баллов в
оценочный
Участок
графика
Какой параметр
постоянен на данном
участке
Как изменяются другие
параметры
12 23
34
41
2 вариант
Участ
ок
графи
ка
Какой параметр
постоянен на
данном участке
Как изменяются
другие параметры 12
23
34
41
УЭ 9
Закреплен
ие
изученног
о
материала
УЭ 10
Выходной
контроль
ЧДЦ: Формировать навыки коллективной работы в сочетании с самостоятельной
деятельностью обучающихся.
Задачи :
Каждая задача 3 балла
1. Газ при давлении 8атм и температура 12ºС занимает объем 855 л. Каково будет
его давление, если газ данной массы при температуре 47 ºС займет объем 800 л.
2. В баллоне емкость 26 л находится 1,1 кг азота при давлении 35атм. Определите
температуру газа.
3. Стальной баллон наполнен азотом при температуре 12 ºС. давление азота 15МПа.
Найти плотность азота при этих условиях.
ЧДЦ: проверить усвоение знаний по теме.
Задание: выполнить тестовое задание.
1 вариант
2 вариант
Выберите правильные
ответы, за каждый верный
ответ 1 балл. Общую сумму
баллов занесите в
оценочный лист.
1. Для газа данной массы произведение давления
газа на его объем постоянно, если температура газа
не меняется. Это закон:
1. Для газа данной массы отношение объема к
температуре постоянно, если давление газа не
меняется. Это закон: A. Шарля,
B. ГейЛюссака,
C. БойляМариотта.
A. Шарля,
B. ГейЛюссака,
C. БойляМариотта.
2. Какой из приведенных ниже графиков
соответствует изобарному расширению?
2. Какой из приведенных ниже графиков
соответствует процессу изотермического
расширения?
3. Какие три процесса представлены на диаграммах
рисунка?
3. Какие три процесса представлены на
диаграммах рисунка? A. Изохорный, изотермический, изобарный.
B. Изобарный, изохорный, изотермический.
C. Изохорный, изобарный, изотермический.
A. Изохорный, изотермический, изобарный,
B. Изотермический, изобарный, изохорный,
C. Изобарный, изотермический, изохорный.
4. Какое значение температуры по шкале Кельвина
соответствует температуре 1000С?
4. Универсальная газовая постоянная равна:
A. 273. К,
B. 373. К,
C. 473К.
A. 8,31 Дж / моль.*К
B. 1,38*1023Дж./ К
C. 6.02*1023моль1.
5. В сосуде объемом 8,3м3 находится 0,04 кг гелия при
температуре 1270С. Определить его давление.
5. Определите массу водорода, находящегося в
баллоне вместимостью 20 м3 под давлением 830
Па при температуре 17 0С.
A. 4*103 Па, B. 8*103 Па,
C. 16*103 Па.
A. 1,38*10 4кг,
B. 1,38*10 3кг,
C. 1,38*102кг.
УЭ 11
Подведен
ие итогов
Заполните лист контроля. Подсчитайте количество полученных баллов и оцените свою
работу.
Оценочный лист
Учебный элемент
Баллы за ответы
Заполните лист
контроля. Подсчитайте
баллы за выполнение
заданий. Поставьте себе
итоговую оценку.
33-37 - баллов-
«Отлично» «5»;
27-32 - баллов –
«Хорошо» «4»;
21-26 - баллов –
«Зачет» «3». УЭ 1
УЭ 2
УЭ 3
УЭ 4
УЭ 5
УЭ 6
УЭ 7
УЭ 8
УЭ 9
УЭ 10
Сдайте лист контроля
учителю.
Всего баллов
Приложение №1
Вариант 1
1. Как изменится давление идеального одноатомного газа при уменьшении его объема в 4 раза и увеличении абсолютной
температуры в 2раза?
А. увеличится в 8 раз; б. увеличится в 4 раза; В. увеличится в 2 раза; Г. не изменится.
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом 8,3 м3 при температуре 100º С.
А. 10 Па; Б. 830 Па; В. 100 Па; Г. 373 Па.
3. Как меняется масса воздуха в помещении, если температура увеличивается? А. уменьшается; Б. увеличивается; В. не изменяется.
4. Чему равен объем 1 моля идеального газа при нормальных условиях?
А 1 м3 Б. 24 м3 В.0,024 м3
5. В баллоне находится газ при t = 27 º С. Во сколько раз уменьшится давление газа, если 50% его выйдет из баллона, а
температура при
этом увеличится до 600 К?
6. Масса кислорода m при давлении Р занимает объем V. Как изменится температура газа, если при увеличении
давления до 2Р его
объем уменьшится в V /10?
А. увеличится в 5 раз; Б. уменьшится в 5 раз; В. не изменится.
7. В баллоне при неизменной массе газа температура увеличилась от 1 до 2 º С. Как изменилось давление?
А. увеличилось в 2 раза; Б. увеличилось в 1, 004 раза; В. не изменилось.
8. Что и по каким физическим величинам можно вычислить на основании уравнения Менделеева – Клапейрона?
1. плотность газа, используя R, р, Т, М. 2. Число молекул в газе, используя V, Т, Р, с; 3. Массу молекулы, ,
используя Т, Р, с, NА, R.
А. 1, 2, 3. Б. 1, 2; В. 1, 3.
1. Как изменится давление идеального одноатомного газа при увеличении его объема и температуры в 2раза?
Вариант 2 А. увеличится в 4 раз; б. увеличится в 2 раза; В. увеличится в 2 раза; Г. не изменится.
2. Вычислите давление водорода массой 0,02 кг в сосуде объемом 8,3 м3 при температуре 100º С.
А. 3730 Па; Б. 373 Па; В. 1000 Па
3. Как измениться плотность воздуха в помещении, если температура уменьшится?
А. не изменится. Б. уменьшится; В. увеличится.
4. Чему равны давления и температура газа при нормальных условиях?
А. р = 105 Па ·t = 100 º С 1 м3.. Б. р = 105 Па ·Т = 273 К. В. р = 105 Па ·Т = 273 К.
5. В баллоне находится газ при Т =300 К. Во сколько раз уменьшится давление газа, если 50% его выйдет из баллона, а
температура
останется неизменной?
А. уменьшится в 50 раз; Б. уменьшится в 2 раза; В. увеличится в 2 раза.
6. При нормальных условиях плотность кислорода:
А. больше плотности водорода; Б. меньше плотности водорода; В. равна плотности водорода.
7. При повышении температуры в комнате меняется:
А. давление; Б. давление и масса воздуха; В. масса воздуха.
8. В цилиндре с поршнем произошло увеличение давления газа больше допустимого за счет увеличения температуры.
Как можно
установить прежнее давление?
А. увеличением объема цилиндра или уменьшением массы газа. Б. только уменьшением массы газа
В. только увеличением объема цилиндра.
Приложение №2
Необходимо проверить, что произведение объема данной массы на его давление при постоянной температуре – величина
постоянная, т.е.
Для этого нужно воспользоваться установкой, изображенной на рисунке, используя в качестве экспериментальной
емкости пластиковую бутылку с объемом V = 1 л. здесь используется градуированный закрытый манометр и шприц
объемом 20 мл. В качестве полного внутреннего объема необходимо брать объем шприца и внутренний объем трубки
манометра до уровня находящейся в нем жидкости.
р · V = const.
1. определите полный внутренний объем системы V0 ;
2. определите величину атмосферного давления рА ;
3. уменьшить объем в шприце на 5 мл и определите. На сколько изменилось давление ∆ р;
4. проделайте опыт из п.3 несколько раз, определите величину ∆ р;
5. результаты занесите в таблицу:
Ход урока: рА = V0 =
№ ∆ р, мм.рт.ст
р = рА + ∆р,
мм.рт.ст
∆ V, мл
V = V0 - ∆ V, мл
р V
1
2
3
4
5
0
5
10
15
20
6. по полученным данным сделайте вывод о проделанной работе.
приложение № 3
« Наблюдение зависимости объема данной массы газа от температуры при постоянном давлении»
Приборы и материалы: 1) пробирка химическая, закрытая пробкой с трубкой длиной 150мм, диаметром 4-5мм; 2) стакан с
водой.
Ход работы
1. Подготовьте оборудование для опыта. Для этого опустите конец трубки с пробкой в стакан с водой на глубину 3-4
см, закройте пальцем другой конец и выньте из воды. Расположите трубку горизонтально. Осторожно закройте
пробирку пробкой так, чтобы столбик воды вылился из трубки.
воды в трубке.
прекратите нагревание воздуха в пробирке и снова в течение несколько секунд, наблюдайте за изменением
положения столбика воды в трубке.
2. нагрейте воздух в пробирке, подержав ее несколько секунд в руке. При этом наблюдайте за положением столбика
3.
4. ответьте на вопросы:
зависимость между какими величинами вы наблюдали на опыте?
Изменялись ли давление и масса воздуха в пробирке во время опыта?
Что можно сказать о зависимости объема данной массы воздуха от температуры при постоянном давлении? приложение № 4
Приборы и материалы: 1) пробирка химическая, закрытая пробкой с индикатором давления; 2) стакан с теплой водой.
Ход работы
пробирки в стакан с теплой водой.
1. Сделайте предположение о том, как будут изменяться уровни воды в коленях индикатора давления при опускании
2. Ответ проверьте на опыте.
3. Ответьте на вопросы:
Зависимость между какими величинами вы наблюдали на опыте?
Изменялась ли масса воздуха в пробирке во время опыта? Примечание. Изменением объема воздуха можно
пренебречь ввиду малости внутреннего диаметра стеклянной трубки индикатора давления.
Что можно сказать о зависимости давления данной массы воздуха от температуры при постоянном объеме?
Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
08.04.2019
Посмотрите также:
© ООО «Знанио»
С вами с 2009 года.
![]()
О портале

