
NITRO COMPOUNDS
Plan:
1. Homological series of nitro compounds. Isomerism. Nomenclature.
2. Physicochemical properties of nitro compounds.
3. Production and use of nitro compounds.
The general formula for saturated nitro compounds is СnH2n + 1NO2 or R-NO2. Isomerism of nitro compounds begins with propane derivatives. Nitro compounds are primary R - CH2-NO2, secondary R2 - CH-NO2 and tertiary R3C-NO2. They are read on hydrocarbon with the word nitro. Indicates the position of the nitrotope in numbers according to the system nomenclature.
|
СН3-NO2 |
CH3-CH2-NO2 |
CH3-CH2-CH2-NO2 |
|
|
nitromethane |
nitroethane |
nitropropane |
2-nitropropane |
Physical and chemical properties
Nitro compounds of alkanes are liquid, fragrant, slightly soluble in water, toxic, the aqueous medium reacts neutrally. Nitro compounds are polar substances, so they boil at a higher temperature than alcohols and carbonyl compounds.
The main chemical properties are related to the structure of the nitro group.
1. Primary amines are formed during the reduction of nitro compounds:
R- NO2 + 6H → R - NH2 + 2H2O
2. Primary and secondary nitro compounds dissolve in alkalis with the formation of salts, since the hydrogen atoms near the carbon atom to which the nitrotope binds are activated by the nitrotope; in an alkaline medium, the nitrotope turns into a nitro group (acidity). Then the nitrotope can be nitro and acinitro in two forms, that is, tautomeric substances.
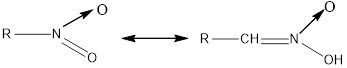
Nitro-type Aci-nitro-type

3. The activation of hydrogen atoms near the carbon atom to which the nitrotope binds can be seen in other reactions. Primary and secondary nitro compounds react with nitric acid, and tertiary ones do not react:
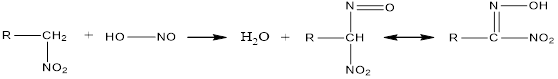
Nitric acid

pseudonitrol
Alkaline salts of nitric acid in solution turn red, pseudonitrols turn blue.
4. Primary and secondary nitro compounds react with aldehydes in the presence of alkali to form nitrocold compounds.
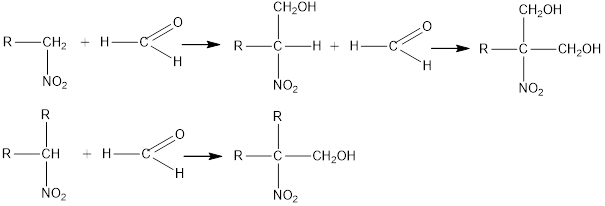
Nitromethane reacts with formaldehyde to form tri (hydroxymethyl) nitromethane O2N-C (CH2OH) 3, which is reduced to amino alcohol.
Formed H2N-C (CH2OH) 3, which is used in the manufacture of detergents and emulsifiers.
Esters of nitric acid and nitro alcohols such as O2N-C (CH2ONO2) 2 are used as explosives.
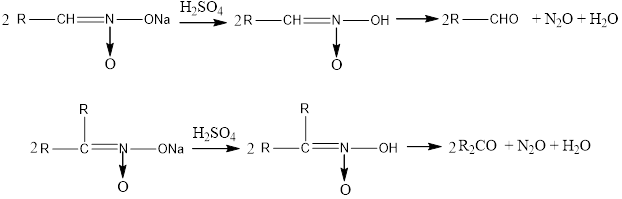
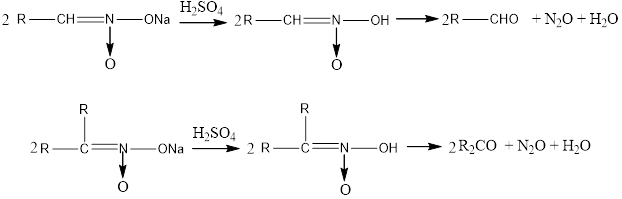
5. When the acetic salts of primary and secondary nitro compounds are exposed to mineral acids, aldehydes or ketones are formed.
6. Primary nitro compounds are converted to carboxylic acid by 85% sulfuric acid (when heated).
R-CH2-NO2Na + H2SO4 + H2O → R - COOH + NH2 - OH + NaHSO4
hydroxylamine
This method produces hydroxylamine in production.
Ways to get
1. Hydrogen atoms in hydrocarbons are converted into nitro groups, called nitration reactions (reaction of MI Konovalov).
![]()
(HNO3 + H2SO4 is a nitrating agent).
2. Obtained in the laboratory by the reaction of haloalkanes with nitrites:
С6Н5СН2Сl + NaNO2 → C6H5CH2NO2 + NaCl
Request
Nitroparaffins are used as solvents in the production of aldehydes, acids, explosives, and also as solvents in the production of rubber (vulcanizers) and plastics.
НИТРОҚОСЫЛЫСТАР
Жоспары:
1. Нитроқосылыстардың гомологтық қатары. Изомериясы. Номенклатурасы.
2. Нитроқосылыстардың физикалық және химиялық қасиеттер
3. Нитроқосылыстардың алынуы мен қолданылуы.
Қаныққан нитроқосылыстардың жалпы формуласы СnH2n+1NO2 не R-NO2. Нитроқосылыстардың изомериясы пропан туындыларынан басталады. Нитроқосылыстар біріншілік R – СН2-NO2, екіншілік R2 – СН-NO2 және үшіншілік R3С-NO2 болады. Оларды нитро-деген сөз қосып көмірсутек бойынша оқиды. Жүйелік номенклатура бойынша нитротоптың орнын цифрмен көрсетеді.
|
СН3-NO2 |
CH3-CH2-NO2 |
CH3-CH2-CH2-NO2 |
|
|
нитрометан |
нитроэтан |
нитропропан |
2-нитропропан |
Физикалық және химиялық қасиеттері
Алкандардың нитроқосылыстары сұйық, әдемі иісті, суда аз ериді, улы, сулы ортасы бейтарап реакция көрсетеді. Нитроқосылыстар-полярлы заттар,сондықтан спирттер мен карбонил қосылыстарына қарағанда жоғарырақ температурада қайнайды.
Негізгі химиялық қасиеттері нитротоптың структурасымен байланысты.
1. Нитроқосылыстар тотықсызданғанда біріншілік аминдер түзеді:
R- NO2 + 6H → R - NН2 + 2Н2О
2. Біріншілік және екіншілік нитроқосылыстар сілтілерде еріп тұз түзеді, себебі нитротоп байланысып тұрған көміртегі атомы жанындағы сутегі атомдары нитротоп әсерінен активтеледі, сілтілік ортада нитротоп аци-нитро-түрге айналады (қышқылдық). Сонда нитротоп екі түрде нитро-және аци-нитро-бола алады, яғни таутомерлі заттар.
|
|
|
|
Нитро-түрі |
Аци-нитро-түрі |

3. Нитротоп байланысып тұрған көміртегі атомы жанындағы сутегі атомдарының активтелетіндігін басқа реакциялардан да көруге болады. Біріншілік және екіншілік нитроқосылыстар азотты қышқылмен әрекеттеседі, ал үшіншілік-әрекеттеспейді:

нитрол қышқылы

псевдонитрол
Нитрол қышқылдарының сілтілік тұздары ерітіндіде қызыл түсті, псевдонитролдар-көк түске боялады.
4. Біріншілік және екіншілік нитроқосылыстар сілті қатысында альдегидтермен әрекеттесіп, нитроспирттер түзеді.
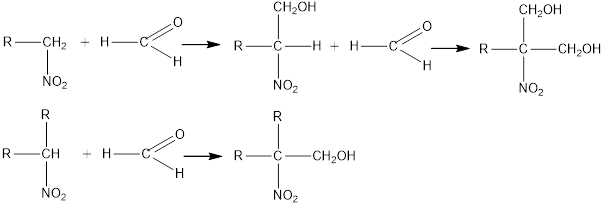
Нитрометан формальдегидпен әрекеттесіп три (оксиметил) нитрометан О2N-C(CH2OH)3 түзеді, оны тотықсыздандырса, амино-спирт
Н2N-C(CH2OH)3 түзіледі, ол жуғыш заттар мен эмульгаторлар өндірісінде қолданылады.
Нитроспирттердің азотқышқылды эфирлері, мысалы, О2N-C(CH2ONO2)2 қопарылғыш зат ретінде қолданылады.
5. Біріншілік және екіншілік нитроқосылыстардың аци-түрдегі тұздарына минералды қышқылдармен әсер етсе, альдегидтер не кетондар түзіледі.
6. Біріншілік нитроқосылыстар 85%-ті күкірт қышқылымен (қыздырғанда) карбон қышқылына айналады.
R-CH2-NО2Na + H2SO4 + Н2О → R – CООH + NН2 - OН + NaHSO4
гидроксиламин
Осы әдіс бойынша өндірісте гидроксиламинді алады.
Алу жолдары
1. Көмірсутектердегі сутегі атомдары нитротопқа алмасады, нитрлеу реакциясы деп аталады (Коновалов М.И.реакциясы)
![]()
(НNO3 + H2SO4 – нитрлеуші агент).
2.Зертханада галогеналкандар мен нитриттер арасындағы реакция арқылы алады:
С6Н5СН2Сl + NaNO2 → C6H5CH2NO2 + NaCl
Қолданылуы
Альдегидтерді, қышқылдарды, қопарылғыш заттарды алғанда нитропарафиндер техникада еріткіштер ретінде қолданылады, сонымен бірге еріткіштер ретінде резенке өндірісінде (вулканизаторлар), пластмассалар алуда қоланылады.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.